复方苦参汤通过调节肠道Th1及Th17细胞分化缓解溃疡性结肠炎肠道损伤*
朱 凤, 韦春珠, 范 恒, 刘星星
华中科技大学同济医学院附属协和医院中西医结合科,武汉 430022
溃疡性结肠炎(ulcerative colitis,UC)是消化系统疾病中比较多发的疾病,其病变部位主要在结直肠的黏膜和黏膜下层,是一种慢性炎症性疾病[1]。UC的特点是病情反复,难以痊愈。虽然目前对UC的研究有很多,但其发病原因及机制非常复杂,因此,在治疗上有很大困难。糖皮质激素、氨基水杨酸以及免疫抑制剂等都是临床治疗UC的常用药物,但对部分患者疗效不理想,且有一定的副作用。UC的反复发作加重患者身心负担[2],因此迫切需要找到新的治疗方法。
辅助性T细胞的过度增殖和促炎细胞因子的释放是影响结肠炎发生发展的重要因素。大量的研究表明,肠道内的免疫稳态取决于CD4+T细胞的调节和平衡[3]。高度活化的T细胞,尤其是Th1[主要分泌γ干扰素(interferon γ,IFNγ)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)]和Th17[主要分泌白介素17A(interleukin-17A,IL-17A),其功能与转录因子维甲酸相关孤儿受体(RORγt)密切相关]在结肠炎模型动物中表现出关键的致病作用[4],因此抑制Th1/Th17反应有望改善UC[5]。
目前,应用中西医结合方法治疗UC是大势所趋。复方苦参汤由苦参、地榆炭、白芨等药物组成,在清热燥湿解毒上有很好的作用。此复方合剂为我院院内制剂,在临床上结合西药对UC患者有良好的治疗效果[6],也利用动物实验开展了较多研究[7-9],本实验主要探究复方苦参汤通过影响T细胞分化及相关细胞因子表达来缓解UC肠黏膜损伤的作用。
1 材料与方法
1.1 实验动物
32只7~8周龄(18~22 g)SPF级健康雄性C57小鼠,由华中科技大学同济医学院附属协和医院动物实验中心提供并饲养,自由饮食,动物合格证号为SCXK(j)2016-0002,许可证号为SYXK(鄂)2016-0057。本研究所有涉及动物及其护理的程序都严格遵守华中科技大学实验动物管理及伦理委员会的相关章程,并得到华中科技大学动物保护和使用委员会(IACUC)的批准。
1.2 试剂与仪器
复方苦参汤由苦参15 g、地榆炭15 g、青黛3 g、白芨10 g、三七粉3 g、甘草10 g组成,药物购自华中科技大学同济医学院附属协和医院中药房。先将药物用双蒸水浸泡0.5 h,第一煎加入药物8倍水量,煮沸后小火煎煮60 min,倒出剩余液体;第二煎加入药物5倍水,煮沸后继续小火煎煮60 min,将前两煎剩余药液合并过滤后继续煎煮浓缩至0.728 g/mL,置于4℃冰箱储存备用。美沙拉嗪缓释颗粒购自上海爱的发制药有限公司,0.5 g/袋。3%葡聚糖硫酸钠(DSS)购自美国MP Biomedicals公司,RNA逆转录试剂及实时荧光定量PCR试剂均购自南京诺唯赞生物技术有限公司。所用引物均由湖北百奥斯生物科技有限公司设计合成。ELISA试剂盒(IL-17A、IFNγ、TNF-α)购自武汉华联科生物有限公司。流式抗体及试剂anti-CD4 antibody(货号:552775)、anti-IFNγ antibody(货号:554413)、anti-RORγt antibody(货号:562682)、Transcription Factor Buffer Set(货号:562574)、Cytofix/Cytoperm Soln Kit(货号:554714)、Phorbol 12-myristate 13-acetate(PMA)(货号:19652581)、Ionomycin Calcium Salt(货号:5608212)均购自上海优宁维技术有限公司。
荧光定量PCR仪(美国Life Technologies公司),光学显微镜(奥林巴斯,CKX53),电动匀浆器(Servicebio公司),酶标仪(美国Molecular Devices,CMAX PLUS),流式细胞仪(美国Becton Dickinson公司)。
1.3 实验方法
1.3.1 动物模型复制与分组 将适应性喂养7 d的C57小鼠随机分成4组(每组8只):正常对照组、模型组、复方苦参汤组及美沙拉嗪组。除正常对照组外,其余各组给予3%DSS自由饮用7 d,复制UC动物模型。造模成功的表现为腹泻、黏液脓血便及体重降低[10]。自造模的第1天起,复方苦参汤组及美沙拉嗪组分别以复方苦参汤(0.1 mL/10 g)及美沙拉嗪(0.52 g/kg)[11]灌胃治疗,余下两组予以等量PBS灌胃,持续给药7 d。造模时所用复方苦参汤给药剂量根据“人和动物按体表面积折算的等效剂量比值表”折算(临床治疗70 kg体质量的患者,每日服复方苦参汤按生药量计为56 g),美沙拉嗪灌胃溶液剂量按成人70 kg体重∶小鼠20 g体重=1∶0.0025折算。从造模第1天开始,每天观察小鼠一般情况,例如大小便颜色及质地、体重变化等。第8天处死所有动物,从回盲部截取小鼠全部结直肠组织,测量长度后纵行剖开,用PBS清洗干净后,取部分组织用甲醛固定,剩余部分于-80℃冰箱保存备用。
1.3.2 疾病活动指数评分(disease activity index,DAI) 在小鼠造模及给药治疗期间,每天称量小鼠体重,观察粪便性质及肉眼血便情况并做好记录,小鼠DAI评分标准参照文献[12]。
1.3.3 结肠组织病理学检测 在4%多聚甲醛溶液中固定48 h后的结肠组织进行石蜡包埋,切片后脱蜡至水,苏木精-伊红(HE)染色,镜下观察。
1.3.4 实时荧光定量PCR(qRT-PCR) qRT-PCR检测小鼠结肠组织中IFNγ、IL-17A和RORγt等的mRNA含量。称取小鼠结肠组织约40 mg,用RNA提取液等试剂提取总RNA,测定浓度,根据浓度调整上样量,按照试剂盒说明书先去除基因组,再将RNA逆转录为cDNA后进行扩增。其在转录水平的表达量按照公式2-ΔΔCt计算。各引物信息见表1。

表1 用于定量PCR的各引物序列信息Table 1 Sequence information of each primer used for qRT-PCR
1.3.5 酶联免疫吸附实验(ELISA) ELISA检测各组小鼠结肠组织中IFNγ、TNF-α和IL-17A的含量。取各组小鼠结肠组织进行匀浆,得上清,IFNγ、TNF-α和IL-17A的组织表达量根据ELISA试剂盒说明书步骤进行检测。在酶标仪上检测450 nm处吸光度值(A450 nm),并作标准曲线,按照标准曲线计算浓度。
1.3.6 流式细胞术 流式细胞术检测各组小鼠脾脏及肠系膜淋巴结中IFNγ及RORγt表达阳性细胞占比的变化。取小鼠脾脏及肠系膜淋巴结,研磨、过滤、离心,得到单核细胞,一部分直接染色:在96孔V底板中加入1×106~2×106个细胞,4℃ 1500 r/min离心5 min,弃上清;将anti-CD4-FITC抗体及anti-FVD-BV510抗体稀释在FACS buffer中,配置抗体混合液;向每孔细胞中加入50 μL抗体混合液,4℃避光孵育30 min;再加入内染抗体anti-RORγt-PB450 50 μL,4℃避光孵育30 min;洗涤、离心、弃上清,以200 μL FACS buffer重悬细胞,200目纱布过滤后上机检测。另外一部分细胞种在96孔U底板中,用佛波酯(PMA)、离子霉素(ionomycin calcium salt)及高尔基体蛋白转运抑制剂(Brefeldin A,BFA)刺激细胞后进行上述表染标记anti-CD4-FITC抗体及anti-FVD-BV510抗体;固定穿膜后加入50 μL稀释的内染抗体anti-IFNγ-APC,4℃避光孵育30 min;洗涤、离心后以200 μL FACS buffer重悬细胞,经200目纱网过滤至流式管后上机检测。
1.4 统计学方法

2 结果
2.1 各组小鼠DAI评分及结肠长度
如图1A所示,与对照组比较,造模各组DAI评分明显升高,说明造模成功;与模型组比较,复方苦参汤组及美沙拉嗪组在药物治疗后第4天开始,DAI评分均有不同程度下降。测量各组小鼠结肠长度(图1B、1C),与对照组比较,模型组小鼠的结肠长度显著缩短;与模型组比较,两个给药组的结肠长度均有不同程度增加。

1:正常对照组;2:模型组;3:复方苦参汤组;4:美沙拉嗪组;与模型组比较,**P<0.01 图1 各组小鼠DAI评分(A)和结肠长度测量(B)与统计(C)Fig.1 DAI score(A),detection(B)and statistics(C)of colon length of mice in each experimental group
2.2 各组小鼠结肠组织病理变化
各组小鼠结肠组织HE染色结果如图2,可见对照组小鼠结肠黏膜完整,腺体排列整齐,无炎性细胞浸润及溃疡形成;模型组可见大量炎性细胞浸润及溃疡,杯状细胞明显减少,腺体排列紊乱等炎症损伤改变;复方苦参汤组及美沙拉嗪组小鼠的结肠损伤均有不同程度减轻。

图2 各组小鼠结肠组织病理学改变(苏木精-伊红染色,×200)Fig.2 Histopathological changes in colon tissues of mice in each group(HE staining,×200)
2.3 各组小鼠结肠组织中IFNγ、IL-17A和RORγt mRNA水平变化
Th1主要分泌细胞因子IFNγ,Th17主要分泌细胞因子IL-17A并表达转录因子RORγt,因此检测了各组细胞因子及转录因子mRNA含量,结果见图3。与正常对照组相比,模型组结肠组织IFNγ、IL-17A和RORγt的mRNA水平显著升高;而与模型组比较,复方苦参汤组结肠组织中IFNγ、IL-17A和RORγt的mRNA水平显著降低(均P<0.01)。

1:正常对照组;2:模型组;3:复方苦参汤组;4:美沙拉嗪组;与模型组比较,**P<0.01图3 qRT-PCR检测各组小鼠结肠组织IFNγ(A)、IL-17A(B)和RORγt(C)的mRNA表达Fig.3 qRT-PCR detection of mRNA expression of IFNγ(A),IL-17A(B)and RORγt(C)in colon tissues of mice in each group
2.4 各组小鼠结肠组织中IFNγ、TNF-α、IL-17A等蛋白含量变化
通过ELISA方法检测了结肠组织IFNγ、TNF-α和IL-17A的蛋白含量变化,结果见图4。与正常对照组比较,模型组IFNγ、TNF-α和IL-17A蛋白表达水平显著升高;与模型组比较,复方苦参汤组结肠组织IFNγ(P<0.01)、TNF-α(P<0.05)和IL-17A(P<0.05)表达量降低。

1:正常对照组;2:模型组;3:复方苦参汤组;4:美沙拉嗪组;与模型组比较,*P<0.05 **P<0.01 图4 ELISA检测各组小鼠结肠组织IFNγ(A)、TNF-α(B)和IL-17A(C)蛋白含量Fig.4 ELISA detection of IFNγ(A),TNF-α(B)and IL-17A(C)protein content in colon tissues of mice in each group
2.5 小鼠脾脏及肠系膜淋巴结中Th1和Th17细胞比例变化
图5为流式细胞术检测各组小鼠脾脏及淋巴结Th1细胞比例情况。结果显示,与正常对照组比较,模型组脾脏及淋巴结CD4+IFNγ+细胞占CD4+T细胞比例显著升高(P<0.01);与模型组相比,复方苦参汤组CD4+IFNγ+细胞占CD4+T细胞比例显著降低(P<0.01)。图6为流式细胞术检测各组小鼠脾脏及淋巴结Th17细胞比例情况。结果显示,相对于正常对照组,模型组脾脏及淋巴结CD4+RORγt+占CD4+T细胞比例明显升高(P<0.01);与模型组相比,复方苦参汤组CD4+RORγt+占CD4+T细胞比例显著降低(P<0.01)。
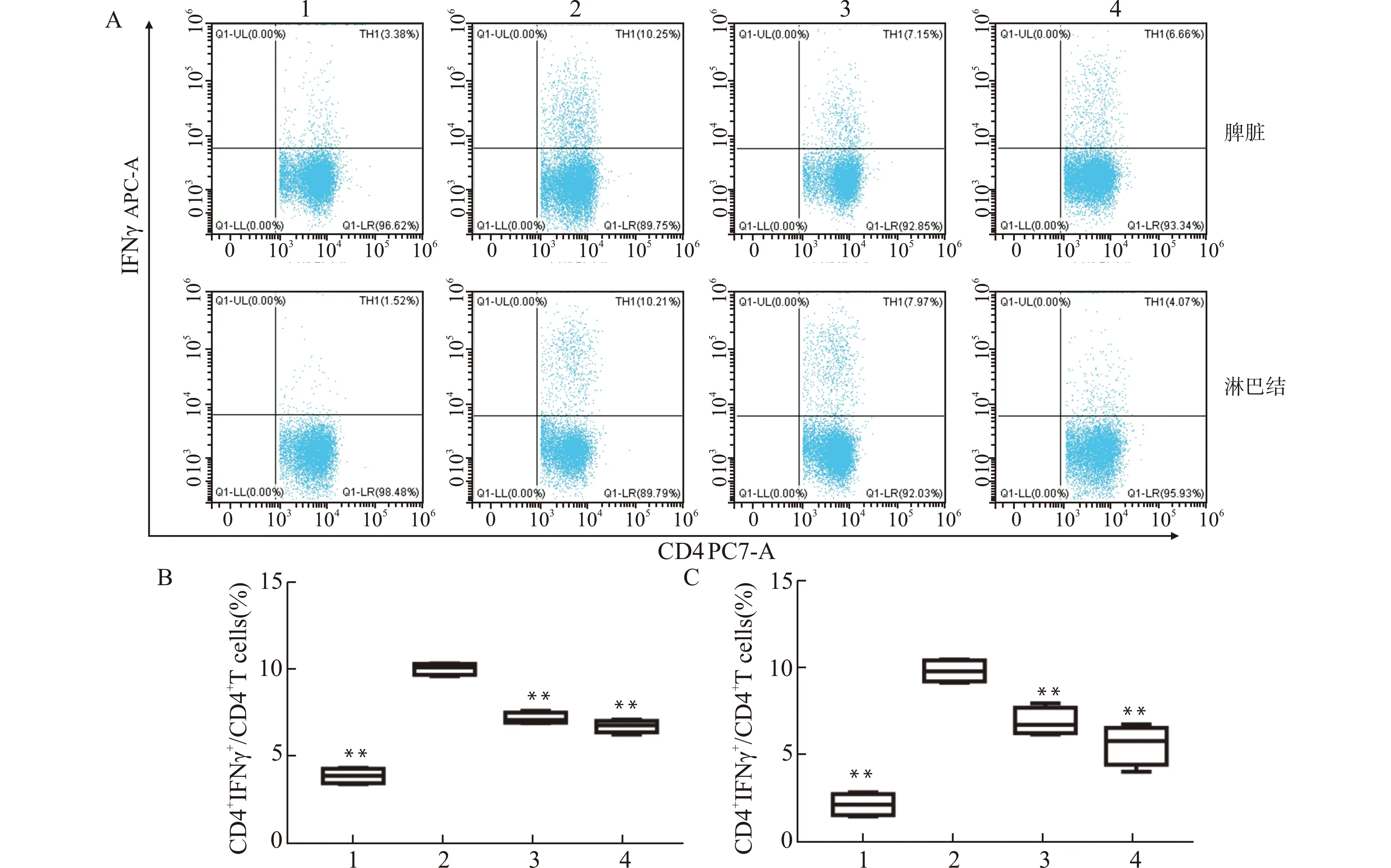
A:流式图;B:脾脏Th1细胞比例统计;C:淋巴结Th1细胞比例统计;1:正常对照组;2:模型组;3:复方苦参汤组;4:美沙拉嗪组;与模型组比较,**P<0.01 图5 流式细胞术检测各组小鼠脾脏及淋巴结Th1细胞比例Fig.5 Detection of Th1 cells in spleen and lymph nodes of each group by flow cytometry
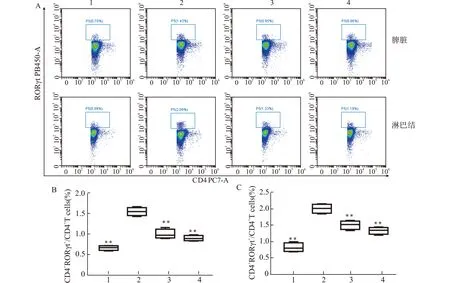
A:流式图;B:脾脏Th17细胞比例统计;C:淋巴结Th17细胞比例统计;1:正常对照组;2:模型组;3:复方苦参汤组;4:美沙拉嗪组;与模型组比较,**P<0.01 图6 流式细胞术检测各组小鼠脾脏及淋巴结Th17细胞比例Fig.6 Detection of Th17 cells in spleen and lymph nodes of each group by flow cytometry
3 讨论
目前普遍认为UC的发病机制是由遗传、免疫、环境因素和肠道菌群共同作用,激活肠道黏膜的免疫应答而引发的炎症反应[13]。T淋巴细胞主要在胸腺中发育成熟,并分化成为CD4+和CD8+T淋巴细胞,其中CD4+T细胞在细胞免疫中发挥重要作用。有研究显示CD4+T淋巴细胞耗竭和阻断抗体可以缓解克罗恩病和UC患者症状,表明CD4+T淋巴细胞在炎症性肠病发生发展中具有重要作用[14-15]。
CD4+T细胞根据不同功能又分为Th1、Th2、Th17及Treg细胞,其中Th1及Th17细胞在肠黏膜免疫中有重要屏障作用,在驱动自身免疫性反应中有不可替代的作用,当它们被激活时通常会加重疾病的进展。Th1细胞产生IFN-γ和TNF,而Th17细胞的功能主要由表达IL-17的能力决定。有许多研究[16-19]发现活动期UC患者Th1及Th17细胞因子IFN-γ、IL-17A异常高表达。因此,对Th1及Th17的研究是非常有必要的。
本课题组经过长期的临床应用及实验研究发现,复方苦参汤在UC患者及动物模型中都可以有效缓解结肠黏膜损伤。为进一步研究其作用机制,本实验通过流式细胞术检测脾脏及肠系膜淋巴结中Th1及Th17细胞占CD4+T细胞的比例,并通过qRT-PCR及ELISA对结肠组织中IFNγ、TNF-α、IL-17A及RORγt的表达水平进行检测。结果表明,与正常组相比,模型组IFNγ、TNF-α、IL-17A及RORγt表达水平显著升高;复方苦参汤及美沙拉嗪处理可显著降低UC模型小鼠Th1及Th17比例及相关因子表达。因此,我们得出结论,复方苦参汤可通过调节肠道Th1及Th17细胞的分化及功能有效降低DSS诱导的UC小鼠结肠黏膜损伤。
UC发病机制至今仍未阐明,影响疾病发生发展的因素众多,因此对于UC的治疗非常棘手。中医治疗UC可以根据患者情况辨证论治和开展个体化治疗,针对不同证型进行精准治疗。随着基础研究的深入,大量实验研究揭示中药复方及相应有效成分对UC部分信号通路有潜在靶向作用[20]。由此可见,中药在治疗UC上有巨大潜力,值得深入研究。

