超声处理对藜麦分离蛋白功能特性和微观结构的影响
尹丽莎,朱莹莹,2,3,董吉林,2,3,申瑞玲,2,3
1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001;2.食品生产与安全河南省协同创新中心,河南 郑州 450001;3.河南省冷链食品质量安全控制重点实验室,河南 郑州 450001
0 引言
藜麦,原产于南美洲安第斯山脉的中高海拔山区,作为印第安人的一种传统主食,具有营养素均衡、易熟、易消化等特点。联合国粮食及农业组织(FAO)认定藜麦是可以满足人类所需全部营养的单作物粮食,其蛋白质含量丰富,氨基酸比例均衡,且包含人体所需的全部必需氨基酸[1]。与大多数谷物相比,藜麦蛋白的品质更接近乳类和肉类,是一种优质可持续性的植物蛋白资源[2],可作为食品工业的功能性成分原料,生产可食用的薄膜、饮料、酱汁、香肠等[3]。
藜麦蛋白的功能特性决定了其应用前景。研究表明[4],藜麦蛋白表现出良好的乳化稳定性,但其乳化能力较差,且溶解性不佳。目前,有多种物理技术被用于改性植物蛋白,以改善其功能特性。其中,超声处理是一种常用的食品大分子改性技术,具有高效、绿色、可持续等特点。孙燕婷等[5]研究发现,超声处理(功率为500 W)大豆蛋白5 min,能够显著提高其溶解性和乳化活性;徐珍霞等[6]利用超声技术对亚麻籽蛋白进行改性发现,超声处理(功率为360 W)亚麻籽蛋白乳液30 min,可明显提高其稳定性及凝胶特性。此外,超声处理对植物蛋白微观结构也有一定影响:望运滔等[7]研究发现,经超声改性处理后的鹰嘴豆蛋白的α-螺旋含量升高、β-折叠含量降低;A.Vera等[8]使用超声技术改性藜麦蛋白后发现,高强度(功率>500 W)超声处理虽能改变藜麦蛋白结构,降低其平均粒径,但却容易形成较大蛋白聚集体颗粒,增加藜麦蛋白浊度。
鉴于此,本研究拟以藜麦为原料,采用传统碱溶酸沉法提取藜麦分离蛋白(QPI),研究功率为500 W的中强度超声处理对QPI功能特性和微观结构的影响,以期为藜麦蛋白的加工和应用提供理论参考。
1 材料与方法
1.1 主要材料与试剂
藜麦(青藜2号),青海省农科院提供;花生油,山东鲁花集团有限公司产;十二烷基硫酸钠(SDS)、HCl、NaOH等试剂,均为分析纯,购自天津市风船化学试剂科技有限公司。
1.2 主要仪器与设备
D5A-WS型台式低速离心机,湖南湘怡实验室仪器开发有限公司产;K9840型自动凯氏定氮仪,济南海能仪器有限公司产;SCIENTZ-10N型冷冻干燥机,北京博医康实验仪器有限公司产;SB-25-12D型超声仪,宁波新芝生物科技股份有限公司产;Multiskan GO1510型全波长酶标仪,美国Thermo公司产;S3500型激光粒度仪,美国Microtrac公司产;JSM-76490LV型扫描电子显微镜(SEM),日本JEOL公司产。
1.3 QPI的提取和超声处理
1.3.1QPI的提取将藜麦烘干、磨粉后过60目筛,备用。参考毕爽等[9]的传统碱溶酸沉法,主要提取步骤是:将藜麦粉分散于水中(m(藜麦粉/g)∶V(水/mL)=1∶12),用1 mol/L的NaOH溶液调节pH值至9.5,于35 ℃条件下振荡提取2.0 h后,静置1.0 h,于4000 r/min条件下离心20 min,取上清液;用1 mol/L HCl溶液调节上清液pH值至4.5,静置4.0 h,于4000 r/min条件下离心20 min,得到藜麦蛋白沉淀;将藜麦蛋白沉淀用蒸馏水反复水洗至中性,冷冻干燥后粉碎,即得QPI,于4 ℃冰箱保存,备用。
1.3.2QPI的超声处理将提取的QPI粉末充分分散于蒸馏水中,制备QPI悬浮液(50 mg/mL),于室温下温和搅拌过夜。对5组QPI悬浮液(100 mL)于室温下用500 W超声强度进行超声改性处理,将超声处理时间分别设置为20 min、40 min、60 min、80 min和100 min。超声处理后将样品冷冻干燥,并于4 ℃冰箱保存,待用。
1.4 QPI的品质分析
1.4.1QPI的纯度测定根据GB 5009.5—2016[10]测定QPI的纯度。
1.4.2QPI的蛋白组分测定参考田旭静等[11]的方法测定QPI的蛋白组分。
1)清蛋白含量的测定。称取1.0 g QPI,加入20 mL蒸馏水,于45 ℃条件下搅拌1.0 h后,于4000 r/min条件下离心20 min,取上清液,于25 mL容量瓶中定容,采用凯氏定氮法测定清蛋白含量;沉淀用蒸馏水洗涤后,作为后续实验的原料。
2)球蛋白含量的测定。向清蛋白提取后的沉淀中加入质量分数为2%的NaCl溶液20 mL,于45 ℃条件下搅拌1.0 h,后续操作同上,测得球蛋白含量;沉淀用蒸馏水洗涤后,作为后续实验的原料。
3)醇溶蛋白含量的测定。向球蛋白提取后的沉淀中加入体积分数为70%的乙醇溶液20 mL,于50 ℃条件下搅拌30 min,后续操作同上,测得醇溶蛋白含量;沉淀用蒸馏水洗涤后,作为后续实验的原料。
4)谷蛋白含量的测定。向醇溶蛋白提取后的沉淀中加入0.05 mol/L 的NaOH溶液20 mL,于50 ℃条件下搅拌1.0 h,后续操作同上,测得谷蛋白含量;剩余蛋白即为不可溶蛋白。
1.5 QPI功能特性的测定
1.5.1 溶解度将各组样品与去离子水(m(样品/g)∶V(去离子水/mL)=1∶100)混合得到QPI悬浮液,并于室温下搅拌1.0 h后,于3500 r/min条件下离心20 min,测定上清液蛋白含量。溶解度[12]计算公式如下:
溶解度=(W1×m1)/(W2×m2)×100%
其中,W1是上清液蛋白含量/%;m1是上清液质量/g;W2是分离蛋白含量/%;m2是分离蛋白质量/g。
1.5.2 持水性和持油性称取0.5 g样品置于10 mL离心管中,称重,加入4 mL蒸馏水/花生油,漩涡振动5 min使其混合均匀,室温下静置1.0 h后,于4000 r/min条件下离心20 min,将上清液移除。测样品持水性时,用滤纸吸干离心管壁残留水分,再称重;测样品持油性时,用滤纸吸干离心管壁残留油滴,再称重。持水性[13]和持油性[14]的计算公式均如下:
参数值=(W2-W1)/W0
其中,W0是蛋白质量/g;W1是离心管和蛋白质量/g;W2是去掉上清液后离心管和蛋白质量/g。
1.5.3 乳化性和乳化稳定性取5 mL花生油和15 mL质量浓度为5 mg/mL的分离蛋白溶液,混匀,用均质机于10 000 r/min条件下分散2 min;分散结束后,立即(0 min)从得到的溶液底部取50 μL乳浊液,加入5 mL质量分数为0.1%的SDS溶液,混匀,在波长为500 nm处测其吸光度;10 min后,重复上述操作。乳化性和乳化稳定性[15]的计算公式如下:
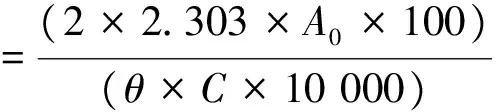
乳化稳定性=A10/A0×100%
其中,A0是0 min时的吸光度;A10是10 min时的吸光度;θ是油相体积分数,为0.25;C是蛋白样品质量浓度/(g·mL-1)。
1.6 QPI平均粒径与分布的测定
参照C.M.Liu等[16]的方法,使用激光粒度仪对样品的粒径与分布进行测定。
1.7 QPI微观结构的测定
采用导电胶将超声处理前后的QPI样品(已冻干)粘附于金属铜座上,置于真空喷镀仪器内,将样品表面喷金使其导电[17]。采用SEM在低真空模式、20 kV电压下对QPI样品进行扫描。
1.8 数据分析
使用SPSS 20.0软件进行显著差异分析(P<0.05),采用Origin 2018软件进行作图。
2 结果与分析
2.1 QPI的组成分析
QPI的近似组成如表1所示。实验所得QPI的纯度为87.78%,高于王棐等[18]对QPI的提取纯度78.30%,这可能与QPI提取工艺方法有关。QPI的组成分析结果显示,总蛋白由清蛋白、球蛋白、醇溶蛋白、谷蛋白和不可溶蛋白组成,其中清蛋白和球蛋白含量较高,两者含量之和高达60%以上,而醇溶蛋白和谷蛋白的含量较低,这与王棐[19]的研究结果一致。
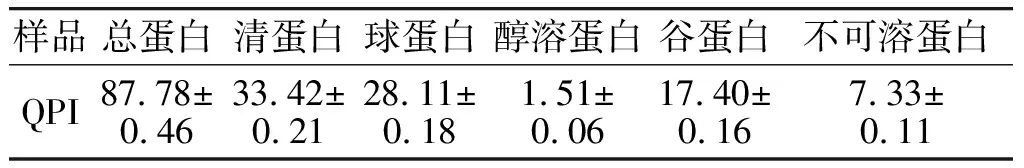
表1 QPI的近似组成(湿重)Table 1 Approximate composition of QPI (wet weight) %
2.2 超声处理对QPI功能特性的影响分析
2.2.1 超声处理对溶解度的影响不同超声处理时间对溶解度的影响如图1所示。由图1可以看出,超声处理时间为20~60 min时,QPI的溶解度随超声处理时间的延长而增高;超声处理时间为60 min时,溶解度最高,达78.25%,这与谢为峰等[20]的研究结果一致。这是因为蛋白质的构象在超声波的作用下发生改变,亲水基团暴露在外,与水分子结合能力增强,提高了蛋白质的溶解度。但随着超声处理时间的继续延长(>60 min),蛋白质分子的空间结构破坏程度较大,导致蛋白质变性,溶解度降低[21]。
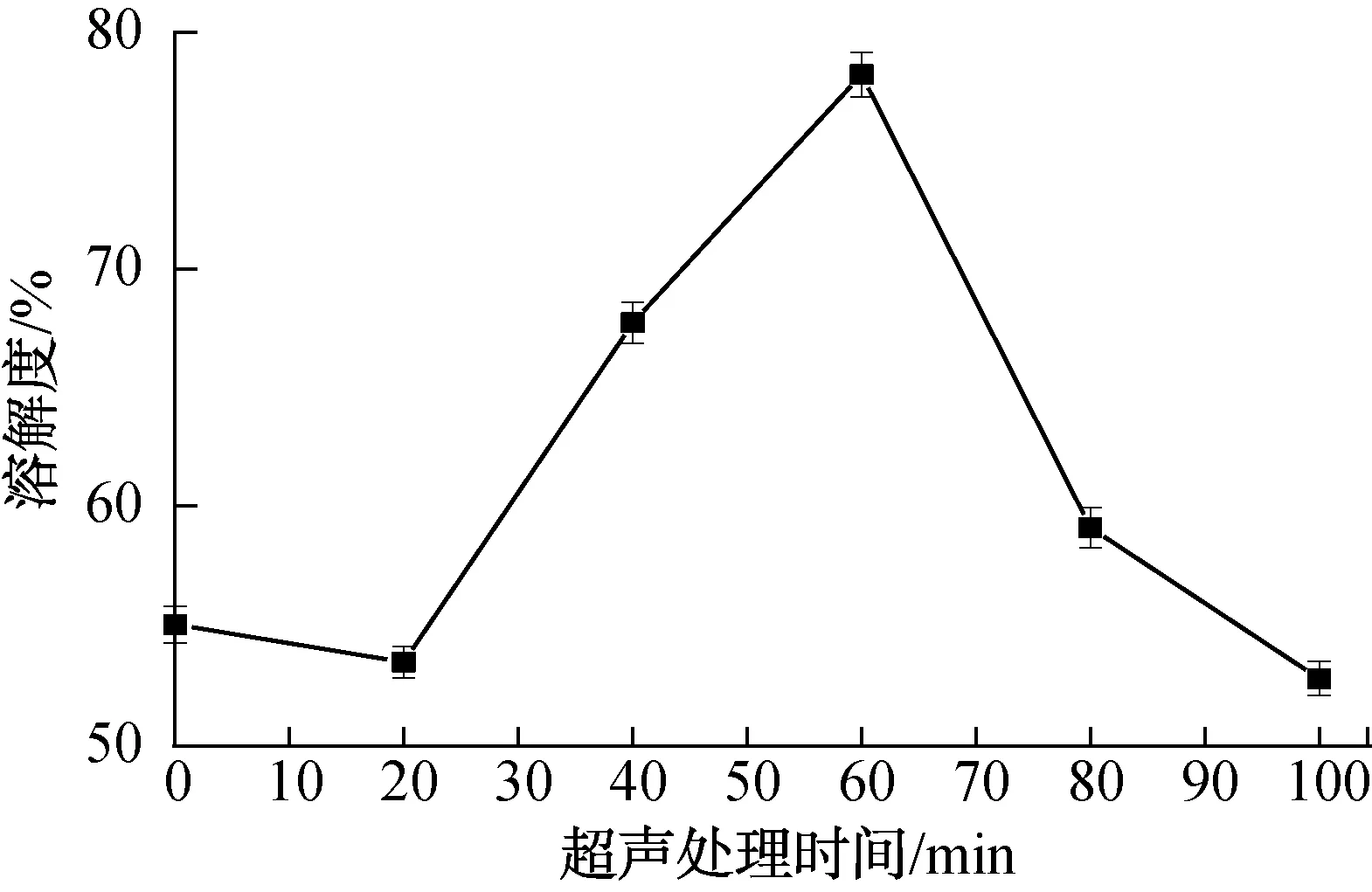
图1 不同超声处理时间对溶解度的影响Fig.1 The effect of different ultrasonic treatment time on solubility
2.2.2 超声处理对持水性和持油性的影响持水性和持油性是食品加工中的重要特征和品控指标。不同超声处理时间对持水性和持油性的影响如图2所示。由图2可以看出,不同超声处理时间对QPI的持水性和持油性的影响趋势几乎相同。QPI的持水性和持油性均随超声处理时间的延长而逐渐增大,在超声处理时间为20~60 min时增长速率较快,在超声处理时间为60~100 min时增长速率缓慢但未停止,如果继续延长超声处理时间,QPI的持水性和持油性很有可能会超过未进行超声处理的QPI,这与张洪新[22]改性面筋蛋白的研究结果相似。这是因为在超声波处理下,蛋白质颗粒变小,组织疏松,比表面积增大;同时,蛋白质空间结构遭到破坏,埋藏在分子内部的二硫基、疏水基等功能基团暴露出来,使样品吸附和结合脂类物质的能力更强,从而增强了QPI的持水性和持油性。
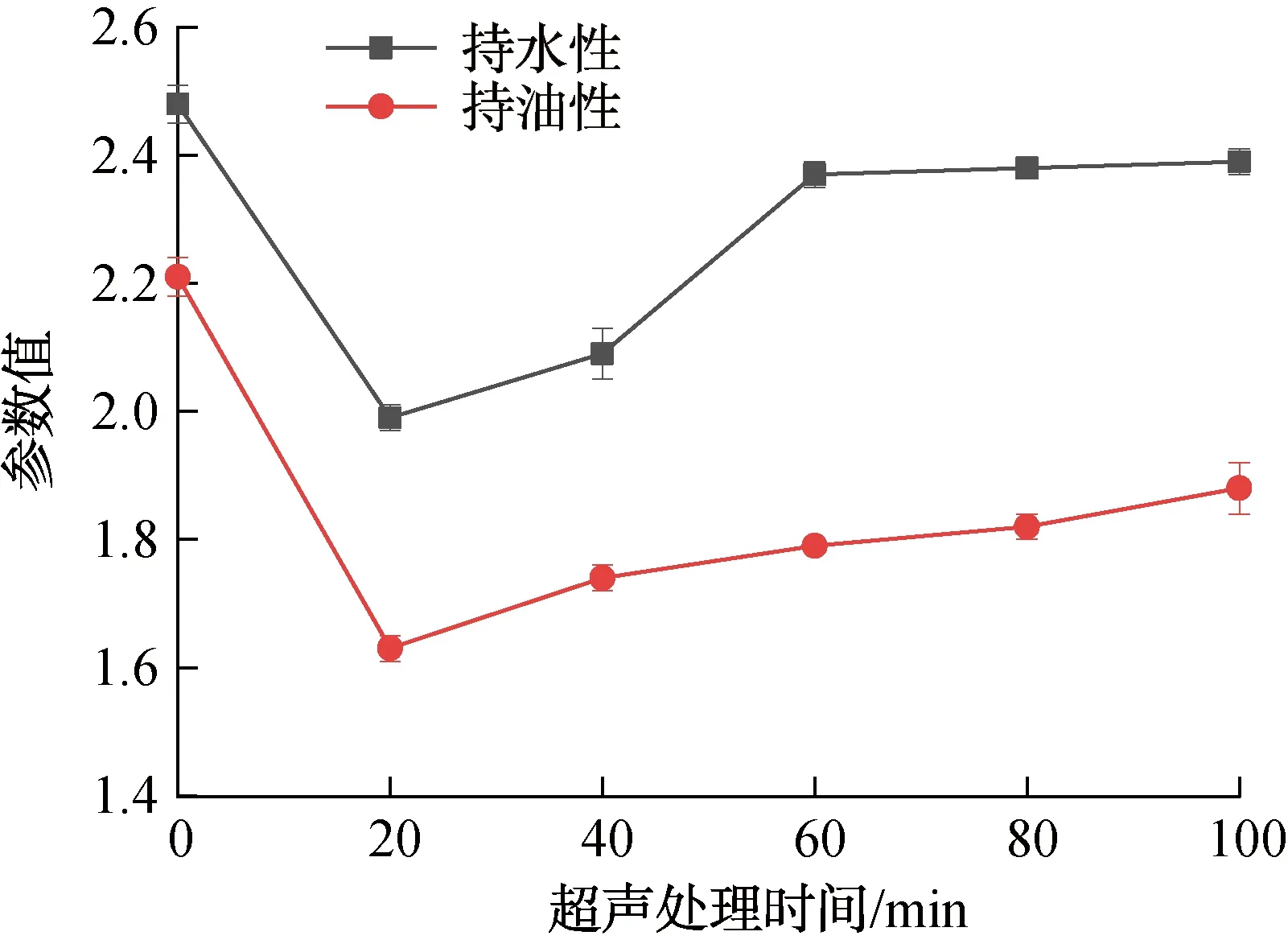
图2 不同超声处理时间对持水性和持油性的影响Fig.2 The effect of different ultrasonic treatment time on water holding capacity and oil absorbency capability
2.2.3 超声处理对乳化性和乳化稳定性的影响乳化性与通过蛋白质分散体的最大油量有关,而乳化稳定性则是指乳液抵抗变化并保持稳定的能力。不同超声处理时间对乳化性和乳化稳定性的影响如图3所示。由图3可以看出,超声处理时间为20~40 min时,QPI的乳化性低于未进行超声处理的QPI(4.938 m2/g);超声处理时间为60~100 min时,QPI的乳化性高于未进行超声处理的QPI,并随着超声处理时间的增加逐渐提高至5.773 m2/g;QPI的乳化性随超声处理时间的延长显著提高(P<0.05),是未经超声处理组的1.2倍。QPI的乳化稳定性在20 min时与未超声处理组的稳定性基本相同,没有显著变化(P>0.05),随着超声处理时间的增加(40~100 min),QPI的乳化稳定性都低于未经超声处理的QPI,但没有明显的变化规律。上述结果与孙筱[23]的高强度超声处理对芸豆蛋白理化和功能特性影响的实验结果相似。这是因为蛋白质的乳化性及乳化稳定性与蛋白质的分子结构相关联。乳化体系的形成是疏水、亲水基团与油、水相互作用产生的乳化现象,随超声处理的持续进行,蛋白质分子的内部结构展开,蛋白分子表面的疏水区暴露,增加了疏水基团与油相的相互作用,故而可提高蛋白质的乳化性。本研究显示了较高的乳化性和良好的乳化稳定性,这可能与藜麦品种和QPI提取方法有关。
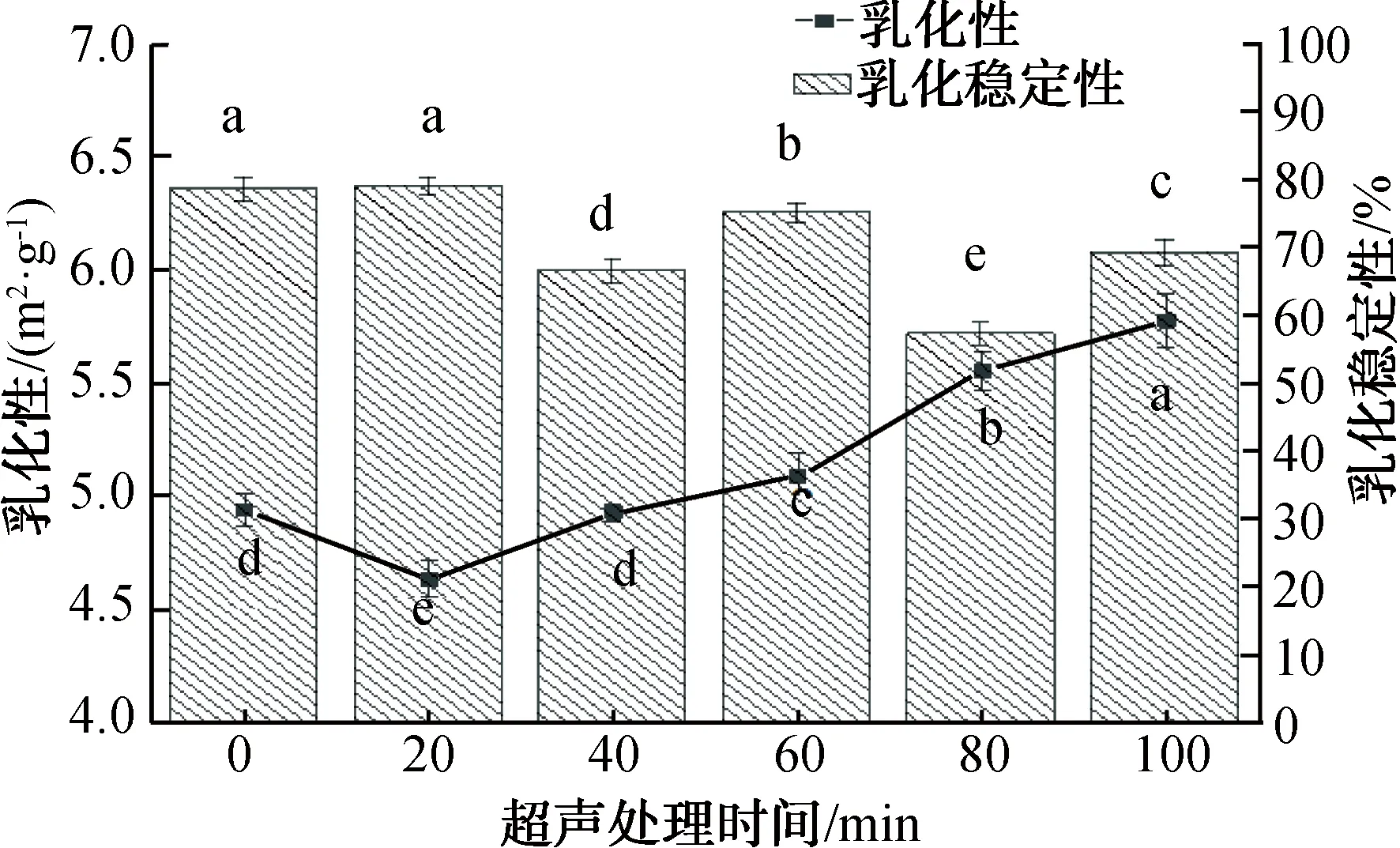
图3 不同超声处理时间对乳化性和乳化稳定性的影响Fig.3 The effect of different ultrasonic treatment time on emulsification and emulsification stability
2.3 超声处理对QPI平均粒径与分布的影响
不同超声处理时间下QPI的平均粒径与分布如表2所示。由表2可知,未进行超声处理的QPI的平均粒径为190.40 μm,而超声处理能显著降低QPI的平均粒径:超声处理仅20 min时,QPI的平均粒径即显著降低(P<0.05),随着超声处理时间的延长,平均粒径持续降低,但降幅较小,变化不明显(P>0.05)。该结果与李弓中等[24]在研究超声波处理蛋清蛋白时发现的现象一致。这可能是由于超声波的空穴效应使溶液形成湍流,湍流产生的机械剪切力将蛋白颗粒打散[25],从而使蛋白粒径变小。
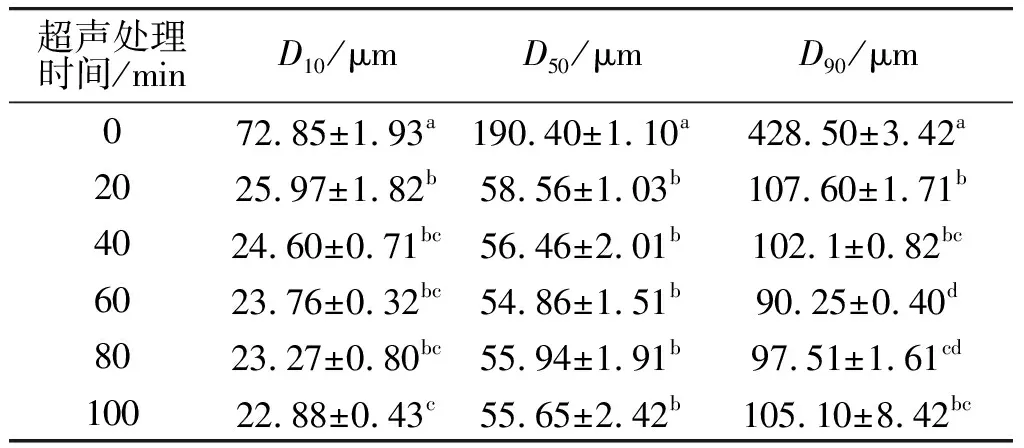
表2 不同超声处理时间下QPI的平均粒径与分布Table 2 Average particle size distribution of QPI under different ultrasonic treatment time
2.4 超声处理对QPI结构特征的影响分析
综上所述,超声强度为500 W,超声处理时间为60 min时,QPI的性能最佳,也最节约能源。超声处理前后QPI的SEM图如图4所示。由图4可以看出,未进行超声处理的QPI的大小和形状均不同,且表面较为平整。超声处理60 min的QPI的微观结构变化显著,蛋白质小分子颗粒增多,蛋白质分子发生一定的聚集,表面出现一定的褶皱,这可与平均粒径分析结果互相印证。

图4 超声处理前后QPI的SEM图Fig.4 SEM of QPI before and after ultrasound treatment
3 结论
本文以藜麦为原料,采用传统碱溶酸沉法提取QPI,研究中强度超声处理(功率为500 W)对其功能特性和微观结构的影响。结果表明:中强度超声处理60 min可获得性能最佳的QPI,改善其溶解度,增强其持水性、持油性和乳化性,降低其平均粒径,改变其结构特征,使其结构更致密均匀,表面出现不同程度的褶皱。本研究表明中强度超声处理是改善QPI功能特性的有效方法,为藜麦蛋白在食品加工行业的进一步研究开发提供了理论依据。

