阳离子双子表面活性剂凝聚相萃取分离甲基橙的研究
杨光,王瑞娟,张建强,刘瑞雪,陈荣源,曹霞,方少明
郑州轻工业大学 材料与化学工程学院,河南 郑州 450001
0 引言
随着我国染料工业的不断发展,其生产废水已导致严重的水环境污染。测定水环境中的染料浓度并控制水环境污染就显得相当重要。但是,染料在水环境中的含量通常较低,大多数实验室检测方法都无法直接对水样进行分析,需进行检测前的预处理(浓缩富集)。目前常用的预处理方法有液液萃取、微孔膜液液萃取、固相微萃取、超临界流体萃取、超声萃取等[1-6]。但是,这些常用的萃取技术也存在一定的问题,如液液萃取常使用有机溶剂[1],微孔膜液液萃取存在记忆效应[2],固相微萃取使用的材料价格昂贵[3],超临界流体萃取操作条件苛刻[4],超声萃取受功率限制等等。因此,建立一种高效、绿色环保、操作简便、成本低廉的水体有机污染物染料预处理方法成为研究热点。
近年来,基于表面活性剂的微萃取技术深受研究者的欢迎,主要包括浊点萃取(Cloud Point Extraction, CPE)技术[7]和凝聚萃取(Coacervation Extraction, CAE)技术[8]。CPE技术是以表面活性剂的增溶作用和非离子表面活性剂的浊点(CP)现象为基础,在非离子表面活性剂浓度大于临界胶束浓度(cmc)时,形成能增溶富集目标物的胶束;当温度大于CP时,引起相分离,得到富集目标物的浓缩相和表面活性剂单体水溶液。作为一种新型萃取技术,CPE具有操作简便、环境污染小、萃取效率高、费用低廉等优点,目前已应用于食品、医药、农药、工业废水、化妆品等样品的预处理[9-16]。但是,商品化的非离子表面活性剂大多是混合物,这增加了分析检测的难度;另外,其在萃取热稳定性较差的化合物时具有一定的局限性。近年来,新兴的CAE技术可以很好地克服CPE技术的上述缺点。CAE技术使用离子表面活性剂,通过加入电解质、改变pH值、添加相反电荷的两亲分子等方式诱导发生液液相分离,其中胶体成分富集的一相叫作凝聚相(coacervate),与其平衡共存的另一相叫作稀释相。相较于CPE技术,CAE技术使用的离子表面活性剂成分确定、易于检测。另外,基于离子表面活性剂的凝聚相可以通过范德华力、疏水作用、静电作用、π-离子作用、氢键等与有机污染物发生相互作用,能给予有机污染物更多的结合位点。因此,凝聚相因具有丰富的聚集结构(如层状结构[18]、三维网状结构[19-20]、蠕虫状胶束缠结结构[21]等),可以作为多功能性溶剂[17]有效地萃取大量极性和非极性化合物。
目前,有关CAE技术用于水体有机污染物染料预处理的实例较少[22-25],尚未建立一种成熟的萃取技术。因此,基于前期研究基础[20-21],本研究以季铵盐阳离子双子表面活性剂1,6-二(十二烷基二甲基)溴化二铵(12-6-12)、苯甲酸钠(NaBz)和羧甲基纤维素钠(NaCMC)为原料,构筑具有不同微观结构的凝聚相,并考查在阳离子染料亚甲基蓝(MB)共存时,其对水溶液中阴离子染料甲基橙(MO)的萃取效率和选择性,探讨凝聚相萃取水体有机污染物的萃取机制,以期为水环境有机污染物检测的预处理技术提供理论参考。
1 材料与方法
1.1 试剂与仪器
12-6-12,根据文献[26]报道的方法合成和纯化;NaCMC (M.W.250 000(DS=1.2),1500~3100 mPa·s),上海阿拉丁生化科技股份有限公司产;NaBz,分析纯,国药集团化学试剂有限公司产;MO、MB,分析纯,上海阿拉丁生化科技股份有限公司产;D2O(纯度99.9%),萨恩化学技术(上海)有限公司产。
Quanta 650型扫描电子显微镜(SEM),美国FEI公司产;Multiskan Sky型紫外可见分光度计,赛默飞世尔科技(中国)有限公司产;ADVANCE III HD 600型核磁共振光谱仪(NOESY),德国布鲁克公司产;KQ2200B型超声波清洗器,昆山市超声仪器有限公司产。
1.2 SEM测试
将待测凝聚相样品(12-6-12/NaBz、12-6-12/NaBz/NaCMC、12-6-12/NaBz/MO和12-6-12/NaBz/NaCMC/MO)滴于干净的硅片上,立即用液氮冷冻以完整保留凝聚相的微观结构;将冷冻样品于-58 ℃、真空条件下冻干以除去多余的水;在所得干燥样品表面喷Au(1~2 nm),完成样品的制备。SEM测试的工作电压为20 kV。
1.3 紫外可见(UV-Vis)光谱测试
凝聚相样品的制备:用微量注射器分别吸取一定体积的0.2 mol/L 12-6-12溶液、0.5 mol/L NaBz溶液(或5.0 g/L NaCMC溶液),再加入一定体积的去离子水,定容至4.0 mL,振荡摇匀,静置分层。
凝聚相体系萃取染料样品的制备:用微量注射器分别吸取一定体积的0.2 mol/L 12-6-12溶液、0.5 mol/L NaBz溶液(或5.0 g/L NaCMC溶液),以及一定体积、一定浓度的MO(或MB)染料溶液,再加入一定体积的去离子水,定容至4.0 mL,振荡摇匀,静置分层。
UV-Vis光谱测试:测试一系列浓度的MO(或MB)染料溶液的紫外可见吸光度及凝聚相萃取染料后下清液(稀释相)的紫外可见吸光度。测试波长范围为200~800 nm,测试温度为室温。
1.4 二维(2D)NOESY测试
以D2O为溶剂配制12-6-12/NaBz/MO悬浮液(MO浓度 0.1 mmol/L, 12-6-12浓度50 mmol/L,NaBz浓度0.25 mol/L),超声溶解均匀并静置分层,取上层凝聚相加入核磁管,进行2D NOESY测试。测试温度为室温。
2 结果与讨论
2.1 12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相的结构表征
以12-6-12、NaBz和NaCMC为研究对象,通过调控它们之间的静电吸引作用、疏水相互作用、氢键作用等分子间相互作用,分别构筑12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相。采用SEM对凝聚相的微观结构进行表征,结果如图1所示。

图1 凝聚相的SEM照片Fig.1 SEM images of coacervate
由图1可见,12-6-12/NaBz凝聚相为线型胶束缠结的网络结构,12-6-12/NaBz/NaCMC凝聚相为三维网络结构。这表明加入水溶性聚电解质NaCMC后,凝聚相结构发生了变化。分析其原因可能是,未加入NaCMC时,12-6-12在有机盐NaBz的诱导下,发生由胶束向线型胶束、线型胶束缠结网络结构的转变[21];加入NaCMC后,由于NaCMC是高分子化合物,且带有负电荷的羧酸基团重复单元,在溶液中可与带正电荷的12-6-12亲水头基发生静电吸引作用,而12-6-12分子中的两个疏水基团又可以发生疏水相互作用从而形成三维网络结构[20]。
2.2 12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相对染料的萃取效率和选择性
2.2.1MO溶液和MB溶液的浓度-吸光度标准曲线表征图2为不同浓度MO溶液和MB溶液的UV-Vis吸收光谱。由图2可见,随着MO溶液和MB溶液浓度的增加,紫外可见吸光度逐渐增强;MO溶液紫外吸收最大波长为460 nm,MB溶液紫外吸收最大波长为664.6 nm。选择图2a)中最大紫外吸收波长460 nm处的吸光度对MO溶液浓度作图,得出MO溶液浓度-吸光度标准曲线(图3a));通过线性拟合得出标准曲线线性方程A=11.686C+0.018,其中A为吸光度,C为浓度/(mmol·L-1)。选择图2b)中最大紫外吸收波长664.6 nm处的吸光度对MB溶液浓度作图,得出MB溶液浓度-吸光度标准曲线(图3b));通过线性拟合得出标准曲线线性方程A=45.305C+0.012 22。
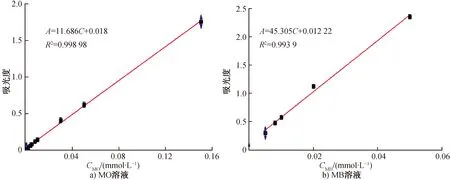
图3 MO溶液和MB溶液浓度-吸光度标准曲线Fig.3 Concentration absorbance standard curve of MO solutions and MB solutions
2.2.212-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相对MO的萃取效率在离心管中分别配制MO初始浓度C0为0.03 mmol/L的12-6-12/NaBz/MO和12-6-12/NaBz/NaCMC/MO混合物,将悬浮液静置12 h,其数码照片如图4a)、b)所示。由图4a)、b)可见,两种混合物静置12 h后分为上下两层,其中上层为凝聚相(富集分析物MO),下层为稀释相(下清液),表明12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相均对MO具有较好的萃取效果。不同12-6-12浓度下稀释相的UV-Vis吸收光谱如图5所示。由图5可见,随着12-6-12浓度的增加,稀释相的吸光度逐渐降低。继续增加12-6-12浓度,12-6-12/NaBz和12-6-12/NaBz/NaCMC两个体系均发生沉淀。根据前述MO标准曲线线性方程可得,不同12-6-12浓度时稀释相中MO的平衡浓度Ce。再根据公式:萃取效率=(C0-Ce)/C0×100%,可以得到不同12-6-12浓度时凝聚相对MO的萃取效率,结果如图6所示。由图6可知,随着12-6-12浓度增加,两个凝聚相的萃取效率均逐渐增加;当12-6-12浓度为50 mmol/L时,萃取效率均达到100%。

图4 不同混合物的数码照片Fig.4 Digital photos of different mixtures
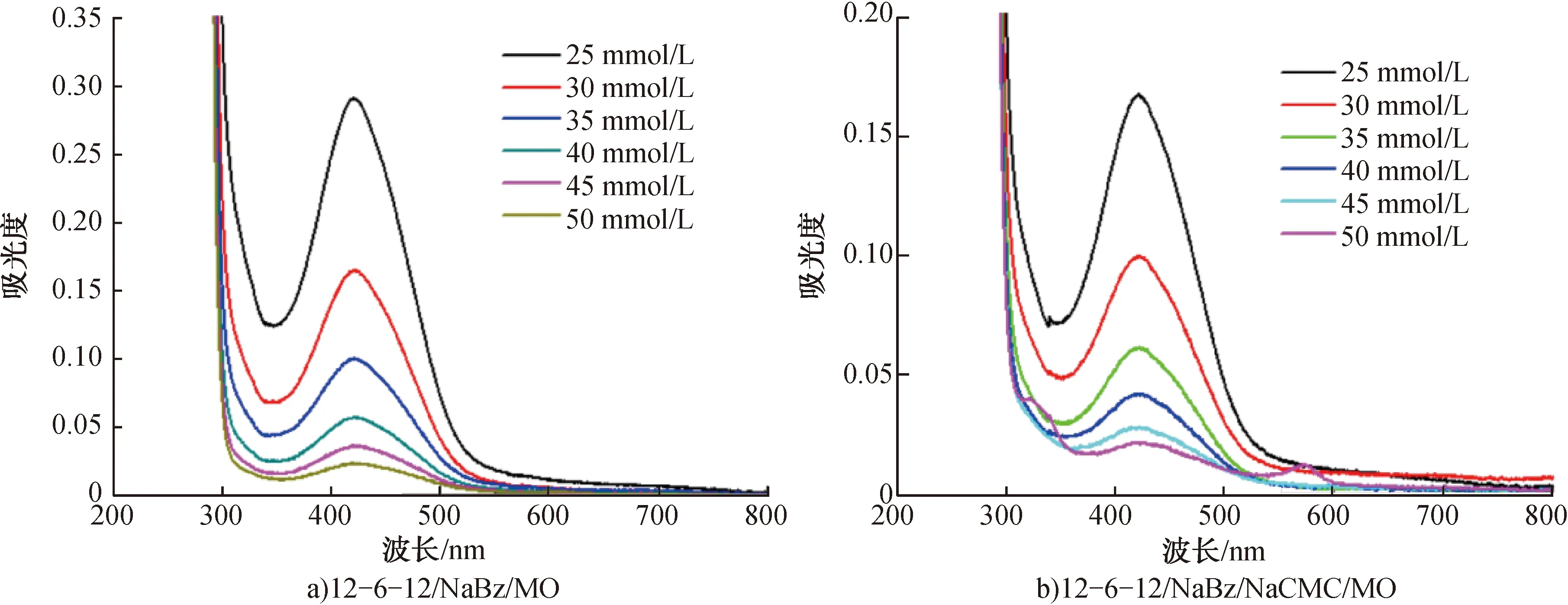
图5 不同12-6-12浓度下稀释相的UV-Vis吸收光谱Fig.5 UV-Vis absorption spectra of diluted phase at different concentrations of 12-6-12
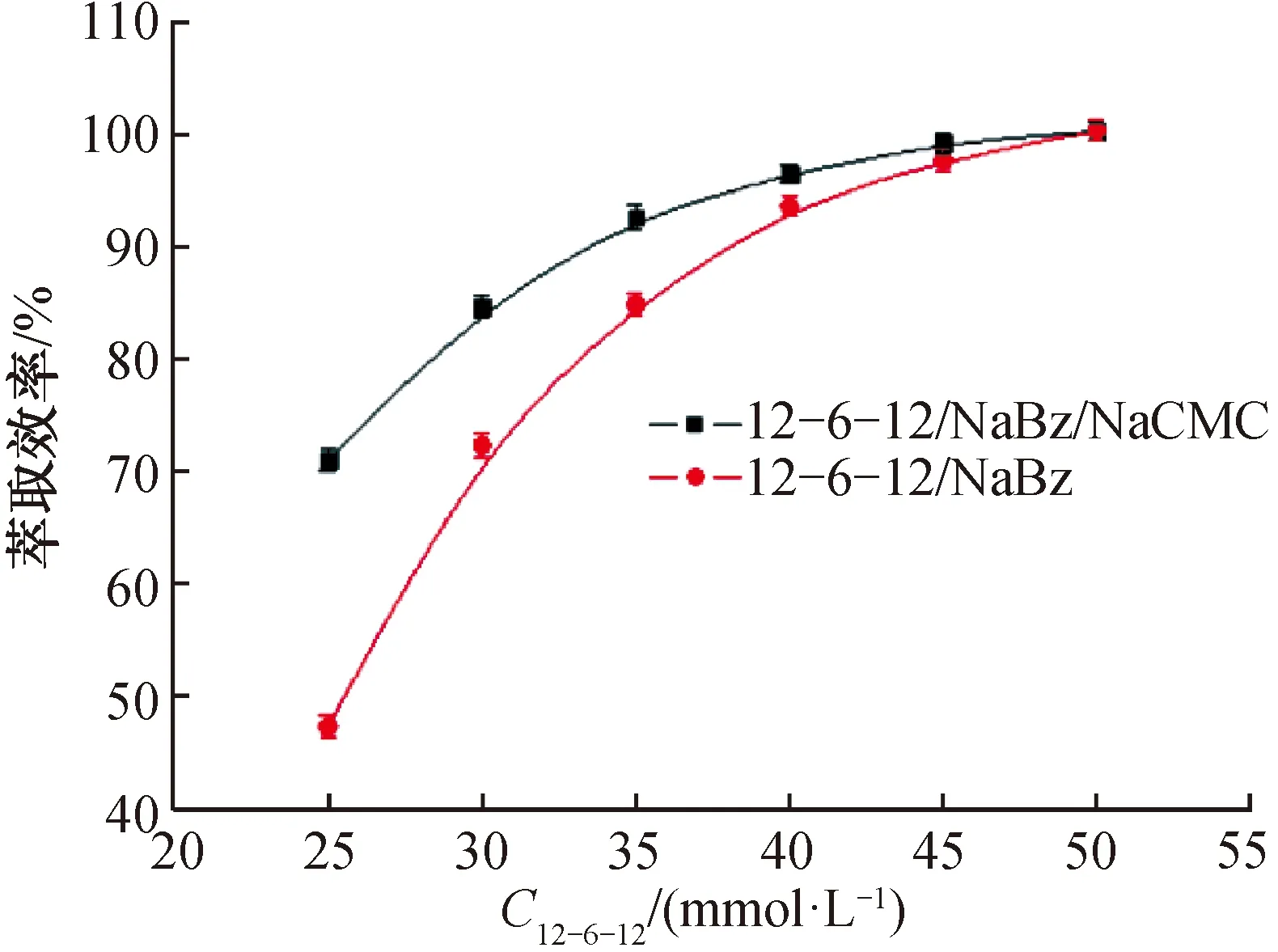
图6 不同12-6-12浓度时凝聚相对MO的萃取效率Fig.6 Extraction efficiency of coacervate relative to MO at different 12-6-12 concentrations
同样地,考查了12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相对MB的萃取效果,其数码照片如图4c)、d)所示。由图4c)、d)可见,上下两层颜色基本一致且均呈蓝色,结合UV-Vis吸收光谱测试结果可知,两个体系对MB均没有明显的萃取效果。
2.2.312-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相对MO的萃取选择性在离心管中分别配制MO和MB的C0均为0.030 mmol/L的12-6-12/NaBz/MO/MB(C12-6-12=50 mmol/L,CNaBz=0.25 mol/L)和12-6-12/NaBz/NaCMC/MO/MB(C12-6-12=50 mmol/L,CNaBz=0.25 mol/L,CNaCMC=1 g/L)混合物,将悬浮液静置12 h,分离凝聚相和稀释相,其数码照片分别如图4e)、f)所示。由图4e)、f)可见,两个体系上层凝聚相均为墨绿色,下层稀释相均为蓝色。上层的墨绿色主要是由于被凝聚相萃取的黄色MO与蓝色MB相遇所致,而下层为MB的颜色。两个体系稀释相的UV-Vis吸收光谱如图7所示。由图7可见,吸收光谱上只存在MB的特征峰而不见MO的特征峰,表明两个体系均对MO有良好的萃取效果而对MB无明显的萃取效果。根据前述标准曲线线性方程及萃取效率,可以计算两个凝聚相对MO和MB的萃取效率,其中12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相对MO的萃取效率分别为89.1%和92.3%,而对MB的萃取效率均接近0。这表明当阳离子染料MB存在时,两个凝聚相均能够选择性地萃取阴离子染料MO;另外,12-6-12/NaBz/NaCMC凝聚相对MO的萃取选择性稍高于12-6-12/NaBz凝聚相。根据文献[20]的研究结果,在12-6-12和NaBz浓度相同的条件下,12-6-12/NaBz/NaCMC凝聚相的体积大于12-6-12/NaBz凝聚相,因此前者能够提供更多的相互作用位点,从而可以萃取更多的MO分子;此外,凝聚相微观结构的不同也可能会对MO萃取量有一定的影响。
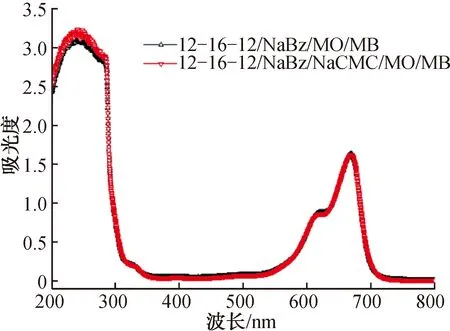
图7 12-6-12/NaBz/MO/MB和12-6-12/NaBz/NaCMC/MO/MB稀释相的UV-Vis吸收光谱Fig.7 UV-Vis absorption spectra of 12-6-12/NaBz/MO/MB and 12-6-12/NaBz/NaCMC/MO/MB diluted phases
2.3 12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相对阴离子染料MO的萃取机制探讨
为了阐明凝聚相中表面活性剂和阴离子染料MO的相互作用机制,利用SEM和2 D NOESY分别对凝聚相的微观结构和分子相互作用位点进行表征,结果如图8、图9所示。
由图8可见,加入MO后,12-6-12/NaBz/MO凝聚相仍形成蠕虫状胶束缠结网络结构,12-6-12/NaBz/NaCMC/MO凝聚相仍形成三维网络结构,表明MO分子参与了凝聚相的形成。

图8 12-6-12/NaBz/MO和12-6-12/NaBz/NaCMC/MO凝聚相的SEM照片Fig.8 SEM images of 12-6-12/NaBz/MO and 12-6-12/NaBz/NaCMC/MO coacervate
由图9可见,MO分子的3-H、4-H和5-H质子与表面活性剂12-6-12的e-H质子存在交叉峰;另外,MO分子的1-H质子与表面活性剂12-6-12的a-H、b-H质子也存在交叉峰,表明这些质子的距离小于0.5 nm,即在12-6-12/NaBz/MO凝聚相中,12-6-12的疏水碳链与MO的两个甲基空间相关,且12-6-12的亲水头基与MO的苯环空间相关。上述结果表明,一些MO分子通过苯环结构嵌入12-6-12胶束内核,而另一些MO分子则吸附在胶束表面。

图9 12-6-12/NaBz/MO体系的2D NOESY谱图Fig.9 2D NOESY spectrum of the 12-6-12/NaBz/MO mixtures
3 结论
本文以12-6-12、NaBz和NaCMC为原料构筑了两种微观结构不同的凝聚相,并将其用于萃取分离水介质中的染料MO,得出如下结论:
1)12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相对阴离子染料MO均具有良好的萃取效果,对阳离子染料MB没有萃取效果;当C12-6-12=50 mmol/L时,两个凝聚相对MO的萃取效率均达到100%。
2)当12-6-12/NaBz和12-6-12/NaBz/NaCMC凝聚相萃取同等浓度的MO和MB时,两个体系对MO的萃取效率分别为89.1%和92.3%,表明在阳离子染料MB存在时,两个凝聚相对阴离子染料MO都有良好的萃取选择性。
3)凝聚相萃取MO的萃取机制可能是,12-6-12/NaBz凝聚相中加入MO后,一些MO分子通过苯环结构嵌入12-6-12胶束内核,另一些MO分子吸附在胶束表面参与了三维网络结构凝聚相的形成。
本研究结果可为拓展CAE预处理技术在水环境有机污染物检测领域的应用提供理论参考。

