骨髓间充质干细胞外泌体介导miR-124-1 对小胶质细胞M2型极化调控的影响
郝 磊,金 戈,杨涌涛,王军伟,孙 洋,秦翠玲,展群岭
重庆市第五人民医院神经内科,重庆 400062
脑卒中,尤其是缺血性脑卒中(ischemic stroke,ⅠS),是患者致残、致死的重要病因之一[1]。炎症伴随着ⅠS的发生即刻开始。小胶质细胞(microglia,MG)快速活化,作为其急先锋(第一感受器)对炎症的发生迅速作出免疫应答,分泌肿瘤坏死因子-α(tumor necrosis factor- α, TNF- α)、 白细胞介素-6(interleukin-6,ⅠL-6)、CD206 及ⅠL-10 等炎症因子,对神经系统起到既损伤又保护的双向作用[2]。MG 分为M1与M2型,不同类型的MG在ⅠS病程中发挥不同的作用。M1型分泌TNF-α、ⅠL-6等促炎症因子,加重ⅠS 的炎症反应,导致神经、组织进一步受损;M2 型分泌CD206、ⅠL-10等抗炎症因子,参与受损神经、组织的修复,对神经系统起到保护作用[3]。可见,调控MG向M2型转化对ⅠS的治疗具有重要意义[4]。但MG的M2型极化,目前尚缺乏有效的调控手段。
间充质干细胞(mesenchymal stem cells,MSCs)已广泛用于受损组织的治疗,包括ⅠS 的救治[5],其作用主要由MSCs 旁分泌的外泌体(exosomes,Exo)予以实现[6-7]。Exo 是细胞质膜萌芽到胞外基质中的一种膜囊泡,是介导细胞间对话的重要因子[8]。MSCs 旁分泌的 Exo 可致 M1 型巨噬细胞(macrophage,MP)与M1型MG转化为M2型,促使ⅠS受损神经的修复[9]。
微RNA (microRNA,miRNA) 具有高度保守性、高度组织特异性和相对稳定等特点,在细胞的生长、分化、凋亡及氧化应激等过程中发挥重要作用[10],被认为是组织损伤的潜在生物标志物[11-12]。受损神经的重塑有多种miRNA 参与,其中,miR-124-1 可调控骨髓间充质干细胞(bone marrowmesenchymal stem cells,BMMSCs)的分化[13],还可调控MG、MP 向M2 型转化[14-15],在包括ⅠS 修复过程的神经发育及其功能调节中发挥作用。
为进一步提升MG 的M2 型极化调控效能,以利于ⅠS 患者的神经修复,本实验先分离、培养并鉴定大鼠BMMSCs 及其Exo(BMMSCs-Exo),然后构建miR-124-1 基因慢病毒过表达载体,将过表达miR-124-1 基因的BMMSCs-Exo(Exo/124-1)与经脂多糖(lipopolysaccharide,LPS)活化的HAPⅠ小胶质细胞株(HAPⅠ细胞,一种MG)共培养。采用实时荧光定量 PCR (quantitative real-time PCR, qPCR) 和Western blotting分别检测HAPⅠ细胞的M1型分子(ⅠL-6、TNF-α)与M2型分子(CD206、ⅠL-10)的mRNA及其蛋白的表达变化。本实验旨在为研究BMMSCs通过其Exo携带miR-124-1基因调控MG的M2型极化在介导ⅠS神经重塑中的可能的机制奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及细胞 分离BMMSCs 用SD 大鼠28 只[购自中国人民解放军陆军军医大学实验动物中心],动物生产许可证号为SCXK(渝)20170002,使用许可证号为SYXK(渝)20170002。大鼠体质量200 g 左右,雌雄均有,于常规恒湿、恒温的SPF 级动物室内饲养,自由摄食标准饲料与无菌水。动物实验经重庆市第五人民医院伦理委员会批准(批号:2020CQSDWRMYYEC-dw001)。
HAPⅠ细胞购自深圳华拓生物科技有限公司。293T 细胞由中国人民解放军陆军军医大学复合伤研究所储存与惠赠。
1.1.2 主要试剂和仪器 胎牛血清购自美国Sigma公司;DMEM 培养基购自美国HyClone 公司;TNF-α、ⅠL-6、CD206、ⅠL-10 及CD9 抗体购自美国Abcam 公司;CD90、CD44 及CD45 抗体购自美国Ebioscience公司;CD63 抗体购自美国Scbt 公司;qPCR 检测引物由中国上海生工生物工程有限公司设计与合成,其检测试剂盒购自该公司,Bio-Rad CFX Manager 3.0为其定量分析软件;PVDF 膜购自美国Bio-Rad 公司;FT106 慢病毒载体、miR-124-1 基因合成及测序由中国广州辉腾生物科技有限公司提供与完成;胶回收及质粒抽提试剂购自美国Roche 公司;Lipofectamine®2000 基因转染试剂购自美国Ⅰnvitrogen 公司。CFX96荧光定量PCR 仪、Mini 蛋白电泳仪购自美国Bio-Rad公司;JEM-1400 Plus 透射电子显微镜(transmission electron microscope,TEM)购自日本HⅠTACHⅠ公司。
1.2 实验方法
1.2.1 细胞培养与鉴定 BMMSCs 的分离、培养与流式细胞仪检测鉴定参照我们前期的实验[1]进行。HAPⅠ细胞按常规方法培养:待其生长至80%~90%融合时,消化传代培养,以备后用。293T 细胞采用常规培养。
1.2.2 BMMSCs-Exo的提取与鉴定 使用去掉Exo的含10%胎牛血清的DMEM培养基常规培养BMMSCs,传至第二代,至80%~90%融合时,收集、过滤其培养液。先在4 ℃时以300×g离心10 min,吸取其上清液;再在同样温度下,分别以2 000×g、10 000×g及100 000×g离心10 min、30 min及70 min,前2次为上清液离心,末次弃去上清液,收集沉淀(Exo)重悬于100 μL,4 ℃预冷的PBS液内,立即送样镜检。
取约10 μL Exo 悬液,按常规TEM 观察要求制样,3%磷钨酸水溶液染色,以100 kV 运行TEM 观察、拍照。
提取、定量Exo总蛋白,Western blotting法[1]检测其CD63 及CD9 蛋白的表达变化,内参照为GAPDH,至少重复3次。
1.2.3 FT106/miR-124-1 慢病毒载体的构建和鉴定参照miRBase 数据库的鼠源miR-124-1 基因序列(NR_031866.1),合成miR-124-1 基因,并克隆其入慢病毒载体FT106 的XbaI和BamHI酶切位点间,构建慢病毒重组载体FT106/miR-124-1,并行测序鉴定。
1.2.4 FT106/miR-124-1 重组载体的包装和滴度测定 参照重组慢病毒的包装与滴度测定实验[1]行FT106/miR-124-1重组载体的包装和滴度测定。
1.2.5 BMMSCs 的FT106/miR-124-1 病毒感染及其miR-124-1 基因的表达检测 BMMSCs 的FT106/miR-124-1 病毒感染参照干细胞的重组慢病毒感染实验[1]进行。设计miR-124-1(NR_031866.1)的qPCR 检测颈环引物(正向引物:5'-ACACTCCAGCTGGGCGT GTTCACAGCGGA-3';反向引物:5'-CTCAACTGG TGTCGTGGAGTCGGCAATTCAGTTGAGTCAAGG TC-3')。qPCR 检测过表达miR-124-1 的BMMSCs(BMMSCs+miR-124-1,BMMSCs/124-1组)及其Exo的miR-124-1(BMMSCs-Exo+miR-124-1,Exo/124-1组)表达情况,以正常BMMSCs(BMMSCs 组)及其Exo(BMMSCs-Exo 组)的相同检测作对照。U6基因作内参。实验至少重复3次。
感染效率的评估采用表达绿色荧光蛋白(green fluorescent protein,GFP)的BMMSCs 的百分比及其qPCR 检测结果,表达GFP 90%以上者,说明其有效表达miR-124-1,可用于后续实验。
1.2.6 过表达miR-124-1的BMMSCs-Exo对MG极化调控的影响 常规培养HAPⅠ细胞,待其长至60%~70%融合时,更换含500 ng/mL 的LPS 培养基,24 h后,分别更换含10 μg/mL 的BMMSCs-Exo(Exo 组)及BMMSCs-Exo/124-1(Exo/124-1 组)培养基,再培养24 h,分别收集Exo 组与Exo/124-1 组细胞。用仅含LPS 培养基培养的HAPⅠ细胞(LPS 组)与未处理的HAPⅠ细胞(正常组)作对照。
设计、合成TNF-α(L00981.1)、IL-6(M26744.1)、IL-10(L02926.1)及CD206(NM_001106123.2)基因qPCR 检测引物(表1)。以各组细胞总RNA 为模板,qPCR分别检测各组细胞各基因的表达情况,以Gapdh(AF106860.2)为内参。

表1 qPCR检测的引物序列Tab 1 Primer sequences for qPCR
Western blotting 法[1]检测上述各组细胞TNF-α、ⅠL-6、CD206及ⅠL-10蛋白的表达情况。
1.3 统计学方法
采用SPSS 22.0 软件对数据进行分析。采用独立样本t检验与方差分析,数据以±s呈现。P<0.05 表示差异具有统计学意义。
2 结果
2.1 BMMSCs的分离、培养和鉴定
倒置显微镜观测发现,原代BMMSCs 由圆形向不规则形转变,随后大部分转变为长梭形、纺锤样,以散在集落状态分布。继续培养8~11 d,取单克隆BMMSCs 扩增培养。经扩增的BMMSCs 良好生长,待至85%~95% 汇片时再次传代扩增。此时的BMMSCs,大部分呈梭形,分布较均匀(图1),增殖旺盛,增殖速度明显快于原代,6~8 d 可再次传代培养,以备后用。

图1 镜下传代扩增的BMMSCsFig 1 BMMSCs subcultured and expanded under microscope
流式细胞仪检测证实,源于中胚层的细胞表型标志CD44 与CD90,在BMMSCs 中明显高表达,其阳性率分别为99.700%与99.200%;而造血细胞表型标志CD45,在BMMSCs中不表达或表达低下,其阳性率是0.999%(图2)。
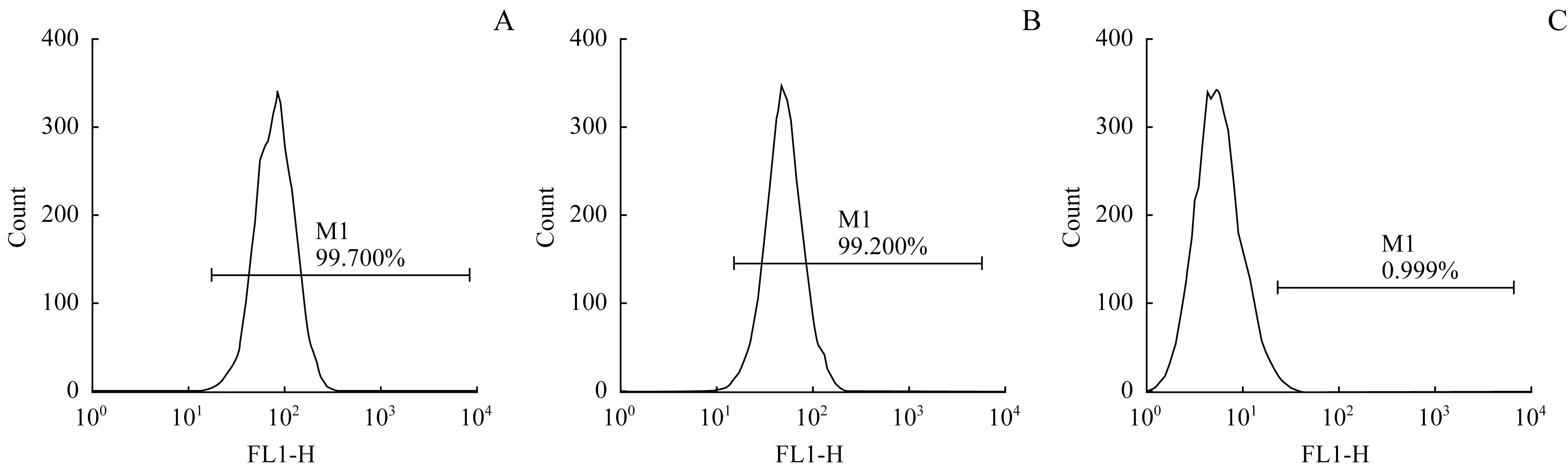
图2 流式细胞仪检测BMMSCs的CD44(A)、CD90(B)与CD45(C)的阳性率Fig 2 Detection of the positive rates of CD44(A),CD90(B)and CD45(C)in BMMSCs by flow cytometry
2.2 BMMSCs-Exo的提取与鉴定
TEM 观察可见,BMMSCs-Exo 呈椭圆形、圆形囊泡状,直径50~150 nm(图3A)。Western blotting结果表明,其表面标志蛋白CD63、CD9 的表达分别较BMMSCs 增高68.00%与61.94%(图3B、3C),差异均具有统计学意义(P=0.000)。

图3 BMMSCs-Exo外泌体的鉴定Fig 3 Ⅰdentification of BMMSCs-Exo
2.3 FT106/miR-124-1病毒的测序鉴定
测序结果(图4)表明,携带miR-124-1 的重组病毒FT106/miR-124-1构建成功。

图4 重组慢病毒载体FT106/miR-124-1的测序鉴定Fig 4 Sequencing and identification of recombinant lentiviral vector FT106/miR-124-1
2.4 FT106/miR-124-1重组载体的包装和滴度测定
将重组病毒FT106/miR-124-1 感染常规培养的293T 细胞(图5A)。倒置荧光显微镜下可见,经感染48 h 的293T 细胞明显表达GFP(图5B)。倍比稀释法实验表明,该重组病毒的滴度约为1.4×108转导单位(transducing unit,TU)/mL。

图5 重组病毒FT106/miR-124的包装Fig 5 Recombinant lentiviral vector FT106/miR-124-1 packaged with 293T cells
2.5 BMMSCs的FT106/miR-124-1病毒感染
未感染的BMMSCs 无GFP 表达(图6A),被重组病毒FT106/miR-124-1 感染的BMMSCs,明显表达GFP(图6B),其感染效率达95%以上。qPCR 检测表明,被感染的BMMSCs 及其Exo 与感染前比较,其miR-124-1 的表达分别上调69.74%与70.59%,差异均具有统计意义(P=0.000,图6C)。

图6 BMMSCs及其Exo的重组病毒感染Fig 6 Recombinant lentivirus infection rate in BMMSCs and BMMSCs-Exo
2.6 携带miR-124-1 的BMMSCs-Exo 对MG 的M2型极化调控的影响
qPCR 和Western blotting 检测(图7、图8) 表明,Exo/124-1 能有效上调HAPⅠ细胞M2 型分子CD206(与正常组和LPS组比较,在基因水平分别上调了46.90%、76.99%,在蛋白水平分别为65.13%、85.11%)、ⅠL-10(与正常组和LPS 组比较,在基因水平分别上调了43.09%、72.36%,在蛋白水平分别为55.19%、78.18%),下调其M1 型分子ⅠL-6(与正常组和LPS 组比较,在基因水平分别下调了55.71%、73.04%,在蛋白水平分别为52.32%、76.95%)、TNF-α(与正常组和LPS 组比较,在基因水平分别下调了51.95%、 68.91%, 在蛋白水平分别为52.14%、77.47%) 的表达,差异均具统计学意义(P=0.000)。结果提示,过表达miR-124-1 基因的BMMSCs-Exo(Exo/124-1)可诱导M1 型HAPⅠ细胞向M2 型转化。
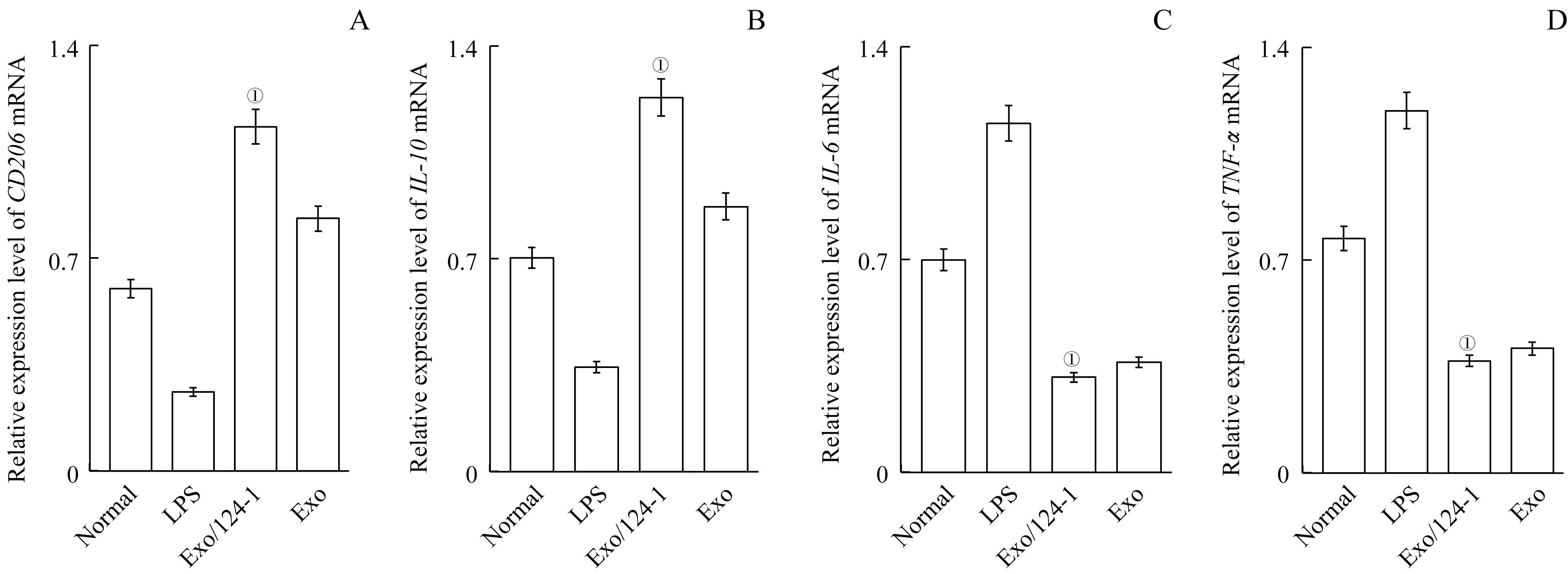
图7 qPCR检测过表达miR-124-1的BMMSCs-Exo对HAPI细胞CD206(A)、IL-10(B)、IL-6(C)和TNF-α(D)mRNA表达的影响Fig 7 Effects of overexpressing miR-124-1 gene in BMMSCs-Exo on the expressions of CD206, IL-10, IL-6 and TNF-α mRNA of HAPⅠcells detected by qPCR

图8 Western blotting检测过表达miR-124-1的BMMSCs-Exo对HAPI细胞CD206、IL-10、IL-6和TNF-α蛋白表达的影响Fig 8 Effects of overexpressing miR-124-1 gene in BMMSCs-Exo on the expressions of CD206, ⅠL-10, ⅠL-6 and TNF-α protein in HAPⅠcells detected by Western blotting
3 讨论
ⅠS 占脑卒中的70%~87%[1]。炎症反应在ⅠS 的发生发展中倍受关注。MG 被视为脑组织中的MP,是中枢神经系统(central nervous system,CNS)中首要和最主要的一道防线。静息状态的MG 对CNS 进行免疫监视,并通过移除细胞碎片、控制神经元及突触冲动等维持CNS的稳定。ⅠS炎症早期,MG被迅速活化成M1 型细胞,释放大量的炎症介质(ⅠL-6、TNF-α等),导致神经元变性、坏死[16]。本研究结果表明,经LPS 刺激活化的HAPⅠ细胞,其ⅠL-6、TNF-α表达明显上调,与文献报道相符;同时被活化成的M2 型细胞释放抗炎介质,发挥神经保护作用[17]。MG 既致毒又保护的双向作用成为ⅠS 救治的重要靶点,探讨MG 的M2 型极化调控成为ⅠS 治疗的新策略[4],但目前仍缺乏有效的措施。因此,本研究选用HAPⅠ细胞为研究靶细胞,以寻求其M2 型极化调控的新手段,为更有效地治疗ⅠS奠定基础。
MSCs 是源于中胚层的成体干细胞,易于获取与扩增,具有高度自我更新与多向分化潜能,在各种疾病包括ⅠS的研究中得以广泛应用。Exo是细胞以出芽方式形成的一种直径30~150 nm 的双层脂质膜纳米囊泡。BMMSCs-Exo 可表达CD63、CD9 蛋白[18]。经TME 和Western blotting 鉴定表明,实验分离到的BMMSCs-Exo,其形态、大小及标志蛋白CD63、CD9 的表达等与文献报道一致。Exo 可向靶细胞传递其内容物(蛋白质、脂质及miRNA 等生物活性物),调控靶细胞基因的表达,影响其生物功能,介导细胞间的通信[19]。MSCs-Exo 不仅有MSCs 的特有活性物,且可作为新型免疫调节剂,免受治疗时细胞产生的免疫排斥,其应用前景广阔[20-22]。MSCs-Exo 在MG的M2型极化调控方面亦具一定作用。
miRNA 是小于22 个核苷酸的一类非编码RNA,参与调节细胞的增殖、凋亡、代谢及组织、器官发育等病理生理过程,其表达稳定、易于干预,作用迅速、广泛;在多种疾病,包括ⅠS 的研究中倍受关注[23]。因受双层膜结构的保护,Exo 中的miRNA 非常稳定。miR-124-1 是CNS 中最丰富的miRNA 之一,为总量的25%~48%[24],可促进MSCs 行使炎症免疫调节和神经保护作用[25]。ⅠS发生后,miR-124-1能使MG 向M2 型极化,以防神经元受损;但单纯地应用miR-124-1,其促进MG 的M2 型极化效能并不显著[15,26]。因此,我们在研究中采用BMMSCs-Exo 携带miR-124-1 来干预HAPⅠ细胞。本研究证实,BMMSCs-Exo 能携带miR-124-1,显著上调HAPⅠ细胞的CD206、ⅠL-10表达,提示其可有效诱导HAPⅠ细胞向M2型极化。
综上所述,BMMSCs 可经其Exo 携带miR-124-1基因,促使HAPⅠ细胞向M2 型细胞极化,从而可能介导ⅠS 神经功能的恢复。本实验只在细胞水平进行了初步探讨,其动物及临床结果是否符合预期,需进一步研究证实。

