基于人群大队列探索心脑血管疾病相关血浆代谢组学特征
张梦吉,黄 琳,李 峥,马卓然,魏 霖,袁安彩,胡刘华,张 薇,钱 昆,2,3,卜 军
1.上海交通大学医学院附属仁济医院心内科,上海 200127;2.上海交通大学生物医学工程学院,上海 200030;3.上海交通大学医疗机器人研究院,上海 200240;4.上海市胸科医院/上海交通大学医学院附属胸科医院检验科,上海 200030
据国家心血管病中心[1]估计,心脑血管疾病占我国居民总死亡原因的首位。目前我国心血管疾病患者约3.3 亿,且由于饮食不健康、运动不足、饮酒、吸烟等危险因素呈现普遍化态势,我国患有心血管疾病的人数仍在持续升高。因此,研究心脑血管疾病发病的分子机制对降低心脑血管疾病相关死亡率具有重要意义。分子组学为心脑血管疾病发病机制研究提供了新的契机,有助于阐明机制并寻找新的药物作用靶点;其中代谢组研究可以通过对代谢物及其差异调控代谢通路展开分析,探寻心脑血管疾病及其危险因素相关的代谢生物标志物(以下简称为标志物)。从代谢角度阐释心脑血管疾病发病造成的代谢途径改变有助于实现疾病管理,从而降低心脑血管疾病风险,减轻心脑血管疾病负担。
心脑血管疾病涉及多因素参与的复杂病理过程,基于单一代谢标志物难以实现疾病分子图景的精准描述,通过代谢指纹相关作用关系有助于疾病整体分析。本研究依托于科技部重大慢性非传染性疾病防控专项“心脑血管疾病协防共管创新管理模式的开发和应用”,基于课题组建立的上海市浦东新区自然人群队列(临床试验号NCT04517513),用于建立基于大数据平台的心脑血管疾病风险预测新模型。本研究重点关注心脑血管疾病相关的高危人群。研究通过纳米材料增强激光解吸电离质谱技术(nano-enhanced laser desorption ionization-mass spectrometry,NELDⅠ-MS)提取约14 000 例血浆代谢指纹图谱(plasma metabolic fingerprints,PMFs),并利用统计分析方法确定了与对照组相比,冠心病(coronary heart disease,CHD)单患组、脑卒中单患组、心脑血管疾病共患组(冠心病+脑卒中)中具有显著差异性调控的6 个代谢标志物,有望对心脑血管疾病发病机制提供代谢层面线索。
1 对象与方法
1.1 对列人群与样本收集
本研究队列人群纳入标准:①年龄≥35 岁。②上海户籍居民或在上海居住5年以上并参加上海市社会保障的人群。③无严重肢体残疾、可以正常沟通的人群。排除标准:①临时居民和流动人口。②不愿接受项目后续检查的人群。③病史采集不全、血样不合格的人群。2019 年2—8 月期间,共纳入14 419 例队列成员,根据以下标准分为4 组:对照组为自述无冠心病、无脑卒中病史的,共12 205例;脑卒中单患组为自述无冠心病、有脑卒中病史的患者,共461 例;冠心病组为自述有冠心病、无脑卒中病史的患者,共1 608 例;心脑血管疾病共患组为自述同时有冠心病、脑卒中病史的患者,共145 例。收集队列成员的体检资料作为基线资料,包括性别、年龄、身高、体质量、体脂率,是否有高血压、糖尿病、高脂血症。研究严格遵循《赫尔辛基宣言》,并获得了上海交通大学医学院附属仁济医院和上海交通大学生物医学工程学院伦理委员会的批准(KY2019-101)。所有对象均签署了知情同意书。
血浆采集按照标准流程,使用5 mL 的EDTA 抗凝分离管采集队列成员的空腹血4~5 mL。所有血样都通过静脉穿刺抽取获得,并在室温下静置40 min至血液凝固。在5 100×g转速下离心10 min 获得血浆样品。离心后弃去沉淀,将血浆样本立即保存在-80°C的环境中。
1.2 试剂与仪器
葡萄糖(99.5%)、丝氨酸(99%)、组氨酸(99%)、氯化钠(99.5%)和牛血清白蛋白(98%)购自美国密苏里州圣路易斯的Sigma-Aldrich 公司。上述试剂将被用于质谱谱峰校准。氯化钾(99.5%)购自国药化学试剂北京有限公司。实验中使用的所有水溶液均由去离子水配制而成,纯水仪购自法国莫尔塞姆的Millipore 公司。AutoFlex TOF/TOF 质谱仪购自德国的布鲁克公司,其内置配有激发波长在355 nm的Nd:YAG激光器。
1.3 NELDI-MS实验
1.3.1 样品制备 取10 μL血浆样品加入适量有机溶剂以进行蛋白沉淀,后点样于微阵列靶板。待干燥后,将1 μL的铁纳米颗粒分散液(1 mg/mL)覆盖在干燥后的斑点上,以作为后续质谱检测的增强基质。此方法系根据前期研究报道[2-4]而展开。标准品混合液由前述试剂组成,其浓度均设置为1 mg/mL。
1.3.2 质谱数据采集 将干燥后的血浆-基质共结晶样品送至AutoFlex TOF/TOF 质谱仪内,以标准品混合液进行质谱校准,同时在反射模式下进行PMFs 采集和分析。检测质荷比(mass-to-charge ratio,m/z)范围100~1 000。采集时设置仪器参数分别为离子源加速电压20 kV,激光发射次数2 000 次,脉冲频率1 000 Hz,延迟时间优化为200 ns。所有质谱谱图均在正离子模式下采集。
1.4 质谱数据处理
对原始质谱数据的预处理采用Python 3.7 软件,主要包括谱峰平滑、谱峰重采样、基线校正和峰提取4 个步骤。谱峰平滑:采用高斯滤波对原始质谱谱图进行平滑,以去除背景噪声。谱峰重采样:采用数据分箱,降低原始质谱谱图的复杂度。基线校正:采用数学形态学方法去除背景基线。峰提取:采用检测谱图的局部极大值,提取信号峰。
1.5 统计学方法
采用Python 3.7 对数据进行统计学分析。定量资料采用单因素方差分析进行多组组间差异检验;采用Shapiro-Wilk test 进行正态性检验,若数据符合正态分布,则用±s表示,2 组间比较采用独立样本t检验;若不符合正态分布,则用M(最小值~最大值)表示,2 组间比较采用Wilcoxon rank-sum 检验。定性资料用n(%)表示,采用χ2检验进行分析。检验水平均为α=0.05。质谱数据分析过程包含代谢峰显著性筛选(依据P≤0.05 准则)以及质谱信号强度筛选,其中显著性筛选依据上述统计检验完成,质谱信号强度筛选设置纳入阈值为质谱谱峰相对强度>1‰。协变量分析基于Logistic 回归计算加入协变量前后自变量的比值比(odds ratio,OR)变化。其中,OR定义为Logistic回归式中自变量系数的自然指数。
1.6 代谢通路分析
根据模型筛选特征m/z值,通过精准分子量比对、 数据库检索(human metabolome database,https://hmdb.ca)鉴定相关代谢标志物。进一步通过MetaboAnalyst (http://www.metaboanalyst.ca/) 中的通路拓扑分析研究潜在改变的代谢途径。
2 结果
2.1 队列人群的基线特征
队列人群的基线特征如表1 所示,各组在性别、年龄、身高、体脂率及是否存在高血压、糖尿病、高脂血症疾病上的差异,具有统计学意义(均P<0.05);在体质量上的差异,不具有统计学意义(P=0.206)。
2.2 PMFs分析
图1 为经NELDⅠ-MS 提取的队列人群血浆原始代谢质谱谱图(m/z为100~500),不同人群的典型质谱图显示了一定差异,特别是m/z为100~300。经数据预处理后,共提取到345 个代谢信号峰,并将此峰作为PMFs用于后续数据分析。
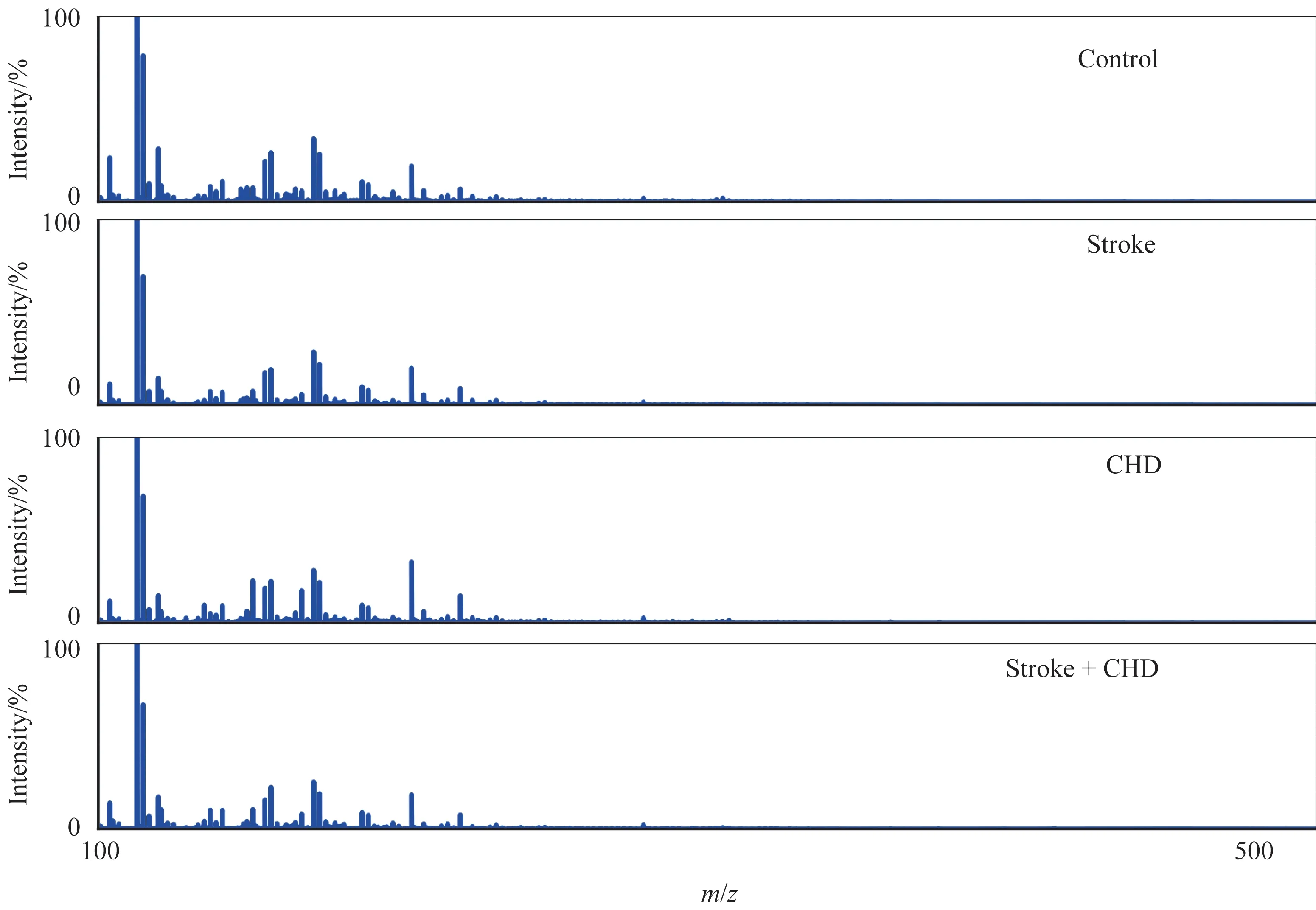
图1 心脑血管疾病的血浆质谱图Fig 1 Typical mass spectra of cardiovascular and cerebrovascular diseases
2.3 心脑血管疾病相关特征代谢标志物筛选
首先利用方差分析进行多组间差异检验分析,依据P≤0.05 准则,在345 个代谢峰中筛选得到85 个在多组间具有显著性差异的代谢峰。其次再依据相对质谱信号强度大于1‰、两两比较t检验显著性P≤0.05的准则,筛选出6 个m/z变量作为差异代谢标志物。通过Human Metabolome Database 数据库搜索及精确一级分子质量比对,对筛选得到的特征m/z变量进行了初步的物质指认。最终确定的差异调控代谢物分别为氨基磺酸(m/z:119.95[M+Na]+)、乙酰乙酸(m/z:124.95[M+Na]+)、甲基丙二酸(m/z:140.95[M+Na]+)、葡萄糖(m/z:202.95[M+Na]+)、半乳糖醛酸(m/z:217.05[M+Na]+)、α-亚麻酸(m/z:301.25[M+Na]+)。另外,由于在本研究队列中,年龄、体脂率、身高等基线指标在多组统计分析中具有显著性差异(表1),且本研究队列人群年龄集中分布[95%置信区间(confidence interval,CI)]在59~81岁,临床上该年龄段人群常伴有血糖、血脂代谢异常等其他相关代谢疾病。为进一步研究临床基线和其他代谢疾病对筛选得到的心脑血管标志物的影响,我们将年龄、身高、体脂率这3种临床基线指标和高血压、糖尿病、高脂血症这3种疾病作为协变量纳入回归分析。由表2可见,代谢标志物的OR在加入各协变量前后几乎无变化,证明上述临床基线指标和代谢疾病与本研究筛选出的6个代谢标志物关联较小。
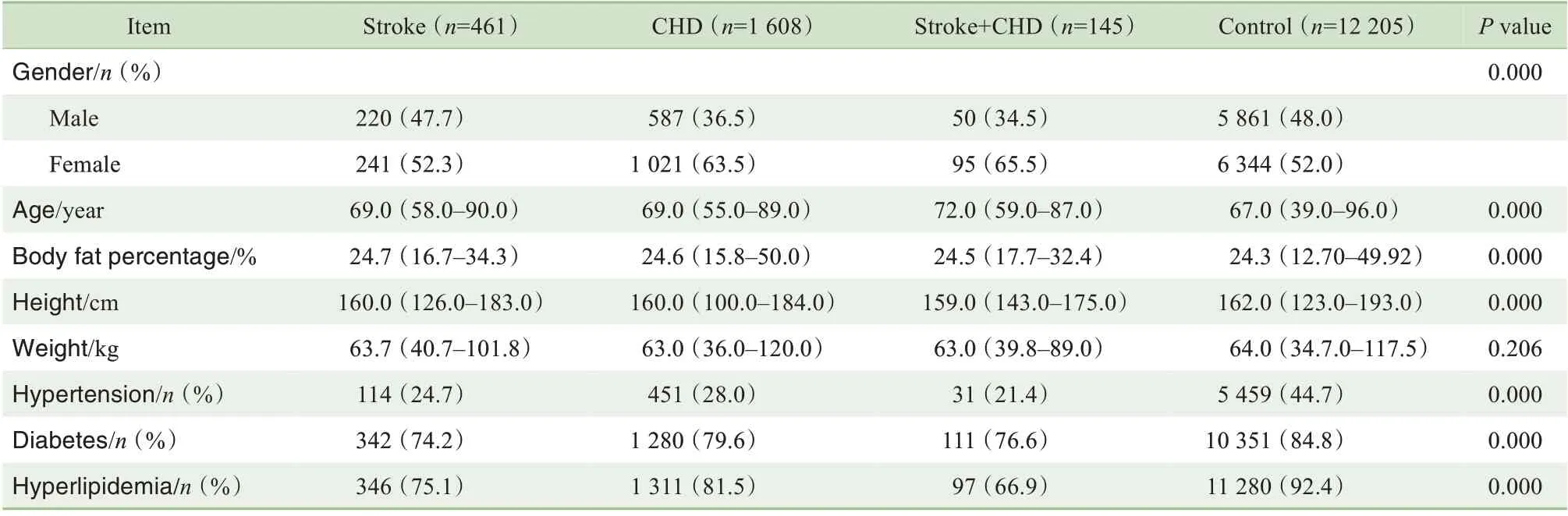
表1 队列人群的基线特征Tab 1 Baseline characteristics of the study cohort

表2 临床基线指标和代谢疾病对标志物影响的评估Tab 2 Assessment of clinical baseline indicators and comorbidity metabolic diseases impact on selected biomarkers
上述代谢物在队列人群中显示出2 种不同的集群趋势(图2A),证明了经筛选得到的差异代谢物可能作为提示心脑血管疾病发生发展相关的潜在代谢标志物。进一步地,6 个差异代谢物可以归为“酮体代谢因子”“脂肪酸代谢因子”2 大集群。“酮体代谢因子”集群中,冠心病单患组血浆中氨基磺酸、乙酰乙酸、甲基丙二酸的强度显著增加,而在脑卒中单患组、心脑血管共患组中三者显著下降(图2B);其中,冠心病单患组、心脑血管共患组的氨基磺酸变化差异最大(下调10.36%)。“脂肪酸代谢因子”集群中,冠心病单患组、心脑血管共患组中葡萄糖、半乳糖醛酸、α-亚麻酸的强度显著降低,而在脑卒中单患组中三者显著增加(图2C)。

图2 筛选出的代谢标志物Fig 2 Screened metabolic biomarkers
2.4 差异代谢通路分析
依据以上鉴定出的代谢标志物,按照P<0.05 筛选出相关的代谢通路。对心脑血管共患组、脑卒中单患组、对照组、冠心病单患组中呈递增趋势的氨基磺酸、乙酰乙酸、甲基丙二酸,鉴定出3 种相关代谢通路(图3A),分别为:①代谢分解始于肌肉细胞,同ATP 合成密切相关的缬氨酸/亮氨酸/异亮氨酸的降解通路(P=0.000)。②同心脏和大脑供能密切相关的酮体合成与降解通路(P=0.006)。③同酮体合成、短链脂质合成、柠檬酸循环、糖酵解、谷氨酸合成密切相关的丁酸甲酯代谢通路(P=0.019)。对心脑血管共患组、冠心病单患组、对照组、脑卒中单患组中呈递增趋势的葡萄糖、半乳糖醛酸、α-亚麻酸,鉴定出2 种相关代谢通路(图3B),分别为:①同不饱和脂肪酸合成密切相关的亚麻酸代谢通路(P=0.024)。②同葡萄糖分解、ATP 合成密切相关的糖酵解通路/非碳水化合物碳底物合成葡萄糖密切相关的糖异生通路(P=0.049)。

图3 代谢通路分析Fig 3 Metabolic pathway analysis
3 讨论
本研究探讨了新型NELDⅠ-MS快速提取心脑血管疾病大队列人群PMFs 的可能性。代谢分析的研究工具主要为核磁共振技术和质谱技术。受制于只能鉴定原子种类,核磁共振在临床生物样本代谢分析的物质鉴定受到掣肘[5]。而现行主流液相/气相质谱技术中严格的样本预处理步骤,如色谱的样本衍生化和纯化[6-7],导致其分析速度慢(0.25~1.5 h/样本)、样本消耗量大(20~400 μL/样本)、通量低(≈100 个样本/d),不利于大队列代谢分析。基于无机纳米材料的尺寸选择效应及表面化学选择性,我们课题组前期开发了NELDⅠ-MS,采集了如血清、尿液、血浆等生物体液样本的PMFs[3-4,8-10]。通过该技术,实现了快速(1 min内完成检测)、高通量(日均检测约1 500个样本)、低消耗(仅需1 μL 血浆样本)的代谢指纹采集。相关代谢指纹具有高维度的数据空间特点(单样本可提取345 个代谢信号峰),基于NELDⅠ-MS 有望实现大队列代谢分析,可用于后续挖掘PMFs 与心脑血管疾病间的内在联系,为临床决策支持提供精准、个性化的指导意见。
分子组学为心脑血管疾病发病机制研究提供了新的契机,有助于阐明机制并寻找新的药物作用靶点,其中主要包括基因组学、蛋白组学以及代谢组学等。在基因层面,鉴于大多数心血管疾病已被证实与遗传高度相关,相关研究主要集中在遗传相关基因以及特定DNA 序列变异[11-12]。如LACAZE 等[13]对25 个遗传性心血管疾病的基因进行靶向测序,发现变异KCNQ1和SCN5A同心脏骤停相关。在蛋白层面,以定义新潜在标志物为目标的蛋白质组学已取得显著进展,研究[14]发现了同心脑血管疾病相关的蛋白标志物在炎症、伤口愈合、蛋白水解、胞外基质组织中起重要作用。在代谢层面,代谢组研究通过对代谢物及其差异调控代谢通路展开分析,确定同心脑血管疾病或危险因素相关的代谢标志物。代谢组测量生物通路中的下游产物,发现其作为基因调控和蛋白表达的结果与疾病表型关系密切。如KHAN 等[15]在400 例队列人群的血清样本中发现,同健康对照组相比,脑卒中组血清中L-色氨酸、3-甲氧基酪胺、甲硫氨酸、同型半胱氨酸、异亮氨酸、肉碱、精氨酸、亚油酸和鞘氨醇特异性升高;任繁栋等[16]在88例队列人群的血浆样本中发现,氨基酸代谢在冠心病组的生理代谢过程中发挥重要作用。
本研究筛选确认了2 大心脑血管疾病相关的代谢风险集群,其在不同组别人群中有完全不同的代谢差异。相关代谢物主要涉及2 条代谢通路的改变:酮体代谢异常及脂肪酸代谢异常。在长时间禁食,严格限制碳水化合物期间或非常剧烈的运动等极端条件下,脂肪酸转化为酮体为身体供能[17-19]。成人健康心脏中,心脏的首选底物是乙酰辅酶A(脂肪酸的主要代谢物),其供能比例达40%~60%。在结构性心脏病早期,脂肪酸氧化减少,引起心脏适应性代谢过程重新编程,增加对酮体供能的依赖。总体而言,本研究发现葡萄糖、乙酰乙酸等心脏关键供能物质在脑卒中单患组、冠心病单患组、心脑血管共患组和对照组中的强度分布差异,能为葡萄糖和乙酰乙酸作为心脏细胞中竞争性供能物质提供一定参考线索[20-21]。因此,研究证实酮体、脂肪酸、糖酵解/糖原异生等相关代谢通路对心脑血管发生、进展高度相关,疾病进展过程中或伴随着相关代谢通路的差异调控[22-23]。
已开发的心脑血管疾病标志物包括上游的核酸/蛋白标志物和下游的代谢标志物。核酸等遗传标志物为主的遗传信号有助于探索底层生物学机制,蛋白等标志物有助于在功能执行层面进行深入探究。下游的代谢相关标志物则可以通过建立分子组与表型间联系,在分子结果层面实现对患者疾病状态和治疗进展的实时监测,因此有助于疾病的治疗干预。另外,作为一项大队列代谢分析的工作,我们的研究存在以下局限:未考虑药物服用对血浆代谢组学研究的影响;未将PMFs 和临床生化实验室指标共同结合做整合,分析心脑血管疾病发生机制。
综上所述,本研究利用新型质谱技术,提取了14 419 例队列人群的PMFs,并联合代谢调控差异、代谢调控表达筛选出酮体代谢异常、脂肪酸代谢异常等2 组在心脑血管疾病中表达趋势不同的代谢标志物,有望为心脑血管疾病发病机制提供一定的代谢解释。更重要的是,本研究所提出的实验设计思路也将为其他疾病的大队列代谢分析提供一定参考。

