肾移植受者术后肺部感染风险预测模型的构建及效果评价
宫晶 窦晓庆 丁良成 孙亚楠 李景余 孟庆慧
肾移植是目前终末期肾病最理想的治疗方式。随着医疗水平的提高,肾移植术后并发症呈明显下降趋势。但由于长期术前透析、术后应用免疫抑制剂等,感染仍是肾移植受者术后的常见并发症,病死率为15%~20%[1],其中以肺部感染最为常见,可能导致呼吸衰竭,病死率高达50%[2]。据研究报道,国外肾移植受者术后肺部感染发生率为4.72%[1],国内为22.73%[3]。肾移植受者术后肺部感染起病隐匿、进展迅速、病情严重,尤其是重症肺炎,致死率和致残率非常高[4]。如何预防和控制肾移植术后肺部感染是提高受者生存率及生活质量亟需解决的问题。目前,研究大多集中于肾移植受者术后肺部感染的危险因素分析[5-6],暂未聚焦到其风险预测模型的建立。因此,本研究旨在建立适合医护人员预测肾移植受者术后肺部感染的风险预测模型,以期达到动态监测及有效预防的目的。
1 资料与方法
1.1 研究对象
回顾性分析2016年1月至2020年4月于山东省潍坊市人民医院泌尿外科接受肾移植的197例受者的临床资料(模型组)。纳入标准:(1)首次施行肾移植手术;(2)术前肺功能评估正常;(3)术前6个月内无明确肺炎病史。排除标准:(1)二次移植;(2)胰肾联合移植;(3)外院施行肾移植手术;(4)病历资料不完整。根据术后1年内是否发生肺部感染分为肺部感染组(感染组,42例)和非肺部感染组(非感染组,155例)。感染组中男30例,女12例,年龄42(34,51)岁,原发病包括慢性肾盂肾炎21例、慢性肾功能不全14例、原发性肾小球疾病4例、多囊肾2例、高血压肾病1例;非感染组中,男117例,女38例,年龄42(34,48)岁,原发病包括慢性肾盂肾炎79例、慢性肾功能不全45例、原发性肾小球疾病22例、高血压肾病2例、多囊肾2例、紫癜性肾炎2例、糖尿病肾病1例、IgA肾病1例、肾病综合征1例。本研究经潍坊市人民医院伦理委员会批准,受者及家属均签署知情同意书。
选取2020年5月至2020年11月在同一医院同一科室接受肾移植手术且符合标准的45例受者进行验证(验证组),年龄(42±10)岁,男38例,女7例;感染组8例,非感染组37例。
1.2 诊断标准
根据中华人民共和国卫生部2001年制定的《医院感染诊断标准(试行)》中定义的肺部感染诊断标准[7],即患者出现呼吸系统症状如咳嗽、脓痰和呼吸深大,肺部叩诊出现浊音或听诊可闻及干湿啰音,经胸部X线检查出现进行性浸润或新浸润、形成空洞、胸腔积液,并同时有以下任一情况则诊断为肺部感染:(1)新出现脓痰或痰液特性改变;(2)痰液或血液细菌学培养获得病原菌。
1.3 研究内容
收集两组受者的临床资料,包括受者个体因素、疾病因素、治疗因素、实验室检查结果。受者个体因素包括性别、年龄、体质量指数(body mass index,BMI)、吸烟史、酗酒史、原发病病程、供者来源等;疾病因素包括高血压、糖尿病、肺部疾病等;治疗因素包括术前透析、术前诱导方案、术前抗菌药物使用情况、围手术期内且在肺部感染发生之前是否发生误吸等;实验室检查结果包括白细胞、淋巴细胞、白蛋白、血清肌酐、术前供肾脓液培养病原菌情况等。
采用美国胸科医师协会提出的肺炎严重指数(pneumonia severity index,PSI)评分系统对肾移植受者进行肺部炎症程度评价,PSI总分=年龄+危险因素得分总和(女性减10分),总分≤50分为Ⅰ级,51~70分为Ⅱ级、71~90分为Ⅲ级、91~130分为Ⅳ级,>130分为Ⅴ级,总分越高,肺炎越严重[8]。研究者根据自行设计的临床资料调查表进行资料收集,根据收集的病例资料计算PSI分值。由另一名研究者核查收集资料的完整性、准确性及真实性并再次核算PSI分值。分析肾移植受者术后肺部感染的发生情况。对肾移植受者发生肺部感染的危险因素进行单因素和多因素分析,建立预测模型并评价模型校准度。
1.4 统计学方法
采用SPSS 26.0软件进行统计学分析。计数资料以率表示,组间比较采用χ2检验;正态分布的计量资料以均数±标准差表示,组间比较采用两独立样本t检验;非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用秩和检验。采用logistic回归构建预测模型。单因素分析用于候选因子的初步选择,将单因素分析中差异具有统计学意义的候选因子采用多元logistic回归分析,P<0.05为差异有统计学意义。根据截距及各独立危险因素的偏回归系数构建肾移植受者术后肺部感染风险预测模型。应用受试者工作特征(receiver operating characteristic,ROC) 曲 线 下 面 积(area under the curve,AUC)评价模型区分度,采用Hosmer-Lemeshow拟合优度检验评价模型校准度,P>0.05表明模型校准度较好。
2 结 果
2.1 肾移植受者术后肺部感染的发生情况
197例肾移植受者中,42例(21.3%)发生肺部感染,其中PSI评级Ⅰ级38例(90%),Ⅲ级1例(2%),Ⅴ级3例(8%)。13例(31%)发生于术后1个月内,22例(52%)发生于术后2~6个月,7例(17%)发生于术后6个月后。细菌感染19例(45%),真菌感染7例(17%),病毒感染10例(24%),混合感染6例(14%)。
细菌感染中最常见的病原菌为肺炎克雷伯菌(8例),其后依次为铜绿假单胞菌(5例)、鲍曼不动杆菌(4例)、肺炎支原体(3例)、大肠埃希菌(2例)、弓形菌(1例)、豚鼠气单胞菌(1例);真菌感染中最常见的为曲霉(8例),其次为白假丝酵母(1例);病毒感染中最常见的为单纯疱疹病毒(11例),其后依次为巨细胞病毒(2例)、多瘤病毒(2例)、流行性感冒病毒(1例)。
2.2 肾移植受者术后发生肺部感染危险因素的单因素分析
单因素分析结果显示,吸烟史、高血压史、糖尿病史、肺部疾病史、围手术期误吸、白蛋白<35 g/L是肾移植受者术后发生肺部感染的危险因素(均为P<0.05,表1)。

表1 肾移植术后发生肺部感染危险因素的单因素分析Table 1 Univariate analysis of risk factors for pulmonary infection after kidney transplantation
2.3 肾移植受者术后发生肺部感染危险因素的多因素分析
将单因素分析中有统计学意义的因素即吸烟史、高血压史、糖尿病史、肺部疾病史、围手术期误吸、白蛋白作为自变量,“0” =无,“1” =有,以受者是否发生肺部感染为因变量,进行多元logistic回归分析。结果显示,存在吸烟史、糖尿病史、肺部疾病史及白蛋白<35 g/L是肾移植受者术后发生肺部感染的独立危险因素(均为P<0.05,表2)。
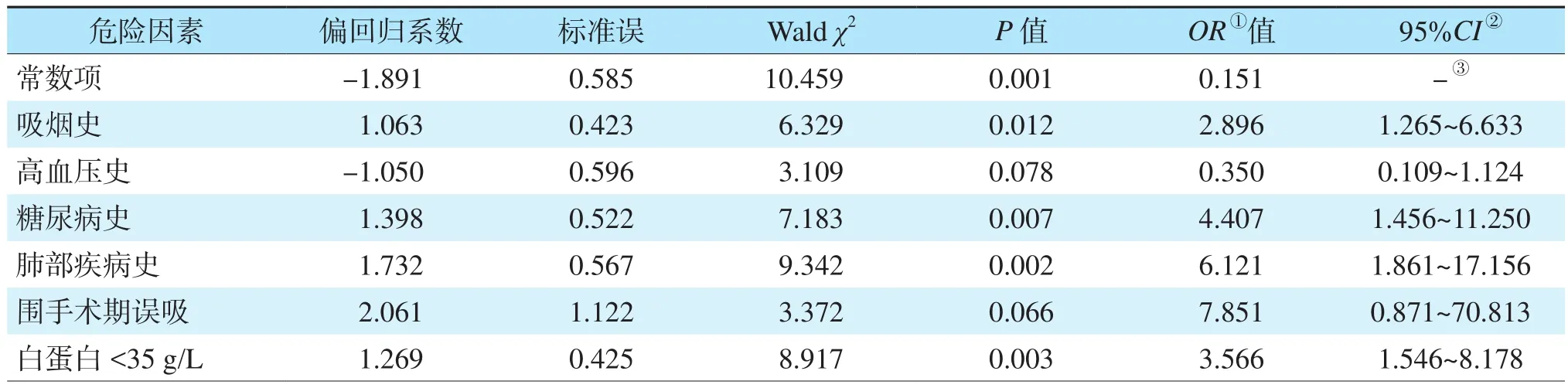
表2 肾移植术后发生肺部感染危险因素的多因素分析Table 2 Multivariate analysis of risk factors for pulmonary infection after kidney transplantation
2.4 肾移植受者术后肺部感染风险预测模型的建立及效果评价
将多因素分析中具有统计学意义的危险因素赋值后构建模型,最终建立方程logit(肾移植受者术后1年内肺部感染)=-1.891+1.063×吸烟史(有=1,无=0)+1.398×糖尿病史(有=1,无=0)+1.732×肺部疾病史(有=1,无=0)+1.269×白 蛋 白(<35 g/L=1,≥35 g/L=0)。
肾移植受者术后肺部感染风险预测模型的AUC为0.788[95%可信区间(confidence interval,CI)0.708~0.869,P<0.001,图1A],以最大约登指数(0.431)确定最佳临界值为-0.725,灵敏度和特异度分别为0.786和0.645。Hosmer-Lemeshow拟合优度检验结果显示模型预测值和实际观测值间的一致度较好(χ2=0.375,P=0.945)。
2.5 肾移植受者术后肺部感染风险预测模型应用效果分析
分析验证组45例受者和模型组197例受者基本资料,结果显示两组吸烟史、糖尿病史、肺部疾病史、白蛋白比较,差异均无统计学意义(均为P>0.05,表3)。

表3 模型组和验证组危险因素比较Table 3 Comparison of risk factors between model group and validation group
ROC曲线结果显示验证组的AUC为0.834(95%CI0.661~0.978,P<0.05, 图1B)。Hosmer-Lemeshow拟合优度检验结果显示模型校准度较好(χ2=3.820,P=0.282)。
2.6 肾移植受者术后肺部感染风险预测模型风险值划分
模型组预测概率值呈偏态分布,P25=-1.891,P50=-0.828,P75=-0.493。考虑到最佳临界值为-0.725,划定风险层次为:<50%(预测概率值<-0.828)为低危,50%~75%(预测概率值-0.828~-0.493)为中危,>75%(预测概率值>-0.493)为高危。本模型预测当P>-0.725时可认为受者会发生肺部感染,预测验证组10例受者发生肺部感染,35例受者未发生肺部感染,肺部感染发生率为22%。实际验证组8例受者发生肺部感染,37例受者未发生肺部感染,肺部感染发生率为18%。45例验证组受者发生肺部感染的风险分层为低危组1例,占比为1/8;中危组5例,占比为5/8;高危组2例,占比为2/8。
3 讨 论
有研究表明,肾移植术后发生肺部感染的受者,随着住院时间延长,经济负担也相应的增加[9-10],且肾移植受者术后肺部感染伴有高发生率和病死率的特点[11-13],因此,在肾移植术后早期进行评估及预防具有积极意义。前期诸多学者集中于探讨肾移植受者术后肺部感染的危险因素,强调识别危险因素对肺部感染的预防有重要意义,但由于危险因素种类及数量较多、评估人员认知水平的差异性,导致危险因素辨识上易出现结果异质性[3-6]。因此,在集中探讨危险因素的同时,关注开发有效的评估工具也至关重要。本研究构建的肾移植受者术后肺部感染风险预测模型,将各个危险因素及其对肺部感染的影响程度直观地展现在公式中,运用模型可对受者进行及时评估并识别高风险受者,根据风险值分层结果制定相应的预防策略,在满足不同风险水平受者需求的同时避免预防不足或者过度预防。
本研究结果显示,吸烟史、糖尿病史、肺部疾病史、白蛋白<35 g/L是肾移植受者术后发生肺部感染的独立危险因素,与既往研究结果一致[14-20]。受者吸烟史对肺部的危害早已达成共识[20],长期吸烟会破坏气管的纤毛屏障,从而导致机体防御机制下降。肾移植手术需常规进行气管插管麻醉,引起呼吸道黏膜损伤,细菌可通过管道入侵,从而引起受者肺部感染[21-22]。因此,鼓励肾移植受者戒烟、术前术后进行肺功能锻炼、术后尽早拔管等可以减少肺部感染的发生。血糖升高会损害中性粒细胞功能,导致外周血中性粒细胞/淋巴细胞比值明显升高,且外周血淋巴细胞计数低下容易继发肺部感染[23-24]。有糖尿病史的肾移植受者通常患有糖尿病肾病,且病程长,病情复杂。有研究报道,血糖>11.1 mmol/L会导致蛋白合成能力下降,组织修复能力减弱[25],而肾移植术后免疫抑制剂的使用更易引起机体防御能力下降,继发肺部感染。因此,建议肾移植受者术前严格控制血糖水平。
研究证明,慢性阻塞性肺疾病患者的肺泡巨噬细胞受损,清除呼吸道病原体和凋亡细胞的能力减弱[26];流行性感冒病毒等感染能改变支气管上皮局部防御机制[27],使肾移植受者更易遭受病原体侵袭而引起肺部感染。因此,应重视患有肺部疾病史的受者,并根据个人情况采取相应的预防策略。手术创伤术后白蛋白水平的降低可归因于术中失血、血液稀释和全身炎症,还可能由于毛细血管的通透性增加所致[28]。手术创伤会导致内皮糖萼破坏,而白蛋白可保护内皮糖萼并维持内皮屏障功能[29]。术后内皮糖萼损伤和低白蛋白血症的恶性循环可能导致受者的毛细血管白蛋白渗漏和间质水肿。此外,低白蛋白还可能通过促进肉芽肿形成和减少胶原蛋白合成抑制先天免疫反应,导致感染和其它并发症[28,30-31]。因此,检测血清白蛋白水平,及早发现术后低蛋白血症可能有助于肾移植受者术后肺部感染的监测和预防。
本研究通过对肾移植受者的临床资料进行分析,筛选出术后肺部感染相关的危险因素,构建的风险预测模型可有效预测肾移植受者术后肺部感染的发生,且所需的指标获取简单、评价快捷,可为肾移植受者术后肺部感染的预防与控制提供一定的参考依据。但本研究为单中心研究,获取的样本量相对较少,年限跨度大,相关结论还仍需要进一步研究。本课题组后期将进行多中心、大样本的研究,以完善风险预测模型,并在临床实践中进一步修正该模型。

