甘草根系分泌物乳酸外源施用对GuSQS1和GubAS基因表达及甘草酸含量的影响
石 晶, 梁新华
(宁夏大学 生命科学院,宁夏 银川 750021)
甘草的主要药用成分为甘草酸、甘草黄酮、甘草多糖及生物碱类物质[1],其中甘草酸的含量是评价甘草药材及成药质量的主要依据[2].甘草酸在植物体内的合成起始于甲羟戊酸,然后再经过一系列复杂的酶催化反应,由鲨烯、氧化鲨烯、β-香树脂醇等前体物质最终合成.文献显示,鲨烯合成酶(squalene synthase,SQS1)与β-香树脂醇合成酶(β-amyrin,β-AS)是甘草酸生物合成的关键酶[3],决定着甘草酸在植物体内的含量.目前,对这2种关键酶基因的表达、调控及其功能研究已成为甘草酸生物合成研究领域中的热点.
研究发现,松科、禾本科、豆科、玄参科等科属植物具有化感作用,并鉴定出皂苷类、酚酸类、有机酸、芳香族化合物等多种化感物质[4—9].由这些化感物质引起的化感作用既包括不同物种间的抑制或促进作用,也包括作用于同物种或者其自身的化感自毒作用.近几年,有关根及根状茎入药的药用植物化感作用研究较多[10—11].实验发现,随着人工甘草种植年限的延长,出现甘草病虫害逐年加重进而影响其药材质量、相似于其他根茎类药材出现的化感自毒现象.这些现象的出现是否由甘草自身根系分泌物影响所引起,有待进一步研究.有机酸是化感物质中的一大类,研究发现,甘草根系分泌物中存在低相对分子质量有机酸——乳酸,其实际分泌浓度为1×10-4mol/L[12].笔者选择实际分泌浓度的乳酸溶液外源培养甘草幼苗,检测其对甘草幼苗根中2种甘草酸生物合成关键酶基因GuSQS1,GubAS的表达及甘草酸含量的影响,以期为深入研究甘草是否存在化感自毒作用及甘草人工栽培种植提供参考.
1 材料与方法
1.1 甘草种子的萌发及幼苗的培养
乌拉尔甘草种子,采自宁夏盐池县花马池镇人工种植甘草基地,由宁夏大学王俊教授鉴定为甘草(GlycyrrhizauralensisFisch.).挑选600粒颗粒均一、饱满、色泽正常的甘草种子,按文献[3]所述方法处理.随后在8 个已高温、高压及灭菌的培养皿上铺上双层滤纸,将上述600 粒充分吸胀的甘草种子按每皿70 粒,分至8 皿.将所有培养皿置于25 ℃的恒温培养箱中培养.每天定时给各组培养皿添加蒸馏水(各2 mL).第3天起,从上述8 个培养皿中选择下胚轴突破种皮达1 cm、长势基本一致的甘草种子,移至已灭菌的泡沫板上,使每个泡沫板上甘草种子数量相同.分别将有种子的泡沫板置于统一大小的塑料红桶(上沿直径25 cm、高18 cm),用自来水培养,每桶4 L,每隔1周更换1次自来水,每天定时通气,利用人工光源补充光照,光暗周期为14 h/10 h.
1.2 乳酸外源的处理
为探讨甘草根系分泌物乳酸对甘草酸生物合成关键酶基因及甘草酸含量的影响,排除甘草根系分泌物中其他成分的影响,采用外源乳酸处理的方法.乳酸纯品购自上海源叶生物科技有限公司(w=98 %,HPLC级,CAS号为50-21-5),按实际分泌浓度(1×10-4mol/L)配制成相应溶液,置于4 ℃冰箱内备用.
选取培养2个月、长势基本一致的甘草幼苗材料经1×10-4mol/L乳酸溶液处理和等量蒸馏水对照处理.每种处理分别以3盆长势基本一致的甘草幼苗(每盆80株)作为3个重复,分别于处理0,1,3,6,9,12,24,48,72,96 h取样.在每一个取样时间,从上述2种处理的6 个盆中分别每盆选取3 株甘草幼苗,装于标记编号的布袋中.液氮速冻后,置于-80 ℃超低温冰箱中备用,并通过实时荧光定量PCR相关检测.
处理96 h结束,分别从乳酸处理组与对照组盆中取样,用吸水纸吸干根部溶液,于105 ℃杀青、70 ℃烘干,粉碎后过筛,测定甘草酸的含量.
1.3 实时荧光定量PCR检测GuSQS1,GubAS表达
所用试剂盒为大连TaKaRa公司出品的MiniBEST Nucleic Acid Isolation Kits,货号为9769.具体提取步骤参照说明书进行,提取后通过核酸电泳检测RNA的质量及完整性.首先向无RNase且冰浴处理的0.5 mL无菌离心试管中依次加入模板RNA(5.0 μL)、Oligod(T)(3.0 μL).随后轻轻混匀并离心分离(70 ℃、10 min)后冰浴3 min.再依次向离心管中加入5倍体积RT Buffer(4.0 μL)、dNTP( 1.0 μL)、反转录酶(0.8 μL)、Rasin(RRI,0.5 μL)、ddH2O( 5.7 μL).轻轻混匀,于42 ℃、60 min、70 ℃,15 min下进行离心分离.最后将离心试管置于冰上终止反应,反转录后的cDNA置于-20 ℃保存备用.
1.4 引物的设计与合成
在NCBI中查找GuSQS1基因(GenBank登录号为AM182329)、GubAS基因(GenBank登录号为AB037203.1)及GuActin基因(GenBank登录号为EU190972),通过BioXM 2.6及Primer 5.0设计如下特异引物,并由上海生物工程有限公司合成.Actin基因引物(扩增片段长度 为229 bp)序列有GuActin-F:5’-CCTCTCTCTTTATGCCAGTG-3’;GuActin-R:5’-GCTTCTCCTTTATGTCACGG-3’.角鲨烯合成酶基因GuSQS1引物(扩增片段长度为157 bp)序列有GuSQS1-F:5’-GGTCACTAATGCTTTGTTGC -3’;GuSQS1-R:5’-TAACTACAC-
CTCCGAAGACT-3’.β-香树脂醇合成酶基因GubAS引物(扩增片段长度为209 bp)序列有GubAS-F:5’-ACAGAGAGAGGATGGTGGAT-3’;GubAS-R:5’-GCCAATCACCCTCTTCCAAT-3’.
1.5 实时荧光定量PCR
向反应体系中加入SYBR Premix(10.0 μL)、正向引物(0.8 μL)、反向引物(0.8 μL)、模板cDNA(1.0 μL)、ddH2O(7.4 μL).GuSQS1基因反应程序:94 ℃预变性3 min、94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸30 s,共30 个循环,最后72 ℃延伸5 min.GubAS基因反应程序:94 ℃预变性3 min、94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,共30 个循环,最后72 ℃延伸5 min.GuActin基因反应程序:94 ℃预变性3 min、94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸30 s,共30 个循环,最后72 ℃延伸5 min.
1.6 甘草酸含量的测定
高效液相色谱检测条件按《中国药典》(2005版)进行.色谱柱为爱尔兰Waters Corporation公司生产;填料为5 μm ODS2;尺寸为4.6 mm×150 mm;流动相为甲醇、醋酸铵(浓度为0.2 mol/L)、冰醋酸(体积比为66∶33∶1);0.45 μm有机系微孔滤膜过滤后使用;检测波长为250 nm;色谱柱柱温为室温;流速为1 mL/min.对照品溶液的制备:取甘草酸单铵盐对照品10 mg,置于50 mL容量瓶中,用流动相溶解并稀释至刻度,摇匀后即得(每1 mL中含甘草酸单铵盐0.2 mg,折合甘草酸0.195 9 mg).供试品溶液的制备:称取前述甘草根粉末0.3 g,置于50 mL容量瓶中,加流动相45 mL,超声处理(功率为200 W,频率为20 kHz)30 min后取出并放冷,加流动相至刻度,摇匀后过滤即得.
1.7 数据分析与处理
所有反应均为3个生物学重复和技术重复.将Real-time PCR仪所得的样品Ct值,利用2-△△Ct方法转化为基因相对表达量.通过Excel 软件进行数据录入及图表的绘制,通过SPSS 16.0进行统计分析.
2 结果与分析
2.1 实时荧光定量检测方法的特异性
针对2个目的基因GuSQS1,GubAS及看家基因GuActin设计特异性引物,进行实时荧光定量PCR检测,得到良好的扩增曲线和熔解曲线(图略).由图可知,扩增曲线呈S型,熔解曲线显示荧光定量PCR产物只有1个峰,无引物二聚体和非特异性扩增峰.结果表明,3种引物的特异性较高,可用于后续实验.
2.2 甘草根系分泌物乳酸外源处理对GuSQS1基因表达的影响
为研究外源乳酸处理对甘草酸生物合成关键酶基因GuSQS1在其根及叶中的表达,以蒸馏水培养下长势基本一致的甘草幼苗为对照组、甘草根系分泌物乳酸(1×10-4mol/L)外源处理为处理组.在处理0,1,3,6,9,12,24,48,72,96 h分别采集甘草幼苗的根和叶.以0 h甘草幼苗的根中GuSQS1基因相对表达量为1,对2种处理条件下甘草幼苗根和叶中GuSQS1基因的表达量进行比较.结果表明,在甘草幼苗的根和叶组中,乳酸(1×10-4mol/L)处理和蒸馏水对照组、在不同时间段下,GuSQS1基因的表达量均存在显著水平差异.
对于乳酸处理组,在甘草幼苗的根中,GuSQS1基因的表达,在整个处理期内呈现小幅升高—降低—快速升高—迅速下降—再升高至与处理初期基本持平的趋势(图1).GuSQS1基因在处理0~3 h时表达量显著下降,在3~6 h表达量又极显著升高并于6 h达到整个处理期内最高值(P<0.01),是对照组的1.2 倍.在9,12 h时表达量极显著下降,在24 h时该基因表达量又显著上升,在24~96 h该基因表达量变化相对平稳,与处理0 h的表达量相近.而对于蒸馏水对照组,在甘草幼苗的根中,GuSQS1基因的表达,则呈现升高—降低—升高—降低的变化趋势,其中GuSQS1基因的表达量在9 h极显著高于其他时间,表达量次高峰出现在3,6,72 h,这3个时间下的表达量又极显著高于其他时间下的.整体而言,在乳酸处理组的甘草幼苗根中,GuSQS1基因的表达量显著低于蒸馏水对照组的(P<0.05)(图1).
在甘草幼苗的叶中,GuSQS1基因的表达量极显著低于其根中的(P<0.01),且为根中GuSQS1基因表达量的10%~50%.其中,在乳酸处理组的甘草幼苗叶中,GuSQS1基因的表达量在整个处理期内均低于1,在不同时间,叶中该基因表达量的变化基本呈现降低—升高—降低的变化趋势:从0 h开始下降,1~6 h逐渐升高,并在6 h达到最高值,极显著高于其他时间下的表达量(P<0.01).但从6 h后GuSQS1基因的表达量持续下降,其中在24 h降至整个处理期内最低,之后GuSQS1基因的表达虽有小幅上升,但依然极显著低于处理6 h时的(P<0.01).在蒸馏水对照组的叶中,GuSQS1基因的表达在整个处理期内的高峰出现在9~12 h,最低值出现在1 h.比较乳酸处理与蒸馏水对照组叶中GuSQS1基因的表达,发现乳酸处理的叶中GuSQS1基因表达量高峰的出现较蒸馏水对照组提早3 h.在乳酸溶液处理条件下、整个处理期内,该基因在叶中的表达量略高于蒸馏水对照组的(图1).
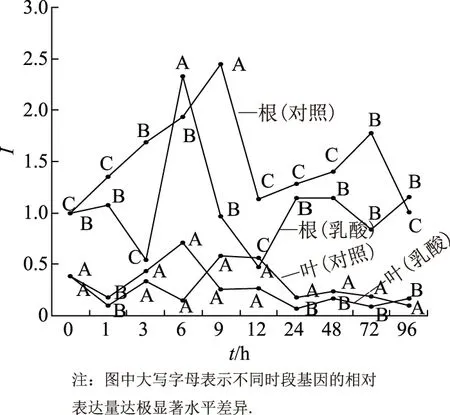
图1 甘草根系分泌物乳酸对甘草幼苗根和叶中GuSQS1基因表达的影响
2.3 甘草根系分泌物乳酸外源处理对GubAS基因表达的影响
以蒸馏水培养下的甘草幼苗为对照组,以甘草根系分泌物乳酸(1×10-4mol/L)外源处理甘草幼苗.在处理0~96 h分别采集甘草幼苗,以0 h根中GubAS基因相对表达量为1,对幼苗根和叶中不同时间下GubAS基因的表达进行分析.结果表明,在甘草幼苗的根和叶中,乳酸(1×10-4mol/L)处理和蒸馏水对照组在不同时间下,GubAS基因的表达量均存在显著及极显著水平差异.
在甘草幼苗的根中,GubAS基因的表达量极显著高于叶中的(P<0.01).且与乳酸(1×10-4mol/L)处理后GuSQS1基因在根中的表达变化趋势基本相似.乳酸处理后,甘草幼苗根中GubAS基因的表达也呈现降低—升高—降低—升高—降低的变化趋势(图2):从0~3 h逐渐降低,3~6 h迅速升高,并在6 h达到第1个峰值,且是0 h表达量的1.94 倍.从6~12 h表达量迅速下降,9~12 h时表达量恢复到与3 h相似的程度,随后从12~48 h再次逐渐升高,并在48 h达到表达量的第2个峰值,且6,48 h的表达量均极显著高于其他时间下的(P<0.01),从48~96 h表达量又一次逐渐下降.与乳酸处理组表现不同,GubAS基因在对照组的根中,呈现升高—降低—升高—降低的表达趋势,表达量从0~3 h逐渐升高,在3 h后下降,但在9 h达到第1个表达峰值,且是0 h表达量的2.18 倍.随后表达量迅速下降,在12 h恢复到处理0 h的表达水平,之后表达量再一次升高,并于24 h达到表达的第2个峰值,且是0 h表达量的2.10 倍.3,9,24 h的表达量均极显著高于其他处理时间下的(P<0.01).从24~96 h表达量又一次下降,在96 h表达量处于整个处理期最低值,极显著低于其他时间下的(P<0.01)(图2).
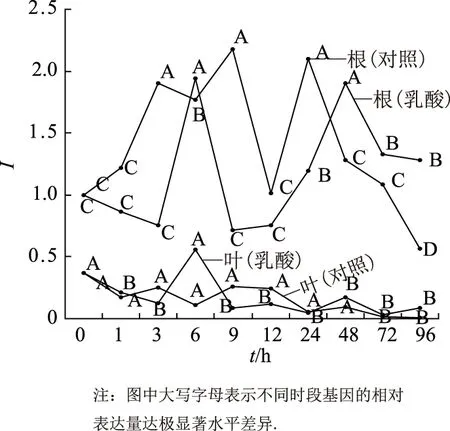
图2 甘草根系分泌物乳酸对甘草幼苗根和叶中GubAS基因表达的影响
与GuSQS1基因在根和叶中的表达情况相同,叶中GubAS基因的表达量极显著低于根中的(P<0.01).在乳酸处理组甘草幼苗的叶中,GubAS基因的表达量在整个处理期内均低于1,在不同时间下,该基因表达量的变化也基本呈现降低—升高—降低的变化趋势,其中,6 h表达量虽然是整个处理期内最大,但与0 h时叶中的不存在显著水平差异.在乳酸处理条件下,0,6 h甘草幼苗叶中GubAS基因的表达量极显著高于其他时间下的(P<0.01).在蒸馏水对照组的叶中,各个处理时间内的GubAS基因在表达量变化上较乳酸处理的平稳,表达量也较乳酸处理下叶中的更低.其中,72,96 h的表达量值显著低于其他时间下的(P<0.05)(图2).
2.4 甘草根系分泌物乳酸外源处理对甘草幼苗根中甘草酸含量的影响
处理96 h时,乳酸处理组甘草幼苗根中的甘草酸含量显著低于对照处理组的(图3),且是对照组的82%.说明一定时间乳酸外源处理,可抑制甘草幼苗根中合成较多的甘草酸.
3 讨论
化感物质是植物生命活动中产生的一些次生代谢物质,大多数为小分子的酚、酸.许多植物中存在化感自毒作用,如花生[13]、大豆[14]、棉花[15]、大蒜[16]等作物,根茎类药用植物如人参[17]、丹参[18]、地黄[19]、当归[20]、贝母[21]和三七[22]等.
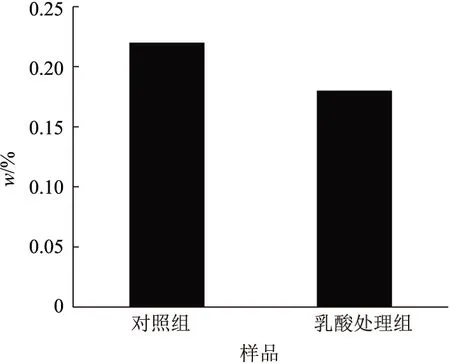
图3 甘草根系分泌物乳酸外源处理对甘草幼苗根中甘草酸含量的影响
乳酸是一种低相对分子质量有机酸.研究表明,根系分泌的有机酸,在植物养分活化与吸收过程中有重要的作用.近年来,关于低相对分子质量有机酸化感作用的研究较多,但大多是有机酸对植物生长、生理指标、土壤环境等所产生的影响以及对矿物中某些元素释放的促进等[23—24].该研究在甘草种子化感自毒作用的研究基础上,分析实际分泌浓度乳酸外源施用,对甘草酸生物合成中2种关键酶基因(GuSQS1,GubAS)在甘草根及叶中的表达及甘草根中甘草酸含量的影响.结果表明,经乳酸(1×10-4mol/L)处理后,甘草幼苗根中GuSQS1,GubAS基因的表达量都极显著高于叶中的(P<0.01).在处理6 h时,甘草幼苗根和叶中GuSQS1,GubAS基因的表达量均达到最高峰.且在乳酸处理下,叶中2个基因表达量虽然较根中的低,但极显著高于对照组叶中的(P<0.01).因此,甘草中是否存在叶中合成的少量角鲨烯以及β-香树酯醇向根部运输,再与根部合成的上述2种物质进一步生物合成甘草酸,这有待于进一步深入研究.从整个处理周期看,外源乳酸处理下GuSQS1,GubAS基因的表达量显著低于对照组中的.在处理周期末,甘草酸的含量也是乳酸处理组显著低于对照组.实际分泌浓度的乳酸整体上降低了GuSQS1,GubAS基因的表达,导致处理期末甘草幼苗根中甘草酸的含量下降.说明甘草酸生物合成关键酶基因的表达改变,可提高或降低该合成途径中次生代谢产物的产率.针对该研究结果,如果从提高甘草酸含量的角度看,可采用乳酸短期的外源处理方法.
研究结果初步说明,甘草根系实际分泌浓度的乳酸外源处理甘草幼苗,虽然在短期内提高了2个甘草酸生物合成中关键酶基因的表达,但从整个处理周期看,降低了2个关键酶基因的表达,从而降低了中间代谢物质(角鲨烯和β-香树脂醇)的合成及积累,最终影响了甘草酸的生物合成与积累.从化感作用角度看,在实际分泌浓度处理6 h内,表现出明显的化感促进作用,但是随着处理时间的延长,反而抑制了GuSQS1,GubAS基因的表达,降低了甘草酸的含量,表现出化感自毒作用.在实际的生长条件下,甘草根系分泌物是诸多物质共存的混合物.研究每一种根系分泌物在实际分泌浓度下,对甘草酸生物合成的影响,可为深入探讨甘草根系中实际根系分泌物对甘草药材品质的影响提供参考.
4 结论
以实际分泌浓度(1×10-4mol/L)乳酸外源处理甘草幼苗不同时间,GuSQS1,GubAS基因的表达量均出现不同程度的改变.GuSQS1基因在乳酸外源处理甘草幼苗的根和叶中,6 h时达到表达量的最大值,而对照组在9 h时达到表达量最大值.GubAS基因在乳酸外源处理甘草幼苗根6,48 h时达到表达量的2个高峰,而对照组在9,24 h时达到表达量的2个高峰.在处理末期,处理组甘草幼苗根中的甘草酸含量显著低于对照组中的.研究表明,实际分泌浓度的乳酸在3 d的处理时间下,对甘草自身产生了一定化感自毒作用.

