维持性血液透析病人肌少症发生现状及影响因素研究
王凯选,于鹏飞,刘志梅*,王思义,邱筱婷
1.青岛大学护理学院,山东 266071;2.青岛市市立医院
维持性血液透析(maintenance hemodialysis,MHD)是终末期肾病病人应用最广泛的肾脏替代疗法。中国肾脏病监测网络(CK‐NET)最新数据显示,我国每百万人口约有402.18 例MHD 病人,总数可达55.3 万例[1]。肌少症(sarcopenia)是一种与增龄相关的以骨骼肌含量减少、肌肉力量及躯体功能下降为特点的退行性综合征[2]。已有研究表明,肌少症的发生与肾功能减退显著相关[3]。肾功能恶化及长期透析可致蛋白质和能量消耗、炎性因子增加等,加之活动量减少,MHD 病人会出现肌肉力量减弱、肌肉结构选择性改变及肌肉萎缩[4],更易罹患肌少症。肌少症不仅可导致病人生活质量下降、突发心血管事件和死亡风险增加,还会带来高额的医疗费用支出[4‐6]。目前,我国针对MHD 病人肌少症的研究尚未成熟,相关影响因素存在争议。因此,本研究旨在探讨肌少症在MHD病人中的发生情况及影响因素,以期为肌少症的早期筛查及干预提供依据。
1 对象与方法
1.1 研究对象 采用便利抽样法选取2020 年10 月—2021 年3 月在青岛市某三级甲等医院血液净化中心接受MHD 治疗的病人作为研究对象。纳入标准:①年龄≥18 岁;②接受MHD 治疗时间≥3 个月。排除标准:①无法配合进行相关检查或问卷调查;②存在生物电阻抗试验禁忌证,如肢体残缺或体内有心脏起搏器等金属植入物;③合并严重并发症,如恶性肿瘤、急性心力衰竭、严重感染等;④近6 个月接受激素或免疫抑制剂治疗;⑤处于妊娠期或哺乳期。本研究已获得医院伦理委员会批准(审批号:QYFY WZLL 25881),纳入病人均知情同意并自愿参加本研究。
1.2 调查工具
1.2.1 一般资料调查表 由研究者自行设计,包括病人个体特征、疾病相关资料、人体测量学指标和实验室检测指标,其中,个体特征包括性别、年龄、吸烟状况、饮酒状况等;疾病相关资料包括透析龄、原发病、是否合并糖尿病等;人体测量学指标包括身高、体重、体质指数(BMI)、肱三头肌皮褶厚度、上臂围、上臂肌围等;实验室检测指标包括血红蛋白、血清蛋白、前清蛋白、空腹血糖、血尿酸、血钙、血磷、三酰甘油、总胆固醇、高密度脂蛋白、低密度脂蛋白、超敏C 反应蛋白、全段甲状旁腺素、单室尿素清除指数、标准蛋白分解率等。
1.2.2 改良定量主观整体评估问卷 根据Kalantar‐Zadeh 等[7]制定的改良定量主观整体评估法(Modified Quantitative Subjective Global Assessment,MQSGA),以问卷调查的形式评估病人营养状况。该法在MHD病人中应用广泛,主要包括体重变化、饮食摄入、胃肠道症状、生理功能状态、并发症、皮下脂肪及肌肉消耗7 项内容,每项内容赋1~5 分,分值越高说明情况越严重。总分7~35 分,得分越高说明营养状况越差。
1.2.3 国际体力活动短问卷(International Physical Activity Questionnaire‐Short Form,IPAQ‐SF) 采用屈宁宁等[8]汉化的国际体力活动短问卷评估病人体力活动情况,其重测信度为0.63~0.89,效标效度为0.72。问卷共7 个条目,调查病人过去1 周内从事高强度、中等强度和步行这3 种不同强度体力活动的情况及每天静坐时间。病人每周从事某种强度体力活动的能量消耗=该体力活动对应的代谢当量(MET)×每周频率(d)×每天活动时间(min),其中,步行、中等强度和高强度体力活动的MET 分别为3.3 MET、4.0 MET 和8.0 MET,总体力活动能量为3 种强度体力活动能量消耗之和。根据国际体力活动问卷工作组推荐的分组标准[9]将病人总体力活动分为高、中、低3 种水平。
1.2.4 肌少症诊断标准 采用2019 年亚洲肌少症工作组(Asian Working Group for Sarcopenia,AWGS)制定的肌少症诊断策略[10]诊断肌少症。①握力:男性<28 kg,女性<18 kg;②步行速度<1.0 m/s;③四肢骨骼肌质量指数:男性<7.0 kg/m2,女性<5.7 kg/m2。符合条件③且满足条件①和(或)条件②即诊断为肌少症。
1.3 资料收集与质量控制 调查前,对2 名研究者进行统一培训,掌握问卷评估及人体测量学指标测量方法。研究者向病人解释研究目的、意义及方法,征得同意后进行调查,采用统一指导语就问卷条目逐一向病人提问,根据病人回答逐项填写,填写完毕后仔细检查资料完整性,若有漏项则当场补齐。研究者通过医院血液透析管理系统获取病人部分一般资料。透析前采用电子握力测试仪(广东香山衡器集团)测定病人握力,要求病人取站立位,双臂自然下垂,使用非内瘘手用力紧握测试仪,测量3 次,每次间隔1 min,记录最大值。测量病人步行速度,要求病人从移动开始以正常步速行走6 m,中途不加速不减速,测量2 次,记录所用时间平均值。透析后30~60 min、饮食饮水之前测量病人身高、体重、肱三头肌皮褶厚度、上臂围,并采用InBody 人体成分分析仪(770,韩国Biospace Co.Ltd)测定病人四肢骨骼肌质量,要求病人去除身上金属物,着轻薄衣物赤足站立于仪器的电极触面上,双手握住手柄并对准电极触面,双臂伸直向两侧展开,利用生物电阻抗原理测定四肢骨骼肌质量,经身高(m)的平方校正后得到四肢骨骼肌质量指数。科室护士采集病人透析前后血标本,研究者核对无误后送检。研究者自行计算病人的BMI、上臂肌围、单室尿素清除指数及标准蛋白分解率。本研究共发放问卷310 份,回收有效问卷308 份,问卷有效回收率为99.4%。
1.4 统计学方法 采用SPSS 22.0 统计学软件进行数据分析。定量资料若服从正态分布以均数±标准差(±s)表示,组间比较采用两独立样本t检验;非正态分布则以中位数(四分位数)[M(P25,P75)]表示,组间比较采用秩和检验。定性资料以频数及百分比(%)表示,组间比较采用χ²检验。采用多因素Logistic 回归分析探讨MHD 病人发生肌少症的影响因素。采用双侧检验,检验水准α=0.05。
2 结果
2.1 肌少症组与非肌少症组病人的临床资料比较 共纳入308 例MHD 病人,其中,有78 例病人被诊断为肌少症,肌少症发生率为25.3%。肌少症组与非肌少症组病人临床资料比较结果见表1。
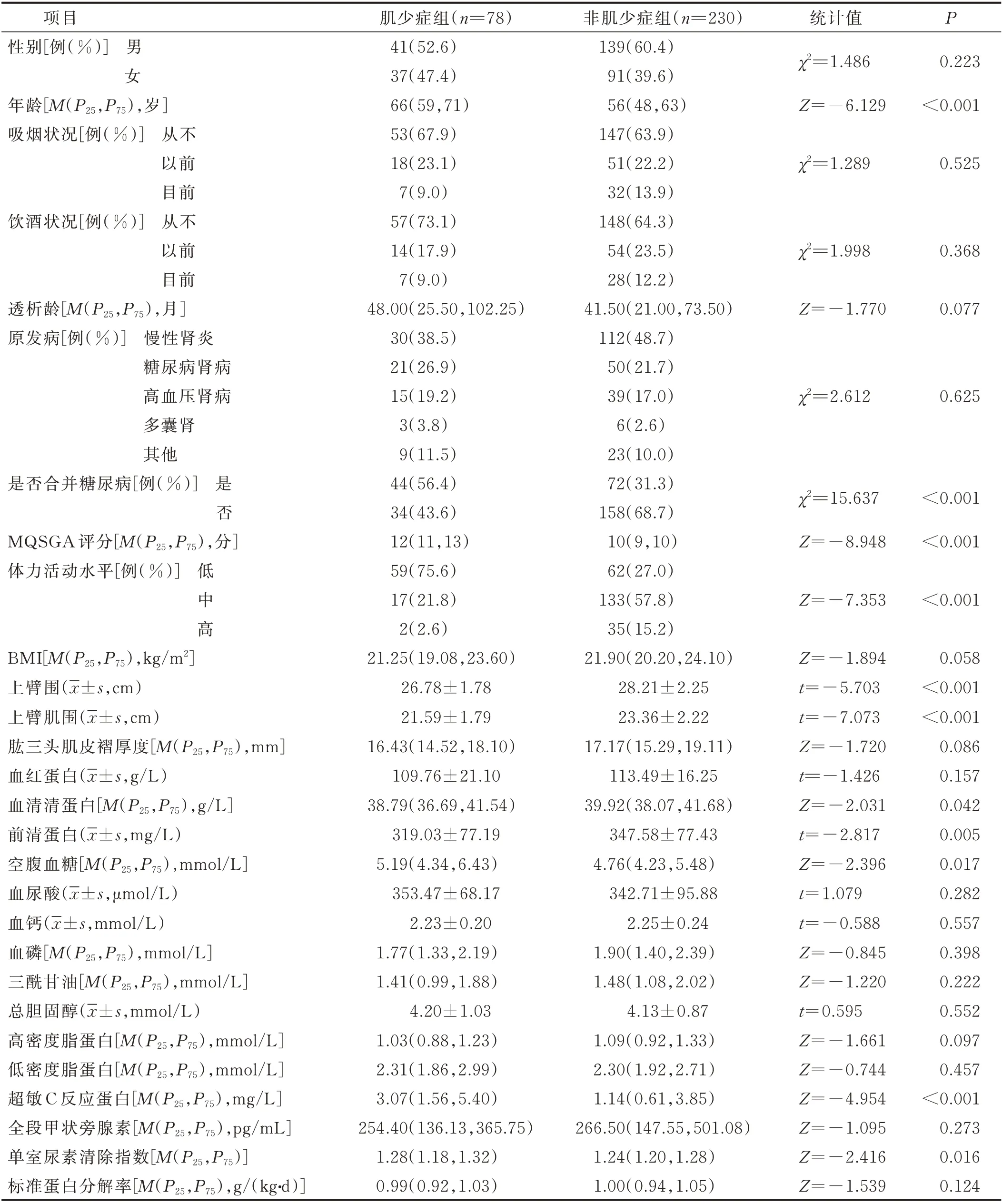
表1 肌少症组与非肌少症组病人临床资料比较
2.2 MHD 病人发生肌少症的影响因素分析 以是否发生肌少症作为因变量,以肌少症组与非肌少症组病人临床资料比较最终差异有统计学意义的变量为自变量及无统计学意义但既往研究常见的影响因素(性别、透析龄)作为自变量,进行多因素Logistic 回归分析。自变量赋值如下:性别(女=0,男=1);是否合并糖尿病(否=0,是=1);体力活动水平(低=1,中=2,高=3);连续变量均以原值录入。结果显示:性别、年龄、是否合并糖尿病、MQSGA 评分、体力活动水平、上臂肌围、超敏C 反应蛋白是MHD 病人发生肌少症的影响因素,见表2。

表2 MHD 病人发生肌少症的多因素Logistic 回归分析
3 讨论
3.1 肌少症在MHD 病人中的发生率较高 不同国家和地区肌少症发生率不尽相同。Lin 等[11]参照欧洲老年肌少症工作组(EWGSOP)诊断标准,调查结果显示MHD 病人的肌少症发生率为16.7%。杜雯等[12]参照同样标准,调查结果显示MHD 病人的肌少症发生率为31.2%,与Bataille 等[13]报道相似。蔡琪等[14]参照AWGS 诊断标准,调查结果显示MHD 病人的肌少症发生率为32.8%,高于董志娟等[15]报告结果(13.5%)。本研究采用AWGS 诊断标准,调查结果显示MHD 病人的肌少症发生率为25.3%。这可能与研究采用的诊断标准、测量工具及纳入人群年龄分布不同有关。虽发生率存在差异,但各项研究均表明,MHD 病人的肌少症发生率较高,不容忽视,提示临床医护人员应加强对肌少症的认识并提早对MHD 病人进行肌少症筛查及干预。
3.2 MHD 病人发生肌少症的影响因素
3.2.1 男性是MHD 病人发生肌少症的危险因素 表2 结果显示,男性MHD 病人较女性更易发生肌少症(OR=3.135),与已有研究结果[5,14]相似。男性MHD病人通常存在性腺功能减退,催乳素清除下降及促黄体生成素信号传导受阻,常导致病人体内睾酮浓度低下[16]。睾酮是类固醇激素,能够促进肌蛋白合成,增加骨骼肌含量和力量,而睾酮缺乏可使肌生成抑制素过度表达,导致肌肉蛋白负平衡[17]。同时,有研究证实,厌食症与肌少症的发生显著相关[18],男性MHD 病人往往更容易出现炎症诱导的厌食症[19],微炎症状态加之饮食摄入减少使病人肌蛋白分解加速,骨骼肌状态异常,引发肌少症。因此,医护人员应密切关注男性病人睾酮水平及膳食摄入情况,避免因进食减少导致肌少症发生。
3.2.2 高龄是MHD 病人发生肌少症的危险因素 表2 结果显示,年龄越大的病人发生肌少症的概率越大,与已有研究结果[4,20‐21]相似。随着年龄增加,病人肌蛋白分解合成代谢逐渐失衡,肌纤维逐渐从Ⅱ型向Ⅰ型转化,骨骼肌质量明显降低,加之运动神经元加速退化,肌肉协调性和强度减弱,可引起运动功能和平衡能力下降[22],最终导致肌少症发生。此外,年龄所诱导的线粒体功能障碍、激素变化等也参与了肌少症发生[23]。王亚美等[4]的研究显示,≥60 岁的MHD 病人发生肌少症的风险是<60 岁病人的4.04 倍。但部分研究[14,24‐25]未发现两者间存在关联性,可能是由于其纳入的研究对象年龄差异不显著。故临床医护人员应多关注老年病人肌肉状态,在治疗时加强病人躯体功能训练。
3.2.3 合并糖尿病是MHD 病人发生肌少症的危险因素 糖尿病是MHD 病人发生肌少症及死亡的重要预测因子[4,20‐21]。原因可能是糖尿病病人的胰岛素抵抗状态不仅能抑制肌蛋白合成,还会使胰岛素信号传递受阻,从而加速肌蛋白降解,肌肉量下降又会加重胰岛素抵抗,最终导致恶性循环,加快肌肉消耗[26]。此外,长期糖代谢紊乱会使糖基化终产物在骨骼肌中堆积,并促进氧化应激反应,致使骨骼肌中活性氧增加[27]。活性氧不仅可以诱导肌细胞损伤基因表达,还可以引起线粒体脱氧核糖核酸(DNA)的氧化损伤,致使肌蛋白分解合成代谢失衡并降低骨骼肌收缩力。表2 结果显示,合并糖尿病病人发生肌少症的风险是未合并糖尿病病人的2.792 倍。可见,积极控制糖尿病并加强血糖监测对预防MHD 病人肌少症的发生具有重要意义。
3.2.4 营养状况差是MHD 病人发生肌少症的危险因素 表2 结 果 显 示,MQSGA 评 分OR 为2.478,故MQSGA 评分每增加1 分,病人发生肌少症的风险便增加1.478 倍。另有研究显示,MQSGA 评分>10 分的MHD 病人发生肌少症的风险是MQSGA 评分≤10分的2.26 倍,提示营养状况越差的病人越容易发生肌少症[4]。由于机体代谢异常、饮食限制、食欲减退等因素,MHD 病人普遍存在营养不良,故科学的营养支持对预防或逆转MHD 病人肌少症发生具有重要作用。臧华龙等[28]研究发现,为期3 个月的口服营养补充剂治疗可有效提高MHD 病人肌肉质量及强度。另有学者提出,补充富含必需氨基酸的优质蛋白有助于维持肌肉质量,改善肌肉状态,且联合运动可提高氨基酸对肌蛋白合成的刺激作用[29]。未来需要更多大规模、前瞻性研究探索MHD 病人肌少症最佳营养干预方案。
3.2.5 高体力活动水平是MHD 病人发生肌少症的保护因素 表2 结果显示,MHD 病人体力活动增加可减少肌少症发生,与既往研究结果[15]相似。运动锻炼不仅可以降低炎症水平,促进肌纤维及蛋白合成,还可以通过激活蛋白激酶B/磷脂酰肌醇3‐激酶等信号通路抑制泛素‐蛋白酶途径的活化,从而减少骨骼肌蛋白水解,防治肌少症发生[30]。目前认为,抗阻运动较有氧运动更能促进肌肉生长并增强肌肉力量,是防治MHD病人肌少症发生的首选运动类型[31]。多项研究证实,每周3 次的透析中抗阻训练可有效提高MHD 病人肌肉力量及躯体功能,延缓肌少症发展[15,31‐32]。因此,针对低体力活动水平的病人,医护人员除应给予健康教育外,还应为其制定个性化的运动处方,以有效防治肌少症。但目前针对MHD 病人的最佳运动干预方案仍存在争议,有待进一步验证。
3.2.6 上臂肌围大是MHD 病人发生肌少症的保护因素 上臂肌围可较为准确地反映肌肉质量和营养状况,现已成为肌肉质量常用的替代评估指标[33]。国际肾脏营养与代谢协会把上臂肌围低于参考人群中位数的90%作为肌肉消耗的重要指标[34]。然而,目前尚缺乏上臂肌围与肌少症的关系研究。本研究结果显示,随着上臂肌围增大,MHD 病人肌少症发生风险降低。与王亚美等[4]研究结果相似,其影响机制有待进一步探索。本研究显示,BMI、三酰甘油、总胆固醇等传统营养评估指标对肌少症发生的影响不明显,可能是由于其容易受到脂肪分布异常影响,不能准确反映肌少症特点。
3.2.7 超敏C 反应蛋白水平高是MHD 病人发生肌少症的危险因素 慢性肾脏病初期超敏C 反应蛋白、白介素细胞‐6 等炎症细胞因子即开始增多,随着疾病进展其水平不断升高,故MHD 病人普遍长期处于微炎症状态[16]。已有研究证明,微炎症状态是MHD 病人发生肌少症的独立预测因子[11]。本研究发现,超敏C反应蛋白水平越高,MHD 病人发生肌少症的风险越高,与以往研究结果[14,25]一致。原因可能是炎症因子可激活核因子‐κB 和泛素‐蛋白酶体系统等途径,加速肌蛋白降解并抑制其合成,从而促进肌肉萎缩[12]。因此,医护人员应密切关注MHD 病人的炎症标志物水平,及时改善机体炎症状态。
4 小结
本研究表明,MHD 病人肌少症发生现状不容乐观,病人性别、年龄、是否合并糖尿病、MQSGA 评分、体力活动水平、上臂肌围、超敏C 反应蛋白是其发生肌少症的影响因素。临床医护人员应重视该人群肌少症的发生情况,针对影响因素进行早期评估及筛查,并及时制订安全、有效的个体化干预方案,降低MHD 病人肌少症发生率。

