皮下与关节腔注射A型肉毒毒素对骨关节炎大鼠镇痛效果比较
万慧伟,李鑫河,王琳,杨慧,李铁山
(青岛大学附属医院康复二科,山东 青岛 266003)
骨关节炎是一种常见的关节疾病,疼痛是其最突出的临床表现,也是导致求医的主要原因[1]。越来越多的研究发现,骨关节炎的疼痛存在神经病理性痛的成分[2-3]。因此,治疗上必须考虑对其神经病理性痛的成分进行治疗[4-5]。已经有临床研究发现,A型肉毒毒素(BoNT/A)注射可以显著减轻神经病理性疼痛症状[6-7]。而关于其镇痛机制,目前大多数研究者认为BoNT/A通过逆向轴浆运输在中枢神经系统发挥镇痛作用[8-9]。根据BoNT/A的逆向轴浆运输特性,本文研究探讨皮下注射BoNT/A对骨关节炎的治疗效果,并通过比较后爪皮下注射和关节腔注射BoNT/A的疗效差异,为临床治疗寻找最佳的治疗方法。
1 材料和方法
1.1 实验材料
SPF级成年雄性SD大鼠75只,体质量180~220 g,由青岛大学实验动物中心提供。大鼠于12 h光照/12 h黑暗、室温23 ℃条件下分笼饲养,不限制水和饲料的供应。所有动物实验操作都遵照青岛大学动物保护和使用委员会的要求,并最大程度减少实验动物的痛苦及其使用数量。A型肉毒毒素(BoNT/A,美国Allergan公司产品);单碘乙酸钠(MIA,美国Sigma公司);Von-Frey Hair(美国North Coast公司);通道式鼠足支撑力测量仪(济南益延科技有限公司);兔抗大鼠P2X4嘌呤受体(P2X4R)抗体(美国Bioss公司);凝胶成像分析系统(美国UVP公司)。
1.2 实验方法
1.2.1骨关节炎大鼠模型制备 将大鼠随机分为Sham组(12只)和造模组(63只),造模组大鼠应用50 g/L异氟烷麻醉后,消毒大鼠踝关节周围的皮肤,固定大鼠左侧下肢,使用50 μL微量注射器将4 mg(50 μL)的MIA沿胫骨-跗骨间隙注射到大鼠左侧踝关节腔中;Sham组大鼠给予相同体积的生理盐水关节腔注射。于造模后21 d对两组大鼠进行50%缩足反应阈值(PWT)及双下肢负重(WB)测试,造模组大鼠PWT及WB明显降低者提示造模成功,将造模成功的大鼠纳入后续实验。
1.2.2实验分组及处理 将造模成功的大鼠随机分为4组,每组15只。后爪皮下注射对照组(A组):于大鼠左侧后爪皮下注射20 μL生理盐水;后爪皮下注射给药组(B组):于大鼠左侧后爪皮下注射BoNT/A 5 U(20 μL);关节腔注射对照组(C组):于大鼠左侧踝关节腔注射20 μL生理盐水;关节腔注射给药组(D组):于大鼠左侧踝关节腔注射BoNT/A 5 U(20 μL)。
1.2.3疼痛行为学测试 分别于造模前3 d、造模后21 d随机抽取Sham组和造模组各6只大鼠进行PWT及WB测试;给药后1、7、14、21 d随机抽取A组、B组、C组、D组各6只大鼠进行PWT及WB测试。①PWT测定:将大鼠放入铁丝网为底的特制有机玻璃笼子中,等待20 min使大鼠适应周围环境,采用up and down法将一系列Von-Frey细丝从2.0 g力度开始刺激大鼠左侧后爪掌中部皮肤,轻微施力使软丝弯曲,保持4~6 s,观察大鼠的缩足反应,阳性反应表现为后足撤回。根据相关文献方法计算PWT[10]。②WB测定:将大鼠放入透明通道中,驱赶大鼠使其爬上称量架,当大鼠两侧后爪分别放置于两侧称量架上、并出现向斜面探究的动作或屈蹲在称量架上时(以相对稳定为准),测量大鼠左右下肢的支撑力,连续测量5次,记录数值并取平均值。结果以双足静态支撑的比值来表示[11]。
1.2.4P2X4R蛋白表达检测 Sham组和造模组于造模后21 d随机抽取3只大鼠,A组、B组、C组、D组分别于给药后7、14、21 d随机各取3只大鼠,麻醉后脱颈处死,迅速剪下腰段脊柱,取出L2~L6段脊髓。提取蛋白后,使用BCA试剂盒对蛋白浓度进行测定,配合5×上样缓冲液及PBS将所有样本稀释至同一浓度,加热变性后保存。将等量的各组蛋白样品进行电泳、转膜、封闭等操作后,将PVDF膜置于兔抗大鼠P2X4R抗体稀释液(1∶1 000)中,4 ℃过夜。漂洗后于FITC标记山羊抗兔IgG稀释液(1∶1 000, Abcam)中室温下低速摇床孵育120 min,将孵育完成的PVDF膜漂洗后放入显影仪中,加入ECL化学发光显影液进行显影,使用Image J软件对图像进行分析。
1.3 统计学处理
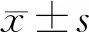
2 结 果
2.1 各组大鼠PWT比较
造模前3 d,造模组与Sham组大鼠PWT比较差异无统计学意义(P>0.05)。在造模后21 d,Sham组与造模组大鼠的PWT分别为(15.00±0.00)、(0.62±0.38)g,两组比较差异有统计学意义(t=92.31,P<0.05)。给药后大鼠的PWT随给药时间逐渐变化(F=23.98,P<0.05)。组内比较,后爪皮下注射给药组及关节腔注射给药组PWT各时间点变化明显(F=8.69、26.76,P<0.01),两组大鼠PWT在给药后持续上升,21 d时到达峰值,并有继续上升的趋势。各组大鼠PWT差异有统计学意义(F=6.40,P<0.05), 后爪皮下注射给药组的PWT较后爪皮下注射对照组明显改善,关节腔注射给药组大鼠的PWT较关节腔注射对照组明显改善,关节腔注射给药组与后爪皮下注射给药组PWT差异无显著性(P>0.05)。给药后不同时间比较,后爪皮下注射给药组PWT在给药后21 d较后爪皮下注射对照组改善明显,关节腔注射给药组PWT在给药后21 d较关节腔注射对照组改善明显,差异均有统计学意义(F=10.42、42.06,P<0.01);其他时间点各组比较差异无统计学意义(P>0.05)。给药时间及分组之间存在交互效应(F=4.04,P<0.01)。见表1。
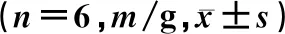
表1 给药后不同时间各组PWT比较
2.2 各组大鼠WB比较
在造模前3 d,Sham组与造模组大鼠的WB比较差异无统计学意义(P>0.05)。造模后21 d,Sham组与造模组大鼠的WB分别为1.00±0.16、0.46±0.15,两组比较差异有统计学意义(t=5.98,P<0.05)。给药后大鼠的WB随给药时间逐渐变化(F=25.05,P<0.05)。组内比较,后爪皮下注射给药组及关节腔注射给药组各时间点WB变化明显(F=25.05、12.27,P<0.01),两组的WB在给药后持续上升,21 d时到达峰值,并有继续上升趋势。各组间WB比较差异有统计学意义(F=22.96,P<0.05),后爪皮下注射给药组的WB较后爪皮下注射对照组明显改善,关节腔注射给药组大鼠的WB较关节腔注射对照组明显改善,关节腔注射给药组与后爪皮下注射给药组WB差异无显著性。给药后不同时间比较,后爪皮下注射给药组WB在给药后14、21 d较后爪皮下注射对照组改善明显,差异有统计学意义(F=9.23、38.96,P<0.01);关节腔注射给药组WB在给药后7、14、21 d较关节腔注射对照组改善明显,差异有统计学意义(F=8.04~38.96,P<0.01);其他时间点各组比较差异无统计学意义(P>0.05)。后爪皮下注射给药组与关节腔注射给药组给药后各时间点WB差异均无显著性(P>0.05)。给药时间及分组之间存在交互效应(F=8.01,P<0.01)。见表2。
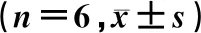
表2 给药后不同时间各组WB比较
2.3 各组大鼠脊髓P2X4R蛋白表达比较
造模后21 d,Sham组、造模组大鼠脊髓背角内P2X4R蛋白表达量分别为0.87±0.06、0.97±0.05,两组比较差异有统计学意义(t=6.08,P<0.05)。给药后7、14、21 d,后爪皮下给药组大鼠脊髓背角内P2X4R蛋白表达较后爪皮下注射对照组减少,关节腔注射给药组较关节腔注射对照组减少,差异有统计学意义(F=9.44~317.32,P<0.05)。见表3。
3 讨 论
骨关节炎是一种常见的关节疾病,疼痛为其主要的临床表现,严重影响病人的生活质量,并给社会带来沉重的经济负担。相关研究结果已表明,关节腔注射BoNT/A可以用于治疗骨关节炎疼痛[12]。由于BoNT/A可以通过逆向轴浆运输发挥镇痛作用,因此在运输路径上的不同部位注射BoNT/A有潜在的治疗作用。但目前缺乏关节外注射BoNT/A对骨关节炎镇痛作用的研究,以及不同部位注射效果的比较研究[13]。
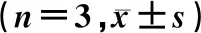
表3 给药后不同时间点各组大鼠P2X4R蛋白表达比较
本研究通过对大鼠疼痛相关行为学检测显示,在给药后14 d,后爪皮下给药能明显改善大鼠的WB,而对大鼠的PWT无明显改善;在给药后7 d,关节腔注射给药能明显改善大鼠WB,而对大鼠的PWT无明显改善;在给药后21 d,后爪皮下给药与关节腔注射给药均能明显改善大鼠的PWT。各时间点后爪皮下给药组大鼠PWT及WB与关节腔注射给药组无明显差异。表明后爪皮下及关节腔注射BoNT/A均具有镇痛作用,但关节腔注射给药组大鼠的WB较后爪皮下注射给药组更早得到改善,而在各时间点两种治疗方法的镇痛效果没有差别。
BoNT/A是由肉毒杆菌分泌的一种神经毒素,关于其镇痛机制,有研究认为BoNT/A可以抑制外周疼痛相关递质的释放,从而减轻疼痛症状[14-16],也有研究表明,BoNT/A可以通过逆向轴浆运输在中枢神经系统中发挥调节作用,减少疼痛信号的传递[17],这两种机制可能同时存在于BoNT/A的镇痛过程中。相关研究结果表明,大鼠后爪皮肤、膝关节腔以及踝关节腔的感觉神经均来源于L3、L4脊髓对应的背根神经节[9]。因此,在大鼠的后爪皮下注射BoNT/A,可以通过逆向轴浆运输作用,到达支配关节腔感觉的脊髓节段,从而发挥与关节腔注射BoNT/A类似的镇痛效果。本文研究结果显示,后爪皮下注射与关节腔注射均在给药后期(21 d)出现PWT的改善,这可能是由于PWT是对痛觉超敏进行评估的指标,而痛觉超敏的改善与BoNT/A的中枢调节作用有关,尽管后爪皮下注射与关节腔注射BoNT/A均可发挥中枢镇痛作用,但这个过程需要的时间较长。关节腔注射给药组大鼠较后爪皮下注射给药组更早出现WB的改善,究其原因:一方面可能是由于关节腔注射BoNT/A不仅可以发挥中枢镇痛作用,还可以抑制关节腔内疼痛相关递质的释放,导致关节腔注射给药能更早地发挥作用[18];另一方面,两种途径注射后组织对药物的吸收效率及运输距离不同导致其作用时间存在差异。但其具体作用机制仍需进一步探讨。
本研究结果显示,MIA注射后大鼠的PWT和WB明显下降,并且L2~L6脊髓中P2X4R的表达明显上升,这与前人的研究结果一致[19]。MIA是一种不可逆的还原型辅酶Ⅱ抑制剂,关节腔注射后可以抑制软骨细胞的代谢,导致关节软骨缺失,软骨下骨损伤,模拟骨关节炎的发病过程,产生疼痛症状[20-21]。P2X4R是一种与神经病理性疼痛相关的嘌呤受体,主要表达在小胶质细胞中,当神经系统遭受伤害性刺激时,小胶质细胞活化导致P2X4R的分子结构和功能发生改变,增强了感觉信息的传递,从而产生疼痛[22-23]。MIA骨关节炎模型大鼠具有明显的神经损伤,这是导致其L2~L6节段脊髓中P2X4R蛋白表达升高的主要原因。而在后爪皮下及关节腔注射BoNT/A后,大鼠脊髓小胶质细胞中P2X4R蛋白表达下降,提示BoNT/A可能通过抑制P2X4R的表达发挥镇痛作用。我们之前的研究也显示,BoNT/A轻链C末端和P2X4R具有很高的亲和力,提示BoNT/A与P2X4R可能存在结合位点,通过影响P2X4R-P38MAPK信号通路,发挥镇痛作用[24-25]。
综上所述,后爪皮下及关节腔注射BoNT/A均能缓解MIA诱导的骨关节炎大鼠的疼痛相关行为,关节腔注射给药可以更早发挥镇痛作用,但两组各时间点的镇痛效果相似;后爪皮下与关节腔注射给药均能对大鼠脊髓中的P2X4R蛋白表达进行调节,表明两种治疗方式均发挥了中枢神经系统调节作用。此外,两种治疗方式均未出现明显的不良反应。本文结果可为临床治疗骨关节炎疼痛提供参考。

