游离脂肪酸对动脉瘤性蛛网膜下隙出血病人预后影响
王永意,周勇,谢永帆,徐志明,李彤,王伟民
(青岛大学附属青岛市市立医院神经外科,山东 青岛 266011)
蛛网膜下隙出血(SAH)是神经外科一种常见的急性脑血管病,动脉瘤破裂是其最常见的病因[1]。虽然近年来随着神经血管成像、神经介入和神经重症监护技术的发展,SAH病死率有所下降,但其总体预后仍不理想,最终只有大约30%的病人能够恢复独立生活[2]。动脉瘤性蛛网膜下隙出血(aSAH)预后与发病后病人的意识水平、高血压病史、出血量、动脉瘤因素及迟发型神经功能恶化等相关[3]。临床上常根据入院时的世界神经外科医师联盟(WFNS)评分、改良Fisher分级或者Hunt-Hess分级等评判病人出血的严重程度、预测神经功能恶化可能和估计病人预后,但此类评分或分级方式较为主观,临床上缺乏客观评价aSAH预后的实验室指标。研究发现,血清游离脂肪酸(FFA)水平在创伤性脑损伤[4]、缺血性脑卒中[5]及功能性神经系统疾病[6]等疾病中有显著改变。FFA及其代谢产物在介导炎症反应、氧化应激及脂质过氧化[7]过程中发挥重要作用。SAH可引起中枢神经系统急性炎症反应,并可持续数周[8],氧化应激和脂质过氧化在SAH发生后早期脑损伤及血管痉挛中发挥重要作用[9],这些因素显著增加继发性并发症发生的可能,对临床预后有重要影响。本研究通过分析不同临床预后aSAH病人血清FFA水平的差异,探讨FFA对aSAH病人预后的影响,以期为aSAH的临床诊疗提供一定的参考依据。
1 资料与方法
1.1 研究对象
对我院2015年9月—2019年12月收治的107例aSAH病人的临床资料进行回顾性分析。病人纳入标准:①符合SAH诊断标准[10];②CT血管造影(CTA)/核磁血管造影(MRA)/数字减影血管造影(DSA)证实为动脉瘤破裂出血,并行介入治疗;③发病至入院时间≤24 h;④年龄>18岁;⑤临床资料齐全;⑥获得病人或亲属的知情同意。排除标准:①其他疾病引起的SAH,如外伤、动静脉畸形等;②既往有颅脑肿瘤、脑卒中、颅内感染等病史者;③合并严重的其他系统疾病如心肺功能不全、肝肾功能不全者;④妊娠期或哺乳期女性;⑤拒绝参与试验及随访者。本研究获得医院道德伦理委员会的批准。
1.2 数据收集
记录病人的临床资料,包括年龄、性别、既往史(吸烟、高血压、糖尿病)、动脉瘤特征(位置、直径)、入院时的Hunt-Hess分级、基于病人发病后初次颅脑CT结果的改良Fisher分级以及病人入院后24 h的实验室检测指标。实验室检测指标包括总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、非高密度脂蛋白胆固醇(Non-HDL-C,由TC减去HDL-C获得)、低密度脂蛋白胆固醇(LDL-C)以及FFA等。
1.3 神经功能预后评估
主要终点为病人的短期神经功能预后,由经过培训的专科医生评估预后情况。根据病人出院时的改良Rankin量表(mRS)评分,将出院病人分为预后良好组(0~2分)和预后不良组(3~6分)。
1.4 统计学处理
2 结 果
2.1 aSAH病人预后影响因素的单因素分析
对纳入研究的107例病人进行术后随访评价,其中57例病人(53.3%)预后良好,另50例病人(46.7%)预后不良。单因素分析结果显示,预后良好组与预后不良组相比较,年龄(t=-3.053,P=0.003)、高血压(χ2=8.141,P=0.004)、Hunt-Hess分级(χ2=20.420,P<0.001)、改良Fisher分级(χ2=17.060,P<0.001)、责任动脉瘤位置(χ2=5.420,P=0.020)以及血清FFA水平(Z=-3.357,P=0.001)等差异均有统计学意义。见表1。
2.2 aSAH病人预后影响因素的多因素分析
选择单因素分析中差异具有统计学意义的临床指标(年龄、高血压、Hunt-Hess分级、改良Fisher分级、责任动脉瘤位置及FFA等)用后退法进行二元Logistic回归分析。结果显示,年龄、Hunt-Hess分级、改良Fisher分级、动脉瘤位置、血清FFA水平是影响aSAH病人预后的独立危险因素,高龄、入院时Hunt-Hess分级3~5级、改良Fisher分级3~4级、后循环动脉瘤和血清FFA浓度高的病人提示预后不良的风险增高。见表2。
3 讨 论
FFA是指非酯化的脂肪酸或者未酯化的脂肪酸,主要通过TG的脂解过程从脂肪组织中释放出来[11]。在正常人血浆中FFA浓度极低。当血浆中出现高浓度的FFA,机体将会产生一系列复杂的病理生理改变。
脂肪酸是活性氧(ROS)的重要来源,研究表明FFA可通过蛋白激酶C(PKC)途径激活NADPH氧化酶产生ROS,导致氧化应激过程[12]。同时,FFA通过改变内质网的形态和流动性,介导内质网应激事件发生,这对炎症反应有重要影响[13]。PKC在FFA诱导的炎症中也发挥作用,FFA与Toll样受体(TLRs)结合,可激活PKC介导的丝裂原活化蛋白激酶(MAPK)级联反应,促进核因子κB(NF-κB)的产生,激活肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)等炎症因子,导致血管内皮过氧化物产生增加和NO产生减少,从而增加血管内皮通透性[14-15]。在微血管内皮细胞中,FFA可以激活NLRP3炎症小体,从而减少内皮紧密连接蛋白ZO-1和ZO-2的表达,导致血管内皮细胞损伤[16]。动物实验和体外细胞实验证实,在自然界中,FFA主要通过被动的饱和扩散过程穿过血-脑脊液屏障,大脑脂肪酸主要来源于血浆中的非酯化形式的脂肪酸[17-18]。因此,血清FFA水平可在一定程度上反映中枢神经系统FFA水平。一项监测SAH病人发病14 d内血清FFA水平的研究证实,FFA升高的程度与SAH初始出血的严重程度相关[19]。随着研究的不断深入,发现神经炎症反应可导致SAH发生后的继发性脑损伤,如脑血管痉挛和迟发性脑缺血[20-21]。本文研究结果进一步证实,入院时血清FFA水平较高的aSAH病人预后较差,多因素二元Logistic回归分析显示,FFA是影响aSAH病人预后的独立危险因素。结合FFA在体内的病理生理功能,FFA水平升高可在一定程度上代表体内的炎症反应程度、脂质过氧化以及氧化应激水平升高,这些因素均可以加重SAH发生后的脑损伤,导致病人的不良预后。故血清FFA水平对aSAH病人的治疗方式选择以及预后评估有一定的参考意义。
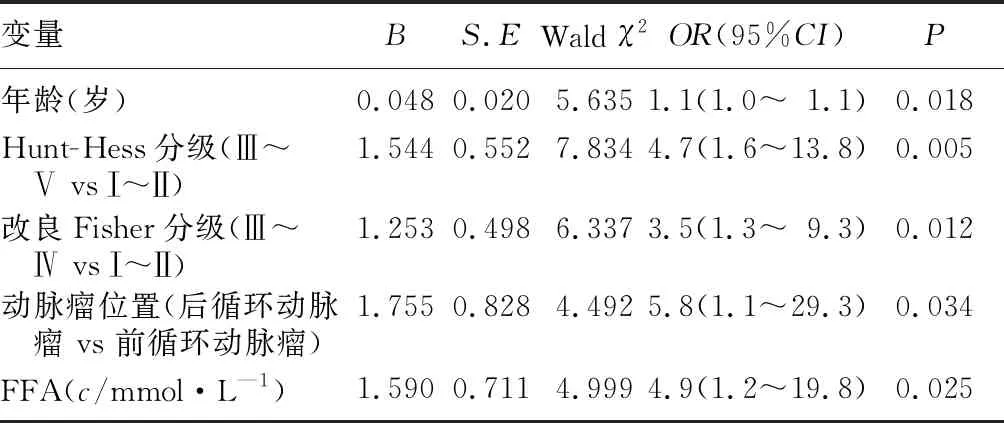
表2 aSAH病人预后影响因素的多因素Logistic回归分析
综上所述,发病后24 h血清FFA水平显著影响aSAH病人出院时的神经功能预后,是其预后的独立危险因素。国内对于FFA与SAH病人预后之间关系的研究较少,本研究结果表明,FFA作为新型生化标志物与aSAH病人的短期预后相关,这对于临床上预测病人短期预后具有一定的参考意义。然而,本研究作为一个单中心回顾性研究,未进一步分析FFA的动态变化过程,且样本量有限,其结论仍待今后大规模多中心的研究证实。

