微创颅内血肿穿刺引流术后残余血肿量对脑出血患者预后的影响
罗胜,王丽琨,任思颖,叶飞,黎辰,伍国锋
脑出血每年新发200余万例,造成我国每10万人中1489.11的伤残调整生命年(disability adjusted life year,DALY)[1]。有效清除颅内血肿能改善脑出血患者预后[2-5],但患者从传统开颅手术中的有效获益有限[6,7]。微创颅内血肿穿刺引流术(minimally invasive surgery,MIS)因创伤小、手术时间短、患者预后好等优势[8],在临床的运用逐渐增多。MIS联合阿替普酶血肿腔内注入治疗脑出血的随机对照多中心前瞻性研究(Minimally Invasive Surgery Plus Recombinant Tissue Plasminogen Activator for Intracerebral Hemorrhage Evacuation,MISTIE)显示,当患者治疗结束时(end of treatment,EOT),颅内血肿残留量<15 mL可以改善患者预后,且患者EOT颅内血肿残留量越低患者预后越好[9-14]。由于MISTIE试验中仅约60%患者达到预定的EOT血肿残留量<15 mL的临床目标,<15 mL这一截断值可能并不准确。本研究通过回顾性研究,探究EOT颅内血肿残留量与预后之间的关系。
1 资料与方法
1.1 一般资料
收集2015年8月1日至2019年7月31日贵州医科大学附属医院急诊神经科收治的接受MIS治疗的脑出血患者。
本研究得到我院临床试验伦理委员会的审查批准,批准号:2018伦审第114号。纳入标准:符合根据《中国脑出血诊治指南》(2019)中脑出血的诊断标准,且经头颅CT证实;接受MIS治疗;取得患者和(或)家属的书面知情同意;资料完整。排除标准:脑淀粉样血管变性所致脑出血;脑外伤、海绵状血管瘤、颅内动静脉畸形、烟雾病、颅内肿瘤、动脉瘤等原因造成的继发性脑出血;原发性脑室系统出血;年龄不满18周岁。
1.2 方法
1.2.1 分组及数据收集 本研究中,“血肿不规则”定义为在血肿周围≥2个的突出或血肿内部≥3个的低密度区域[15];“预后好”定义为改良Rankin量表(modified rankin score,mRS)评分0~3分[16];“再出血”定义为头颅CT显示的血肿量较上次CT绝对增加≥6 mL和(或)相对增加≥30%[17,18]。血肿体积测量使用多田公式,血肿体积/mL=血肿最大层面长径(cm)×血肿最大层面宽径(cm)×血肿所占层面厚度(血肿层面数×0.3 cm/层)/2[19]。
首先使用ROC曲线分析,计算出院预后好的患者EOT颅内血肿残留量的截断值,并据此分组。收集入组患者的人口学资料及临床资料,包括性别、年龄、发病至入院时间、发病至手术时间、既往史、个人史、用药史、入院血压、入院及出院格拉斯哥昏迷量表(glasgow coma score,GCS)评分、美国国立卫生院脑卒中量表(national institute of health stroke score,NIHSS)评分、mRS评分、头颅CT影像、手术相关资料等。
1.2.2 MIS手术过程及术后管理 以患者幕上脑出血血肿体积≥30 mL,丘脑出血>8 mL,基底节出血>18 mL,小脑出血血肿直径≥3 cm或脑出血并发脑疝、梗阻性脑积水等危及生命的并发症为手术适应证[20,21]。所有符合手术指征的患者均向其和(或)家属告知手术流程、风险、预后等相关事项并取得书面同意。
在局部浸润麻醉下予以患者安装立体定向定位头架,行头颅定位CT扫描,选取血肿最大层面建立坐标系。于坐标系内设置穿刺靶点及ICP传感器置入靶点。计算各靶点坐标值(X、Y、Z),取合适长度的穿刺针在立体定向仪引导下穿破颅骨及脑膜,进针适当深度至靶点中心。以上同法置入ICP传感器。抽出针芯并接10 mL注射器抽吸血肿,记录血肿抽吸量。抽吸完成后接引流袋,重力引流血肿。患者术后继续于病房接受血肿引流及血肿腔内尿激酶(5万单位/引流管)注入,每8小时1次。尿激酶注入并夹闭引流管2 h后开放引流管,继续行重力引流,某些情况下需振荡引流管以利血肿流出。所有患者均给予包括控制血压、镇静等在内的标准内科治疗[19]及标准的针灸康复治疗。
1.3 统计学处理
采用SPSS 24.0软件进行统计学分析。符合正态分布的计量资料以(±s)表示,不符合正态分布的计量资料及等级资料以中位数(Q25,Q75)表示,组间比较采用独立样本均数t检验或Mann-Whitney U检验;计数资料以率表示,组间比较采用χ2检验。对患者出院预后进行二元Logistics回归及COX生存回归分析。对EOT时颅内血肿残留量与患者出院预后行点二列相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 资料收集及分组结果
本研究共收集符合纳入和排除标准的经MIS治疗的脑出血患者408例,其中临床资料缺失29例,影像资料缺失120例,手术资料缺失3例,排除后共有256例患者纳入研究。
所有患者平均年龄(57.29±12.60)岁;男性患者占72.7%;48%有吸烟史,71.9%有高血压史,5.2%有糖尿病史,42.6%有饮酒史,2.3%有抗凝史,34.6%的患者血肿破入脑室系统,41.0%的患者血肿不规则。患者发病至入院的中位时间为5 h,发病到手术的中位时间为16 h。入院中位血肿量为38.01 mL。
首先使用ROC曲线分析,计算出院预后好的患者EOT颅内血肿残留量的截断值为11.288 mL。此时其预测患者出院预后良好的敏感性为45.5%,特异性为83.2%,曲线下面积(area under curve,AUC)为67.0%(95%CI59.6%-74.4%),约登指数为0.287,见图1。
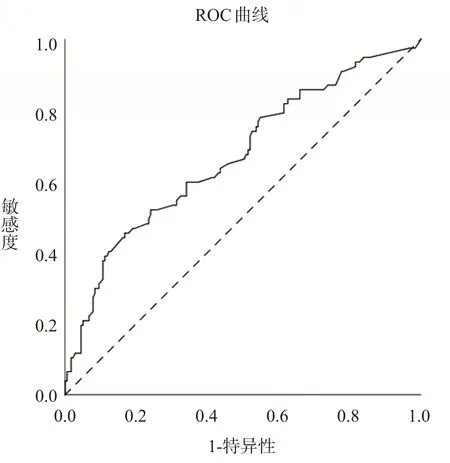
图1 患者EOT时颅内血肿残留量与患者出院预后良好间的ROC曲线
据此将患者分为EOT低残留组(EOT颅内血肿残留量<11.288 mL)191例,EOT高残留组(EOT颅内血肿残留量≥11.288 mL)55例。
2.2 2组基线资料比较
高残留组有饮酒史患者的比例,术中、术后发生再出血的比例,患者入院时血肿量及EOT时血肿残留量高于低残留组(均P<0.05),其余指标差异无统计学意义,见表1。
表1 2组患者基线资料比较[例(%)或(±s)或中位数(Q25,Q75)]

表1 2组患者基线资料比较[例(%)或(±s)或中位数(Q25,Q75)]
组别低残留组高残留组t/χ2/F/Z P值例数191 65男性135(70.7)51(78.5)1.478 0.224吸烟史86(45.0)37(56.9)2.75 0.097高血压史133(69.6)51(78.5)1.870 0.172糖尿病史10(5.2)3(4.6)0.039 1.000饮酒史72(37.7)37(56.9)7.333 0.007抗凝史5(2.6)1(1.5)0.247 0.619破入脑室64(33.5)25(38.5)0.525 0.469术前再次出血10(5.2)4(6.2)0.079 1.000组别低残留组高残留组t/χ2/F/Z P值术中再出血16(8.4)18(27.7)15.709<0.05术后再出血17(8.9)20(30.8)18.758<0.05血肿不规则75(39.3)30(46.2)0.951 0.33年龄/岁57.4±12.6 56.9±12.7 0.285 0.777发病到入院时间/h 5.0(3.0-10.0)5.0(3.0-10.5)-0.746 0.456发病到手术时间/h 15.0(9.0-27.0)19.0(9.3-34.1)-0.955 0.339入院收缩压/(mmHg)171.7±26.9 175.5±34.3-0.808 0.364入院舒张压/(mmHg)100.0(90.0-110.0)100.0(86.0-110.5)-0.226 0.821组别低残留组高残留组t/χ2/F/Z P值入院脉搏压/(mmHg)68.0(54.0-86.0)71.0(58.5-87.5)-0.769 0.442入院mRS/分5(4-5)5(4-5)-0.291 0.771入院GCS/分10(8-13)10(7-13)-0.249 0.803入院NIHSS/分16(14-20)17(14-21.5)-0.96 0.337入院血肿量/mL 36.0(31.0-48.6)47.3(34.1-59.9)-3.634<0.05术中血肿清除率/%40.7±23.1 39.5±20.1 0.368 0.714拔出引流管时间/d 4(3-6)5(3-6)-0.526 0.599 EOT残留值/mL 3.0(1.2-6.1)18.9(13.8-25.0)-12.045<0.05
2.3 出院转归比较
EOT低残留组较EOT高残留组的预后更好、3个月死亡率更低、mRS评分更低,差异有统计学意义(均P<0.05),见表2。
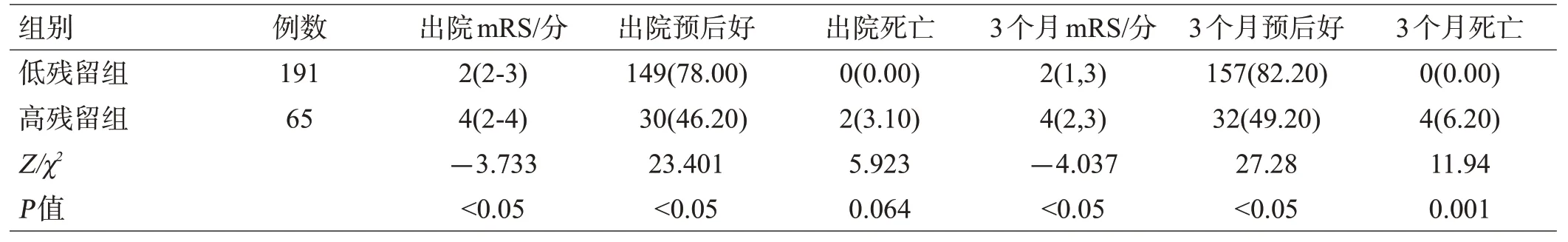
表2 2组患者预后比较[例(%)或中位数(Q25,Q75)]
2.4 2组出院预后的生存分析结果
经COX回归,EOT颅内血肿残留值<11.288 mL为患者预后良好的独立预测因子(wald=14.051,P<0.01)。与EOT颅内血肿残留量≥11.288 mL相比,EOT血肿残留量<11.288 mL的患者预后差的风险更低(HR=2.374,95%CI1.511-3.732),见图2。
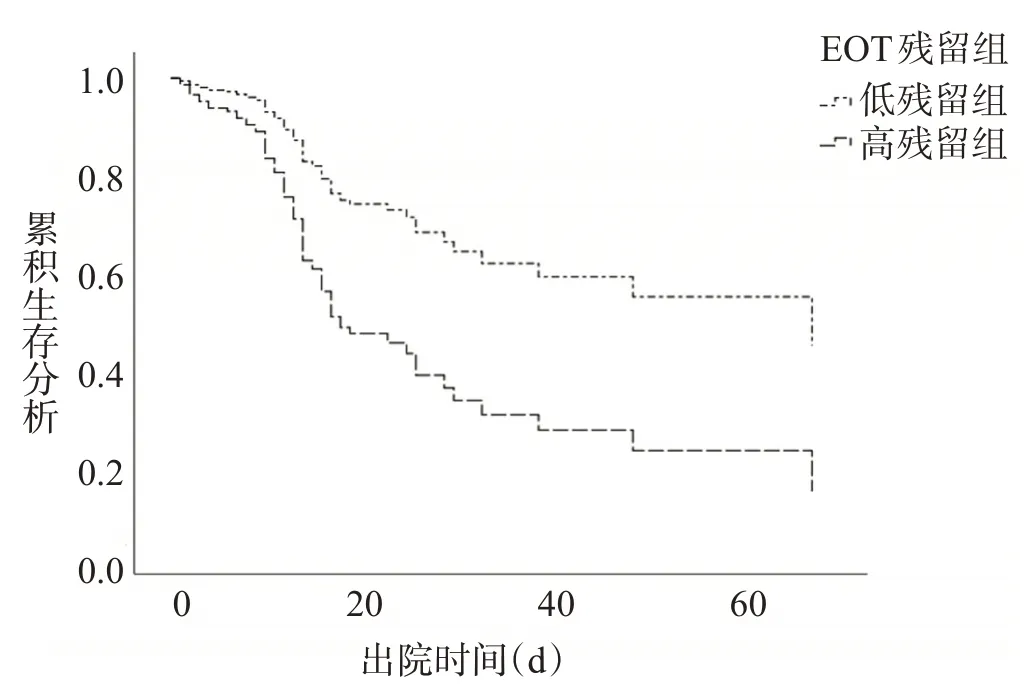
图2 EOT时低残留组与高残留组患者出院预后的COX回归结果
2.5 2组3个月预后的二元Logistic回归分析结果
EOT时血肿残留量与患者3个月时的预后相关,见表3。
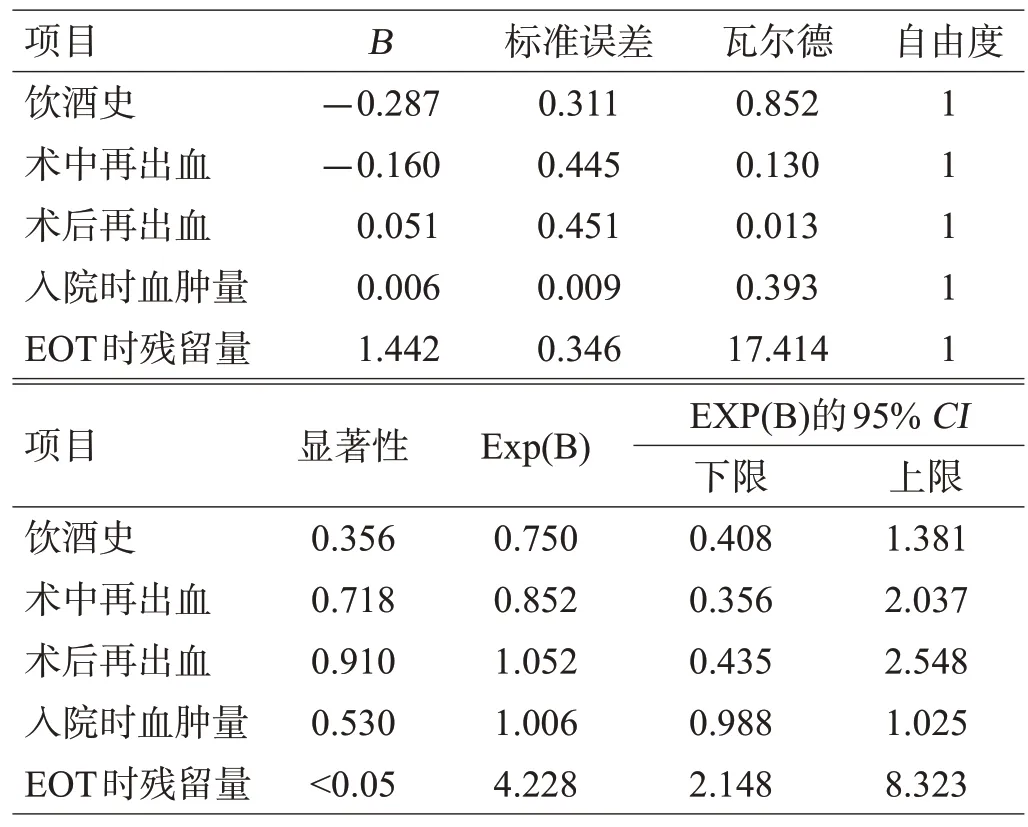
表3 2组患者3个月预后的二元Logistic回归结果
3 讨论
本组患者中,EOT低残留组出院预后好的比例为78%,3个月预后好的比例为82.2%,而EOT高残留组的比例分别为46.2%和49.2%,提示EOT残留量<11.288 mL是患者预后良好的独立预测因子,这与MISTIE试验结果相符[9]。
本研究结果提示,将EOT血肿残留量降至11.288 mL以下再拔除引流管可能是改善患者预后的一个有效途径。可能的方法有延长引流管的留置时间及加大尿激酶血肿腔内注入的剂量,包括增大单次剂量和(或)增加血肿腔内注入频率(次数)等多种选项。MISTIE研究表明,每次1.0 mg与0.3 mg剂量的阿替普酶血肿腔内注入的主要安全风险与疗效均无明显统计学差异[13]。来自本中心的经验表明,增加尿激酶血肿腔内注入频率和(或)总次数似乎可以加快颅内血肿的清除,但潜在的细菌感染风险尚不明确。因此,这些潜在方案可能需要进一步的临床研究证实其安全性及有效性。
MISTIE试验尚有一些不足:首先是MISTIE程序规定的拔出引流管的时机(第9剂阿替普酶注入后或发生症状性再出血或血肿引流至残留15 mL以下或血肿残留30%以下)似乎并不合适:第9剂阿替普酶注入后患者可能仍未达到MISTIE所规定的颅内血肿残留<15 mL的目标(实际上也仅有不足60%的患者达到EOT<15 mL的目标);其次是当患者出现症状性再出血时即拔除了引流管,使患者丧失了继续接受血肿引流的机会,无法探究继续引流是否仍有机会改善预后。
本研究进行了如下优化:①患者拔除引流管的时机为手术医师认为达到治疗要求,此时虽有产生信息偏倚的可能,但因本研究样本量较大可以将其控制在较小范围内;②无论患者是否出现术后再出血,均继续接受引流,能有效探究MIS联合尿激酶血肿腔内注入是否能够改善术后再出血患者的预后。
本研究尚有如下不足:首先本研究为单中心、非随机对照回顾性研究,可能存在信息偏倚。同时,患者的并发症发生率如颅内感染、继发性癫痫等亦未被研究。综上所述,脑出血患者行MIS联合尿激酶血肿腔内注入EOT颅内残留量<11.288 mL可能可作为患者出院及3个月预后良好的独立预测因子。
