高血压脑出血患者血肿周围脑组织miR-146a表达与自噬及短期预后的关系
陆飞宇,王文宏,李剑侠,黄先锋,林小祥
高血压脑出血是原发性高血压最危重的并发症之一,致死、致残率高。脑出血后,血肿的占位和压迫直接造成脑组织的机械性损伤,而血肿周围脑组织中炎症、细胞凋亡、自噬等过度激活等能够引起脑组织二次损伤[1-3],但其具体机制仍不十分清楚。目前,临床上常用的血肿清除术、血肿抽吸术等治疗手段能够及时清除血肿,减轻脑组织受到的机械性损伤,但炎症、凋亡、自噬等造成的二次损伤并不能完全消除。
微小RNA(microRNA,miR)是长约22 nt的非编码RNA,能够在转录后水平抑制基因表达并参与炎症、凋亡、自噬等过程的调控。miR-146a是一种具有保护作用的miR,其在脑出血大鼠模型的表达明显下调,过表达miR-146a对脑出血大鼠脑组织的自噬具有显著抑制作用[4]。临床研究表明,心肌梗死患者及脑梗死患者miR-146a的表达均明显降低[5,6]。但高血压脑出血发病过程中miR-146a表达的变化及意义尚缺乏临床证据。本研究将以高血压脑出血患者为对象,观察血肿周围脑组织miR-146a表达与自噬及短期预后的关系,为阐明高血压脑出血二次损伤的机制、发现高血压脑出血新的防治靶点提供依据。
1 资料与方法
1.1 一般资料
选择2017年1月至2019年12月在我院接受血肿清除术的高血压脑出血患者204例纳入脑出血组。另取尸检的非脑出血病例18例纳入对照组,留取正常脑组织。本研究已取得医院伦理委员会批准。
脑出血组纳入标准:①参照《自发性脑出血诊断治疗中国多学科专家共识》[7]及《中国脑出血诊治指南(2014)》[8],符合高血压脑出血的诊断标准;②接受血肿清除术;③发病时间≤24 h;④临床及短期随访资料完整;⑤留取血肿周围脑组织。
脑出血组排除标准:①既往有脑梗死、脑出血等病史;②外伤、肿瘤等其他原因引起的脑出血;③合并精神性疾病、恶性肿瘤、自身免疫性疾病等。
1.2 方法
1.2.1 miR-146a表达的检测 取脑出血组的血肿周围脑组织及对照组的正常脑组织适量,根据试剂盒操作说明,依次提取脑组织中的总miR、将总miR反转录为对应的cDNA、荧光定量PCR检测检测miR-146a水平。程序如下:95℃预变性3 min,而后95℃5 s、60℃15 s重复40个循环,得到循环曲线后,以U6为内参计算miR-146a的表达量。上述试剂盒均购于天根生化科技(北京)有限公司。
1.2.2 自噬基因表达的检测 取脑出血组的血肿周围脑组织及对照组的正常脑组织适量,提取并测定蛋白水平,将含有30μg蛋白的样本用于western blot检测。电泳、电转PVDF膜后5%脱脂牛奶室温封闭1 h;1∶1000稀释的Beclin-1、组织蛋白酶D(Cathepsin D)、微管相关蛋白1轻链3(microtubule-assaiated protein 1 light chain 3,LC3)一抗或1∶2500稀释的β-actin一抗4℃孵育PVDF膜过夜;1∶2000稀释的二抗室温孵育PVDF膜1 h;凝胶成像系统曝光得到蛋白条带,以β-actin为内参、计算目的基因的表达水平。上述试剂盒均购于上海碧云天生物技术有限公司。
1.2.3 临床数据收集 收集脑出血患者的临床资料:性别、年龄、吸烟史、冠心病史、糖尿病史、入院时美国国立卫生院脑卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分、血红蛋白(hemoglobin,Hb)、白细胞(white blood cell,WBC)计数、血小板(platelet,PLT)计数、入院即刻血糖(admission blood glucose,ABG)、血肿体积、血肿破入脑室比例。Hb、WBC、PLT采用全自动血常规仪检测,ABG采用全自动生化分析仪检测,血肿体积及是否破入脑室根据头颅CT扫描结果进行评估。
1.2.4 脑出血预后的随访 出院后3个月时进行门诊复查,采用改良Rankin量表(modified Rankin Scale,mRS)评分评价预后;mRS>2分为预后不良,mRS≤2分为预后良好。
1.3 统计学处理
采用SPSS 21.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验;计数资料以率表示,组间比较采用χ2检验;相关性分析采用Pearson检验;miR-146a预测预后的价值采用ROC曲线分析,预后的影响因素采用Logistic回归分析;P<0.05为差异有统计学意义。
2 结果
2.1 2组脑组织中miR-146a及自噬基因表达水平的比较
脑出血组血肿周围脑组织中miR-146a的表达水平明显低于对照组,自噬基因Beclin-1、Cathepsin D、LC3-II/LC-I的表达水平明显高于对照组,差异有统计学意义(P<0.05),见图1,表1。
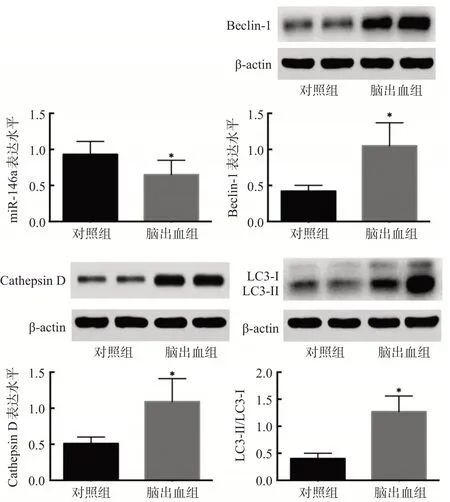
图1 2组脑组织中miR-146a及自噬基因表达水平的比较
表1 2组脑组织miR-146a及自噬基因水平比较(±s)
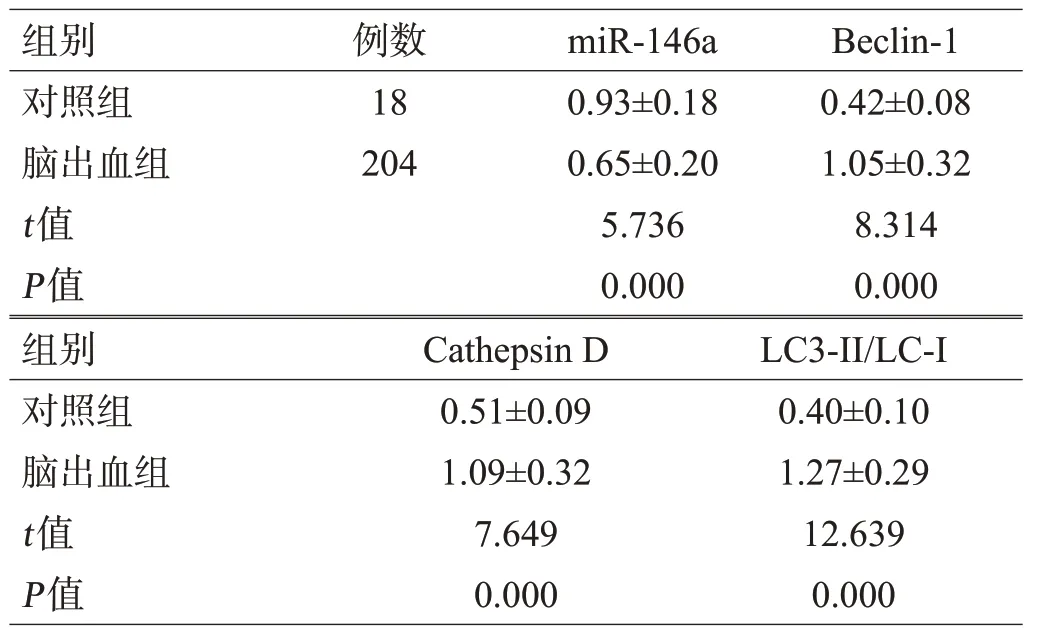
表1 2组脑组织miR-146a及自噬基因水平比较(±s)
组别对照组脑出血组t值P值例数18 204 miR-146a 0.93±0.18 0.65±0.20 5.736 0.000 Beclin-1 0.42±0.08 1.05±0.32 8.314 0.000组别对照组脑出血组t值P值Cathepsin D 0.51±0.09 1.09±0.32 7.649 0.000 LC3-II/LC-I 0.40±0.10 1.27±0.29 12.639 0.000
2.2 脑出血组脑组织中miR-146a及自噬基因表达水平的相关性
脑出血组血肿周围脑组织中miR-146a的表达水平与自噬基因Beclin-1、Cathepsin D、LC3-II/LC-I的表达水平有负相关关系,见图2,表2。
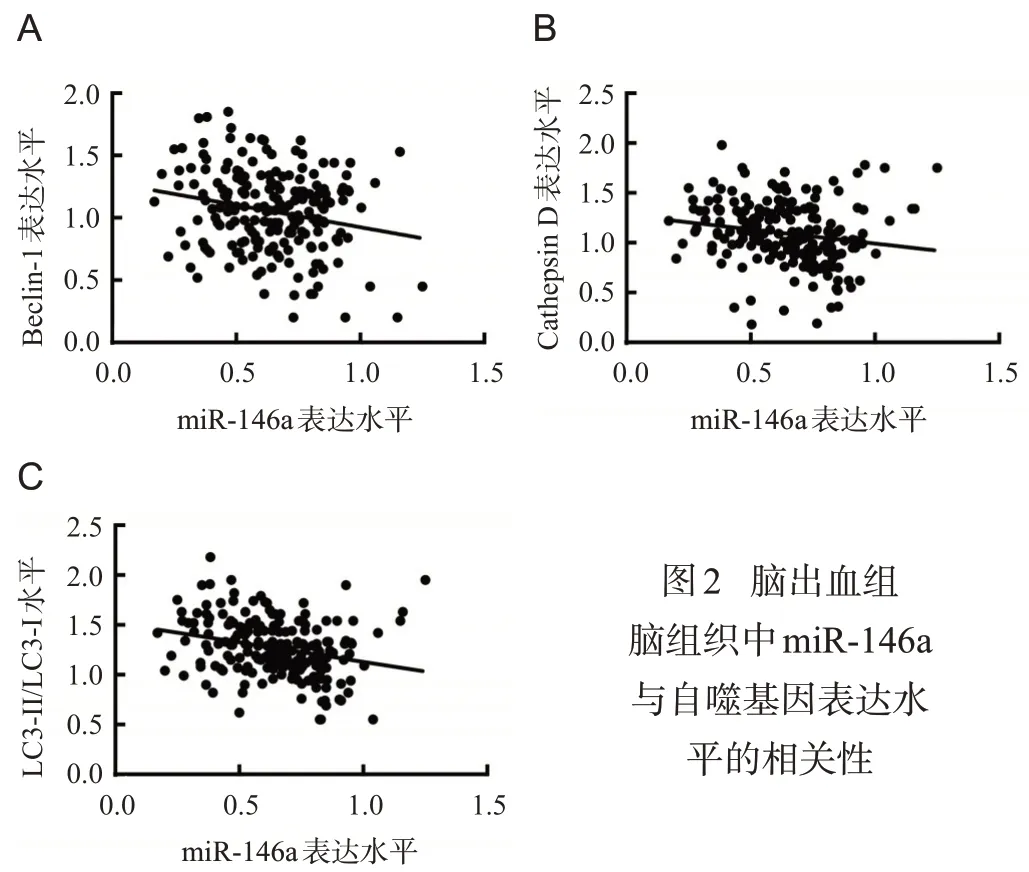
图2 脑出血组脑组织中m i R-1 4 6 a与自噬基因表达水平的相关性
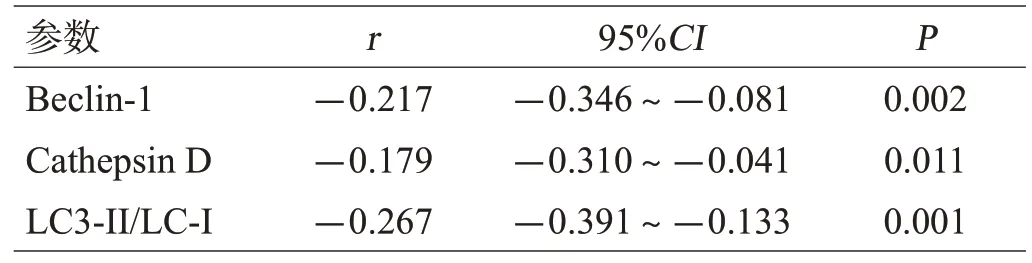
表2 miR-146a与自噬基因相关性的Pearson检验
2.3 脑出血组中不同预后患者临床特征及miR-146a、自噬基因表达的比较
根据随访mRS评分,脑出血组患者分为预后良好组117例,预后不良组187例。2组的性别、年龄、吸烟史、冠心病史、糖尿病史、Hb和PLT的差异无统计学意义(P>0.05);入院时NIHSS评分、WBC、ABG、血肿体积、破入脑室比例及miR-146a、Beclin-1、Cathepsin D、LC3-II/LC-I表达水平的差异有统计学意义(P<0.05),见表3,表4。
表3 脑出血组中不同预后患者临床特征比较[(±s)或例(%)]

表3 脑出血组中不同预后患者临床特征比较[(±s)或例(%)]
组别预后良好组预后不良组t值P值例数117 187男性58(49.57)42(48.27)0.034 0.855年龄/岁64.57±12.84 66.71±15.08 1.092 0.276吸烟史41(35.04)33(37.93)0.180 0.671冠心病史13(11.11)12(13.79)0.334 0.563糖尿病史30(25.64)23(26.44)0.721 0.396 NIHSS评分/分6.75±1.32 9.84±1.47 15.750 0.000组别预后良好组预后不良组t值P值Hb/(g/L)121.01±26.68 117.68±30.25 0.833 0.406 WBC/(×109/L)7.68±1.57 9.02±1.77 5.708 0.000 PLT/(×109/L)223.18±46.58 219.27±53.75 0.555 0.579 ABG/(mmol/L)6.03±1.12 7.69±1.45 9.226 0.000血肿体积/mL 11.37±2.38 17.05±3.14 14.700 0.000破入脑室10(8.55)16(18.39)4.348 0.037
表4 脑出血组中不同预后患者miR-146a及自噬基因表达水平比较(±s)
表4 脑出血组中不同预后患者miR-146a及自噬基因表达水平比较(±s)
组别预后良好组预后不良组t值P值例数117 187 miR-146a 0.73±0.18 0.54±0.17 7.634 0.000 Beclin-1 0.83±0.29 1.35±0.38 11.087 0.000 Cathepsin D 0.87±0.27 1.39±0.41 10.906 0.000 LC3-II/LC-I 1.02±0.22 1.61±0.37 14.206 0.000
2.4 miR-146a水平预测脑出血组患者预后的ROC曲线分析
miR-146a水平预测脑出血患者预后的ROC曲线下面积为0.7656(95%CI0.6992-0.8320,P<0.01),根据约登指数最大值确定最佳截断值为0.618,该截断值预测预后的灵敏度为66.67%,特异性为76.11%,见图3。
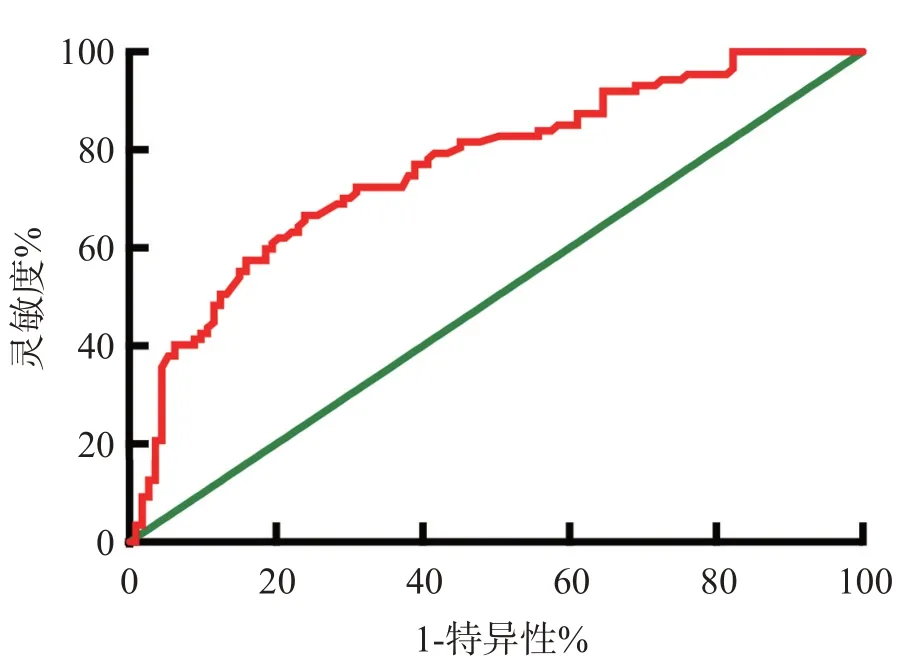
图3 miR-146a预测脑出血组患者预后的ROC曲线
2.5 脑出血组患者预后的Logistic回归分析
以脑出血组患者预后作为应变量,以不同预后患者比较有统计学差异的因素作为自变量,进行Logistic回归分析可知:NIHSS评分、血肿体积、破入脑室、miR-146a和Beclin-1是脑出血患者预后的影响因素(P<0.05),见表5。

表5 脑出血患者预后影响因素的Logistic回归分析
3 讨论
高血压脑出血发生后,血肿周围脑组织炎症、凋亡、自噬等过度激活引起的二次损伤是引起神经功能损害、导致患者预后不良的重要原因,但其机制尚不十分明确,临床也缺乏相应的有效防治手段。近些年,多种miRs被证实在脑出血、脑梗死、心肌梗死等发病过程中起保护作用[9-11]。Huan S等[4]及Chu B等[12]的动物实验研究显示,miR-146a在脑出血及脑缺血再灌注过程中表达减少,过表达miR-146a有保护作用。刘明等[6]的临床研究发现,脑梗死患者血清miR-146a的表达明显减少。本研究结果显示,在血肿周围脑组织中miR-146a的表达水平明显降低,提示miR-146a表达降低可能参与了高血压脑出血的发生,也可能参与了脑出血后神经功能的二次损伤。
miR本身不具备编码蛋白的功能,其生物学作用是调控下游靶基因的表达并调控炎症、凋亡、自噬等生物学过程。Huan S等[4]的动物实验发现,过表达miR-146a显著抑制脑出血大鼠的自噬,miR-146a可能通过调控自噬参与脑出血的发病。自噬是通过溶酶体降解来实现自我吞噬的过程,由Beclin-1、Cathepsin D、LC3-II等蛋白介导。多项临床和基础研究均报道了自噬在脑出血过程中显著激活[13-15],激活的自噬是一把“双刃剑”,在一定程度内的自噬能够起到神经保护作用,但过度激活的自噬会造成细胞发生程序性死亡并加重神经损伤。本研究对自噬基因的检测发现:脑出血患者血肿周围脑组织中Beclin-1、Cathepsin D、LC3-II/LC-I的表达水平均明显增加,表明高血压脑出血发病过程中自噬显著激活,与既往的临床及基础研究结果[13-15]一致。在此基础上,通过相关性分析发现:miR-146a与Beclin-1、Cathepsin D、LC3-II/LC-I呈负相关,提示miR-146a可能在高血压脑出血的发病过程中靶向调控自噬。
本研究还进一步对患者的短期预后进行了随访。国内多项研究采用发病或出院后3个月时的mRS评分进行预后评价,预后不良的发生率约35%~50%[16-18]。在本研究入组的204例患者中,预后不良患者共87例、发生率42.65%,与国内研究的数据基本一致。经ROC曲线分析miR-146a与预后的关系可知:血肿周围脑组织中miR-146a的表达水平对高血压脑出血患者的预后具有评估价值,更进一步验证了低表达的miR-146a在高血压脑出血发病中的作用。高血压脑出血患者预后的影响因素复杂,国内相关研究证实,NIHSS评分、血肿体积、破入脑室是相关的影响因素,提示病情越重、脑出血预后越差。本研究在Logistic回归分析中发现:除了已知的NIHSS评分、血肿体积、破入脑室外,miR-146a及自噬基因Beclin-1也是高血压脑出血患者预后的影响因素,由此推测miR-146a参与高血压脑出血发病的可能分子机制是其表达降低促进自噬过度激活,引起神经功能损害、导致预后不良。
综上所述,miR-146a在高血压脑出血的血肿周围脑组织中低表达且与自噬过度激活、短期预后不良有关,miR-146a有望成为今后研究高血压脑出血二次损伤分子机制及防治手段的靶点。但本研究随访时间较短,仅为3个月,今后可进一步延长随访时间、观察miR-146a与高血压脑出血患者长期预后的关系,进而为阐明miR-146a在高血压脑出血发病中的作用提供更充实的临床证据。
