外周血单核细胞及其亚群数量在吉兰-巴雷综合征病程中的变化及临床意义
任凯夕,赵代弟,白苗,卢佳睿,李宏增,郭俊
吉 兰-巴 雷 综 合 征(Guillain-Barré syndrome,GBS)是一类常见的导致弛缓性瘫痪的急性炎症性周围神经病,常伴有腹泻、上呼吸道感染、疫苗接种或手术等前驱史[1]。目前认为,继发于空肠弯曲菌、巨细胞病毒、寨卡病毒或新型冠状病毒等病原微生物感染后产生的抗自身神经节苷脂抗体,联同单核-巨噬细胞、膜攻击复合物等,共同对周围神经的髓鞘和轴索造成损伤[2,3]。
在GBS发生和进展过程中,单核细胞能够分泌趋化因子、募集其他炎症细胞并分化为巨噬细胞进入神经组织,发挥重要的调节炎症或组织修复等功能[4]。单核细胞具有多样性,可依据表型和功能的差异分为“经典型(classical monocyte,c-Mo)”和“非经典型(non-classical monocyte,n-Mo)”等亚型[5]。c-Mo通过分泌炎性因子、吞噬和抗原提呈等方式发挥促炎作用,而n-Mo则具有减轻炎症、促进血管再生或组织修复的功能[6]。研究表明,c-Mo可转化为n-Mo,在免疫炎性疾病中发挥不同的作用,缓解炎性损伤[7]。然而,在GBS病程中,单核细胞的亚型数量的变化规律如何,其与神经损伤程度是否具有相关性,仍不清楚。本研究首次分析了GBS患者急性期、缓解期及部分复发患者外周血单核细胞的变化情况,探究其与病程及症状的相关性,对临床病情预判及治疗决策制定提供理论依据。
1 资料与方法
1.1 一般资料
收集2015年6月至2019年6月我院收治的GBS患者133例,年龄≥15周岁。依据《中国吉兰-巴雷综合征诊治指南》评估患者病程达峰时间、肢体弛缓性无力症状、腱反射减弱或消失体征、神经电生理检查、前驱感染史、脑脊液蛋白细胞分离特征等[8],选择急性炎性脱髓鞘性多发性神经根神经病(acute inflammatory demyelinating polyneuropathies,AIDP)87例和急性运动轴索性神经病(acute motor axonal neuropathy,AMAN)患者31例共118例入组;排除Miller Fisher综合征的变异型GBS 5例,合并糖尿病周围神经病7例及合并肿瘤3例。健康志愿者96例纳入对照组。所有患者均自愿参加并签署知情同意书。本研究获我院伦理委员会审批(TDLL-KY-202106-02)。
1.2 方法
1.2.1 临床资料收集及症状体征评估 所有患者接受正规GBS治疗并随访18个月,根据随访期GBS的复发及再次入院治疗情况,最终分组为急性期组(首次入院者)118例,缓解期组(118例患者随访过程中GBS未复发但再次返院复查者)36例,复发期组(118例患者随访过程中GBS再次复发入院)6例次。每次入院时,均采用休斯功能分级量表评分(Hughes Functional Grading Scale,HFGS)及医学研究理事会(Medical Research Council,MRC)量表对患者进行评分[9],并详细记录患者的临床资料。其中,FGS评分范围为1~6分:1分为仅有较少的症状并能够奔跑;2分为能在无辅助情况下行走10米以上,但不能奔跑;3分为能在有辅助情况下行走10米;4分为需使用轮椅或卧床;5分为需要全天或部分时间使用辅助通气;6分为死亡。MRC总和评分用于评估患者双侧肩外展、肘屈曲、伸腕、髋屈曲、伸膝、足背屈等6组肌群肌力,每群肌力以0~5级肌力作记录,总分0~60分。
1.2.2 患者外周血采集及流式细胞术分析 各组入院时即采集外周血,用于血常规及流式细胞术分析。使用的抗体:抗人FITC HLA-DR(#307604),抗人Pacific Blue CD11b(#101224),抗人PE CD16(#307630),抗人APC CD14(#301808),均购于美国BioLegend公司。使用美国BD公司FACS Canto流式细胞仪分析细胞[10]。
1.3 统计学处理
2 结果
2.1 首次发病及复发GBS患者资料特点
对118例患者随访的18个月中,5例患者在12个月内出现复发,其中1例患者复发2次。急性期组和复发期组的一般资料、治疗方式、HFGS和MRC总和评分比较见表1-3。

表1 急性期和复发期GBS患者临床资料比较[例(%)]
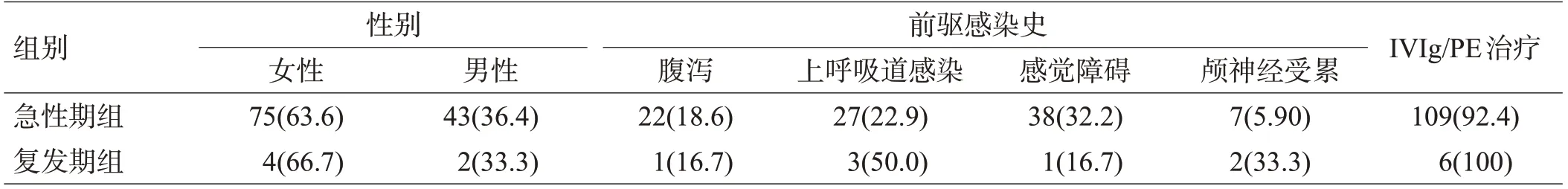
注:IVIg:静注人免疫球蛋白;PE:血浆置换
2.2 各组外周血单核细胞总数变化情况
单核细胞计数在急性期组(49.89±1.99)×109/L及复发期组(66.33±9.178)×109/L患者中较对照组(42.24±1.530)×109/L显著升高(均P<0.05),缓解期组单核细胞计数(41.47±2.721)×109/L与对照组差异无统计学意义(P>0.05),见图1。
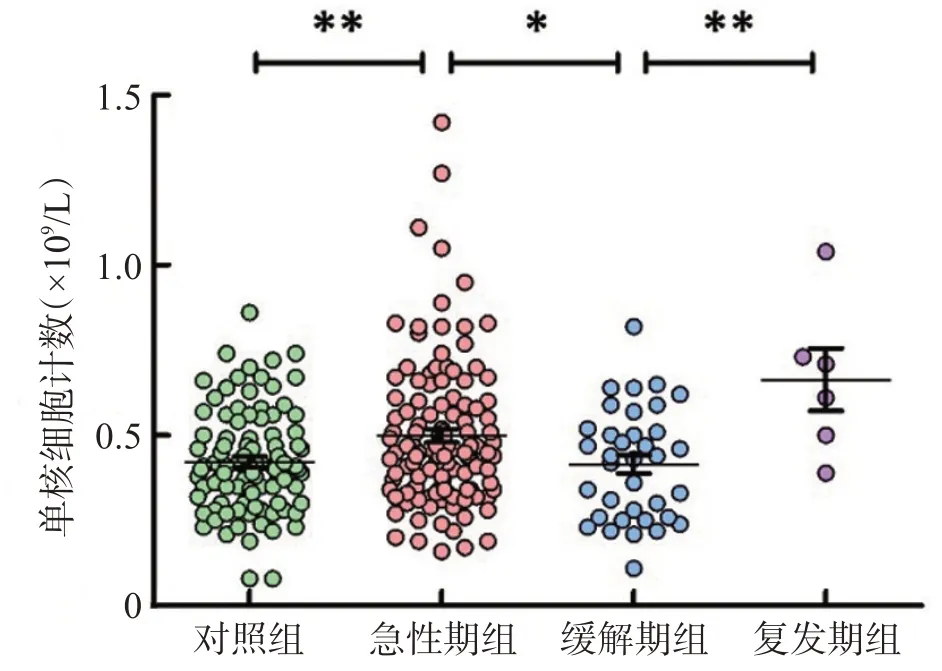
图1 各组间外周血单核细胞计数比较
2.3 各组外周血单核细胞亚群变化及其与MRC总和评分相关性分析
采用流式细胞术对单核细胞进行进一步亚型分析(c-Mo表达CD14++CD16-,n-Mo表达CD14+CD16+),应用荧光标记抗体染色和7AAD染色筛选目标活细胞。在急性期组和复发期组,外周血c-Mo较其他2组明显增加(均P<0.05);在对照组和缓解期组,外周血n-Mo较其他2组明显增加(均P<0.05),见图2,表4。
表4 各组外周血c-Mo和n-Mo数量比较(×109/L,±s)
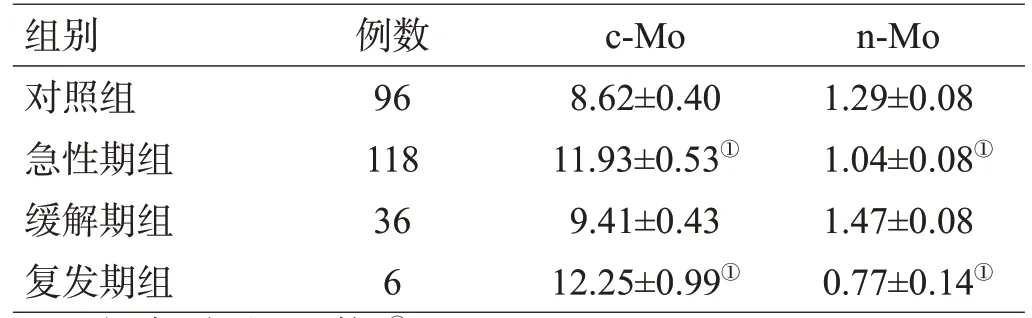
表4 各组外周血c-Mo和n-Mo数量比较(×109/L,±s)
注:与对照组比较,①P<0.05
组别对照组急性期组缓解期组复发期组例数96 118 36 6 c-Mo 8.62±0.40 11.93±0.53①9.41±0.43 12.25±0.99①n-Mo 1.29±0.08 1.04±0.08①1.47±0.08 0.77±0.14①
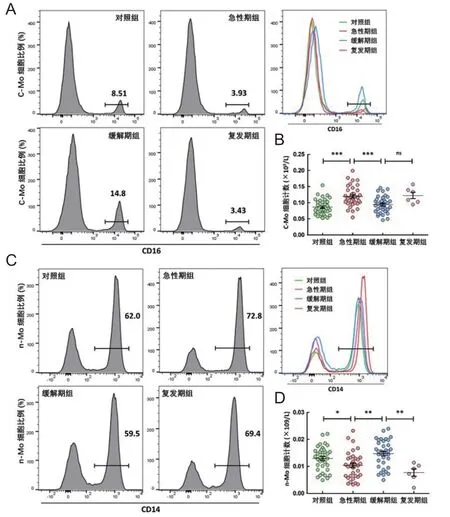
图2 流式细胞术分析各组间单核细胞亚群比例及数量差异
相关分析结果显示,在急性期组,c-Mo数量与MRC总和评分呈负相关(r=-0.3856,P=0.020),见图3A;在缓解期组,c-Mo数量与MRC总和评分无明显相关性(r=-0.0905,P=0.599),见图3B。

表2 急性期和复发期GBS患者HFGS评分比较[例(%)]

表3 急性期和复发期GBS患者MRC总和评分比较[例(%)]
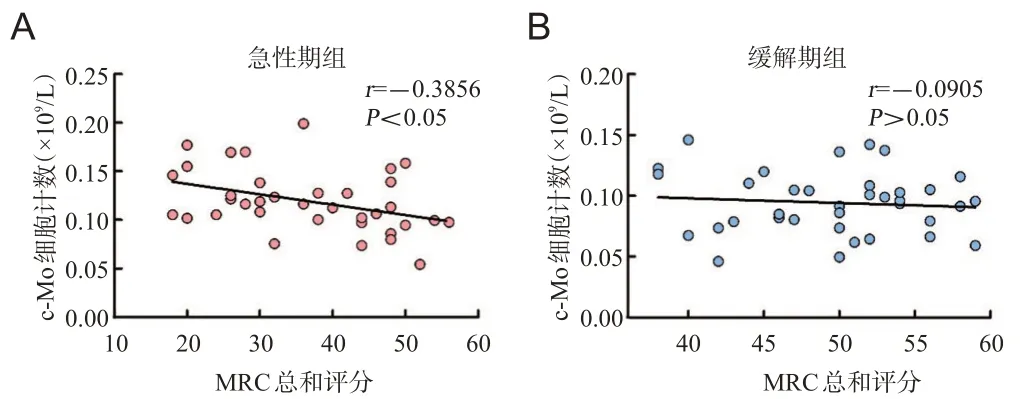
图3 各组c-Mo与MRC总和评分相关性分析
3 讨论
本研究首次发现在GBS急性发病及复发过程中,外周血单核细胞的数量较缓解期及正常对照明显升高。单核细胞亚型c-Mo在急性期升高,而n-Mo减低;c-Mo的升高与MRC总和评分呈负相关,提示c-Mo数量的升高与疾病加重可能存在相关。
在GBS发生和进展过程中,B淋巴细胞介导的适应性免疫应答被认为发挥了重要作用,其所产生的抗自身神经节苷脂抗体可能是造成周围神经损伤的主要原因[11]。但仅能在40%~45%的GBS患者的外周血中检出上述抗体[12,13]。经过免疫球蛋白或血浆置换等清除抗体治疗后,仍有超过20%的患者肢体运动或感觉障碍持续加重[2],3%~5%的患者治疗缓解后出现病情复发[14,15]。GBS神经损伤的深层次免疫机制仍不清楚。
研究显示,固有免疫应答在GBS发病中发挥了关键的作用[16],其中尤以单核细胞在促进神经炎症反应、抗原提呈、神经组织修复等多方面发挥了重要的调控功能[4,17-19]。单核细胞亚型在免疫性神经炎发生时被快速募集到炎症部位,分泌大量IL-6、TNF-α等因子,通过吞噬、抗原提呈等方式加重神经组织炎症;n-Mo表达CD14+CD16+,能够分泌IL-10、TGF-β等免疫调节因子,具有减轻炎症及促进组织修复的作用[20]。其在多种自身免疫性疾病中,都具有调节功能。Hirose等[21]报道在系统性红斑狼疮模型中,单核细胞增多与狼疮相关抗体的血清水平密切相关,其中c-Mo分泌大量IFN-α等炎性因子,并通过促进树突状细胞成熟、促进B细胞成熟为浆细胞等作用持续产生自身抗体加重病情。Puchner等[22]发现,在类风湿性关节炎滑膜增生发生过程中,n-Mo经过粒细胞-巨噬细胞集落刺激因子和核因子κB受体活化因子配体的刺激,能够分化成为破骨细胞,n-Mo可能作为病灶区破骨细胞的“祖细胞”而存在。破骨细胞又可进一步刺激活化n-Mo,促使其分泌单核细胞趋化蛋白,募集更多c-Mo加重骨质破坏。Huang等[23]发现GBS患者的外周血单核细胞与淋巴细胞比例(monocyte-to-Lymphocyte ratio,MLR)较对照人群显著增加。在另一项针对GBS小鼠模型“实验性自身免疫性神经炎(experimental autoimmune neuritis,EAN)”的研究中,将募集单核细胞的趋化因子受体CCR2基因敲除后,EAN模型单核细胞浸润大量减少,小鼠症状以及神经损伤明显减轻[18]。
本研究首次发现在在治疗后的GBS缓解期,c-Mo数量减低,而n-Mo升高。当出现GBS复发时,c-Mo再次升高,且与MRC总和评分呈负相关,提示c-Mo升高可能与GBS复发关系密切。
综上所述,在GBS不同病程中,外周血单核细胞及其亚群具有特征性的变化规律,其变化与GBS症状体征具有相关性,对指导治疗决策以及预测临床预后具有重要意义。
