八宝丹体外抑制淋巴管生成的作用机制研究*
关建华,逯遥,黄彬,2,兰炜兰,林久茂,2
1.福建中医药大学中西医结合研究院,福建 福州 350122; 2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122
恶性肿瘤严重威胁着人类健康,肿瘤转移是恶性肿瘤的一大生物学特征,其中淋巴道转移不仅是肿瘤转移的一个主要途径[1],还是判断预后的一个重要依据[2]。关于肿瘤的淋巴道转移大多认为是肿瘤通过诱导淋巴管生成之后所产生的现象,与淋巴管的生成密切相关[3]。因此,抗肿瘤相关淋巴管生成可能成为抑制肿瘤转移新的治疗策略[4]。八宝丹(babao dan,BBD)属于名贵药物,由麝香、牛黄、羚羊角、蛇胆、三七和珍珠等中药组成,具有清热利湿、活血解毒、祛黄止痛等功效,在恶性肿瘤治疗及辅助治疗方面有着良好的效果[5]。研究表明,BBD可通过抑制肿瘤细胞自噬抑制肿瘤细胞生长[6]。本课题组前期研究发现,BBD可抑制人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)和胃癌细胞的增殖、迁移,并诱导胃癌细胞凋亡[7-10];还可通过调控血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)/血管内皮生长因子受体-2(vascular endothelial growth factor receptor 2,VEGFR-2)信号通路抑制胃癌血管生成[11]。然而,BBD能否抑制淋巴管生成尚未可知,故本研究对此进行探索。
1 材料
1.1 细胞人淋巴内皮细胞(human lymphatic endothelial cells,HLECs,货号:JNO-061)采购于广州吉妮欧生物技术有限公司。
1.2 药物与试剂BBD(厦门中药厂股份有限公司,批号:180101)。Hoechst33258染色试剂盒(江苏凯基生物技术股份有限公司,货号:KGA211);MTT粉末、结晶紫(北京索莱宝科技有限公司,货号:M8180、C8470);内皮细胞培养基(endothelial cell medium,ECM,美国ScienCell公司,货号:SC1001);磷酸缓冲盐溶液(phosphate buffer saline,PBS,美国Life Technologies公司,货号:SH30256.01B);Transwell迁移小室(美国Corning公司,货号:3422);管腔试剂盒(德国Merck Millipore公司,货号:ECM625);Western封闭液(上海碧云天生物技术有限公司,货号:P0023B);VEGFR-3一抗(美国Abcam公司,货号:ab27278);β-actin一抗、VEGF-C一抗、HRP标记的山羊抗小鼠IgG (H+L)抗体、HRP标记的山羊抗兔IgG (H+L)抗体(武汉三鹰生物技术有限公司,货号:66009-1-lg、22601-1-AP、SA00001-1、SA00001-2);基质金属蛋白酶-2(matrix metalloproteinase,MMP-2)(D2O4T)兔单克隆抗体、MMP-9(D6O3H)XP®兔单克隆抗体(美国CST公司,货号:87809S、13667S);Western专用一抗二抗稀释液(武汉博士德生物工程有限公司,货号:14C12B17)。
1.3 仪器Galaxy 17型二氧化碳培养箱(德国Heraeus公司);Infinite M200型多功能酶标仪(瑞士TECAN公司);SW-CJ-1FD型超净工作台(苏州净化设备有限公司);IC1000型Countes®全自动细胞计数仪(美国Life Technologies公司);DFC425型荧光显微镜、DMIL LED型倒置显微镜系统(德国Leica仪器有限公司);超高灵敏度化学发光成像系统(美国Bio-Rad公司)。
2 方法
2.1 药物制备使用PBS将BBD配置成浓度为25 g·L-1的溶液,超声30 min助溶后,采用培养基配成所需要的浓度(0 g·L-1、0.25 g·L-1、0.5 g·L-1、0.75 g·L-1)。
2.2 细胞培养HLECs采用ECM完全培养基(ECM基础培养基500 mL、胎牛血清25 mL、内皮细胞生长因子5 mL和青-链霉素双抗 5 mL)于5%CO2及饱和湿度的37 ℃培养箱中培养。
2.3 细胞增殖检测采用MTT法对细胞增殖进行检测分析。取对数生长期的HLECs,消化处理后按照1×105·mL-1的密度接种于96孔培养板中,每孔100 μL。当细胞汇合度至50%~60%时,每孔加入含不同浓度BBD(0 g·L-1、0.25 g·L-1、0.5 g·L-1、0.75 g·L-1)的培养液100 μL,分别培养24 h和 48 h 后,弃掉原培养液,加入0.5 g·L-1MTT溶液,每孔100 μL,4 h后弃掉MTT,每孔加入100 μL DMSO,室温孵育10 min,充分振荡混匀,采用酶标仪检测570 nm处的光密度(optical density,OD)值,评估细胞增殖。
细胞增殖(%)=(实验组OD值/对照组OD值)×100%
2.4 细胞形态观察取对数生长期的HLECs,消化处理后按照1×105·mL-1的密度接种于6孔培养板中,每孔接种2 mL。当细胞汇合度至50%~60%时,使用含不同浓度BBD(0 g·L-1、0.25 g·L-1、0.5 g·L-1、0.75 g·L-1)的培养基干预24 h后,弃掉原培养基,每孔加入0.5 mL PBS进行清洗,倒置显微镜下观察细胞形态并拍照。
2.5 细胞凋亡实验取对数生长期的HLECs,消化处理后按照1×105·mL-1的密度接种到12孔板中,每孔接种1 mL。当细胞汇合度至50%~60%时,使用含不同浓度BBD(0 g·L-1、0.25 g·L-1、0.5 g·L-1、0.75 g·L-1)的培养基干预24 h后,弃掉原培养基,每孔加入0.5 mL PBS进行清洗,4%多聚甲醛溶液固定细胞10 min,弃上清液,采用Hoechst33258染液染色10 min,荧光显微镜下观察细胞凋亡情况并拍照记录。
2.6 细胞划痕损伤修复实验取对数生长期的HLECs,按3×105·mL-1的密度接种于6孔培养板中,每孔接种2 mL。当细胞汇合度至90%左右时,用小规格枪头垂直于6孔板底,并按照一定力度进行水平划痕,弃掉原培养基并使用PBS清洗3次,拍照记录后使用含不同浓度的BBD(0 g·L-1、0.25 g·L-1、0.5 g·L-1、0.75 g·L-1)干预,于 12 h 后观察细胞划痕损伤修复情况。
2.7 细胞迁移实验含不同浓度BBD(0 g·L-1、0.25 g·L-1、0.5 g·L-1、0.75 g·L-1)的培养基干预对数生长期的HLECs 24 h后,消化并收集细胞,细胞重悬混匀后密度调整为2.5×105·mL-1,取200 μL重悬液加入迁移小室内,700 μL ECM完全培养基置于室外,恒温箱孵育12 h后弃掉培养基,使用4%多聚甲醛固定后采用结晶紫染色10 min,超纯水清洗并晾置干燥,倒置显微镜下观察BBD对HLECS迁移的影响,并随机选取5个视野拍照。
2.8 管腔形成实验于低温环境中预先配置基质胶并铺置于48孔板中,恒温培养箱孵育1 h。将HLECs按照2×105·mL-1的密度接种于含有基质胶的48孔板中,每孔200 μL,3 h后通过倒置显微镜观察HLECs的管腔形成情况。
2.9 Western Blot检测淋巴管生成相关蛋白表达水平采用Western Blot检测HLECs中VEGF-C、VEGFR-3、MMP-2和MMP-9的蛋白表达水平。HLECs以1.0×105·mL-1的密度接种于6孔板,当汇合度达到50%~60%时,使用含不同浓度BBD(0 g·L-1、0.25 g·L-1、0.5 g·L-1、0.75 g·L-1)的培养基干预24 h后收集细胞,提取总蛋白并进行定量定体积。SDS-PAGE电泳,分离胶浓度为10%,蛋白上样量为50 μg,转膜。室温下使用Western封闭液封闭2 h,加一抗[VEGF-C(1:3 000)、VEGFR-3(1:1 000)、MMP-2(1:1 000)、MMP-9(1:1 000)和β-actin(1:5 000)],4 ℃孵育14 h~18 h。室温条件下TBST洗涤3次,每次10 min,加二抗(1:5 000),室温下孵育2 h,TBST洗涤3次,每次10 min,使用超高灵敏度化学发光成像系统显影并分析。

3 结果
3.1 BBD对HLECs增殖的影响与0 g·L-1BBD组比较,干预24 h及48 h后,0.25 g·L-1BBD组、0.5 g·L-1BBD组及0.75 g·L-1BBD组HLECs的增殖能力明显降低(P<0.01)。见图1。
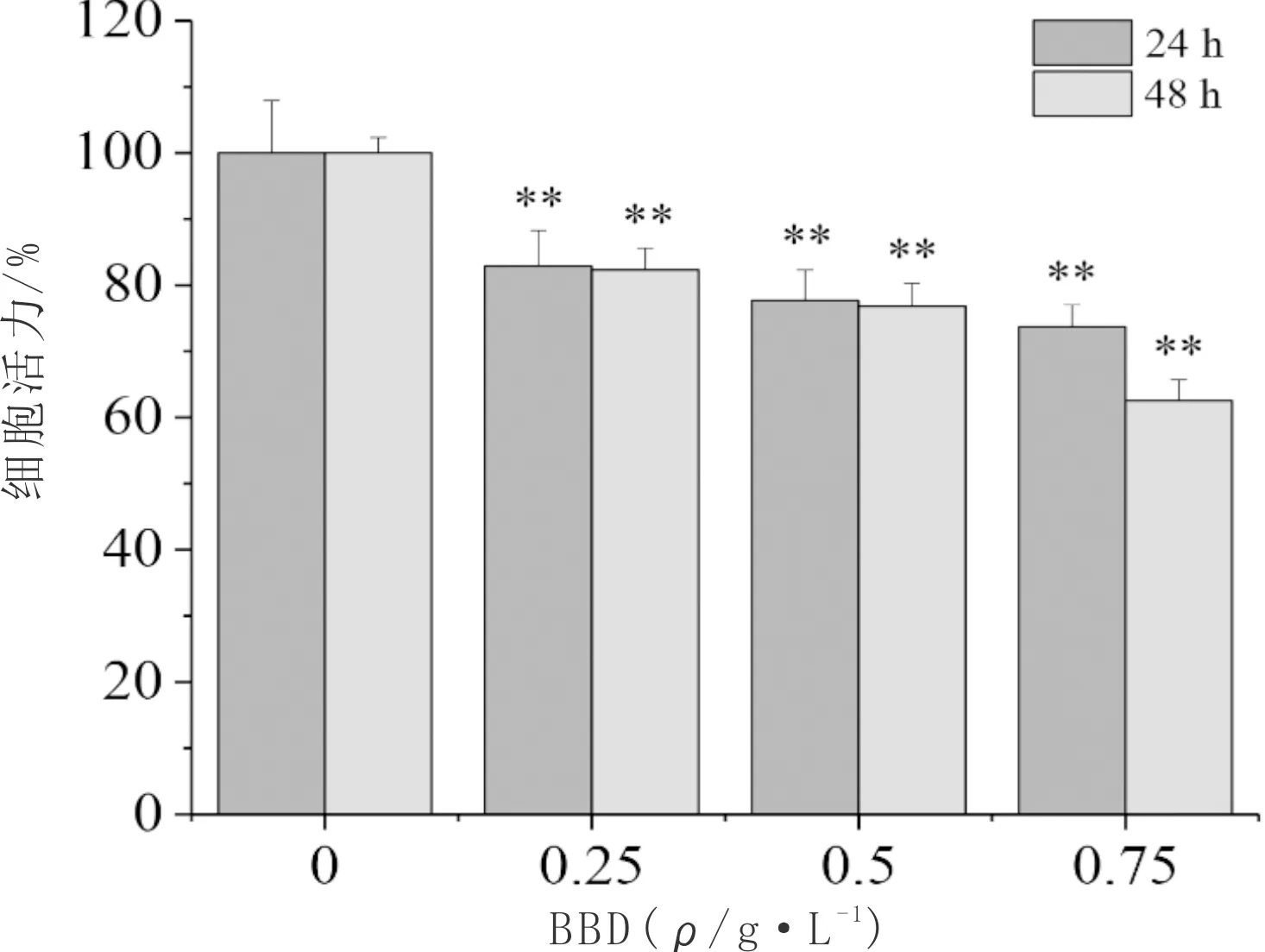
注:与0 g·L-1 BBD组比较,**P<0.01
3.2 BBD对HLECs形态的影响与0 g·L-1BBD组比较,其余浓度BBD组HLECs出现细胞密度减少,部分细胞脱落的现象,且呈现明显的剂量依赖性。提示BBD对HLECs生长有着抑制作用,并呈现剂量依赖性。见图2。
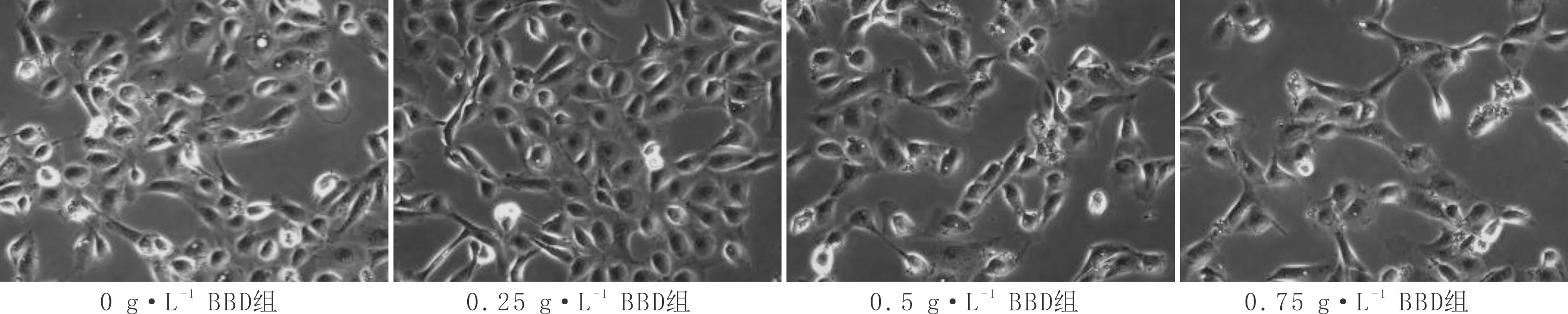
图2 BBD对HLECs形态的影响(×200)
3.3 BBD对HLECs凋亡的影响与0 g·L-1BBD组比较,其余浓度BBD组HLECs的细胞凋亡率明显升高(P<0.01);与0.25 g·L-1BBD组比较,0.5 g·L-1BBD组和0.75 g·L-1BBD组HLECs的细胞凋亡率明显升高(P<0.01);与0.5 g·L-1BBD组比较,0.75 g·L-1BBD组HLECs的细胞凋亡率明显升高(P<0.01)。提示BBD能够促进HLECs凋亡,且呈现明显的剂量依赖性。见图3。
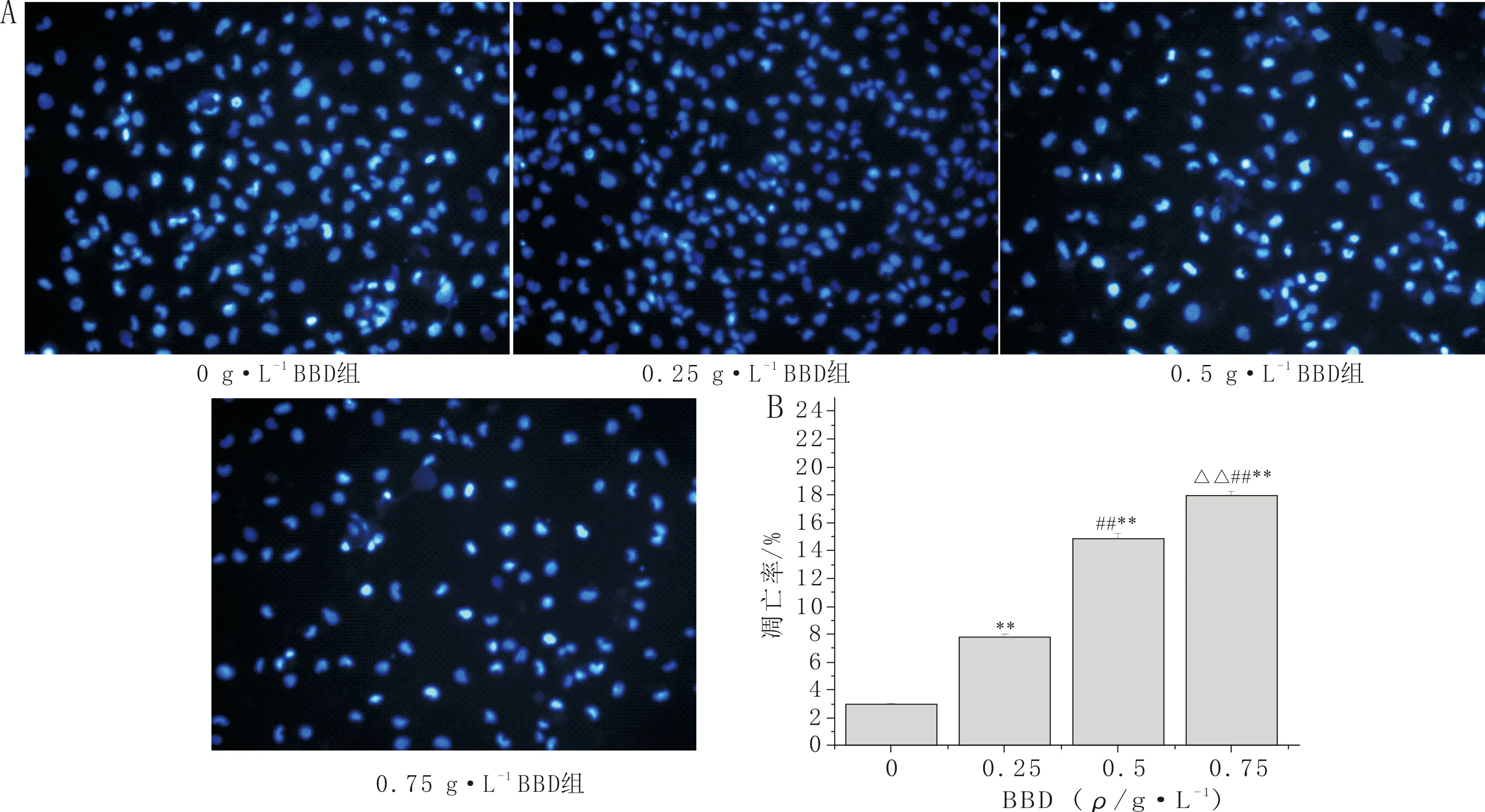
注:A:细胞凋亡图(×200);B:各组细胞凋亡率结果比较;与0 g·L-1 BBD组比较,**P<0.01;与0.25 g·L-1 BBD组比较,##P<0.01;与0.5 g·L-1 BBD组比较,△△P<0.01
3.4 BBD对HLECs损伤修复能力的影响与0 g·L-1BBD组比较,经其余浓度BBD干预后,HLECs向划痕区域愈合的速度逐渐减缓,细胞损伤的修复能力逐渐减弱。提示:BBD可抑制HLECs损伤修复能力。如图4。

图4 BBD对HLECs损伤修复能力的影响(×100)
3.5 BBD对HLECs迁移能力的影响0 g·L-1BBD组细胞可以成功迁移,证明HLECs自身具有迁移能力。与0 g·L-1BBD组比较,经其余浓度BBD干预后,HLECs的迁移率显著降低(P<0.01),且呈现浓度依赖性。提示:BBD具有抑制HLECs迁移的作用。见图5。
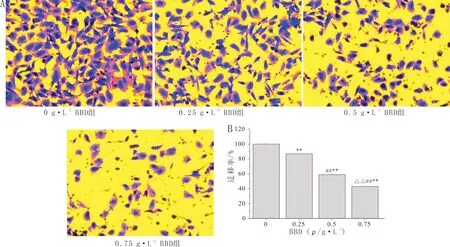
注:A:细胞迁移图(×200);B:细胞迁移率统计结果图;与0 g·L-1 BBD组比较,**P<0.01;与0.25 g·L-1 BBD组比较,##P<0.01;与0.5 g·L-1 BBD组比较,△△P<0.01
3.6 BBD对HLECs管腔生成能力的影响0 g·L-1BBD组HLECs有较多的管腔生成,提示HLECs自身具有较好的管腔生成能力。与0 g·L-1BBD组比较,其余浓度BBD干预后,HLECs管腔生成数量显著减少(P<0.05),且呈剂量依赖性。提示,BBD能够抑制HLECs的管腔生成。见图6。

注:A:管腔生成图(×100);B:管腔生成率统计结果图;与0 g·L-1 BBD组比较,*P<0.05;与0.25 g·L-1 BBD组比较,#P<0.05;与0.5 g·L-1 BBD组比较,△P<0.05
3.7 BBD对HLECs中淋巴管生成相关蛋白表达水平的影响与0 g·L-1BBD组比较,其余浓度BBD干预HLECs 24 h后,HLECs中VEGF-C、VEGFR-3、MMP-2与MMP-9蛋白表达水平显著下调(P<0.05)。提示,BBD可抑制HLECs中淋巴管生成相关蛋白的表达水平。见图7。
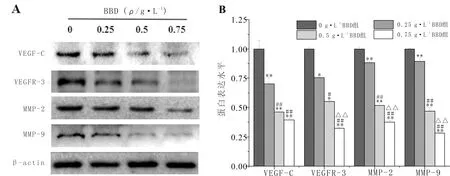
注:A:HLECs中淋巴管生成相关蛋白免疫印疫图;B:各组HLECs中淋巴管生成相关蛋白结果比较;与0 g·L-1 BBD组比较,*P<0.05,**P<0.01;与0.25 g·L-1 BBD组比较,#P<0.05,##P<0.01;与0.5 g·L-1 BBD组比较,△△P<0.01
4 讨论
研究发现,淋巴道转移是恶性肿瘤对人类生命健康的最大威胁[12-13],因此,抑制淋巴管生成是目前研究抗肿瘤转移的热点之一。VEGF由多种组织细胞分泌,是肿瘤血管生成的重要指标,对肿瘤淋巴道转移有着至关重要的作用[14]。VEGF-C作为目前发现的唯一特异性血管生长因子,与其特异性受体VEGFR-3成为目前公认的促进淋巴管生成关键因子[15]。研究证实,VEGF-C与VEGFR-3结合后,可以促进HLECs的增殖、迁移,促进淋巴管生成[16-17]。
细胞外基质在肿瘤转移的过程中发挥着重要作用,与细胞外基质完整性相关的基质金属蛋白酶家族(matrix metalloproteinases,MMPs)与肿瘤的转移及预后密切相关[18-19]。MMP-9能够降解细胞外基质Ⅳ型胶原及基底膜,促进肿瘤细胞的浸润与转移,还能够促进内皮细胞的迁移和新血管生成,从而促进肿瘤的发生发展[20-21]。MMP-2与MMP-9能够共同发挥降解多种细胞外基质蛋白的作用,如IV型胶原、层粘连和纤维连接蛋白[22]。Ⅳ型胶原是构成细胞外基质和基底膜的主要蛋白,MMP-2、MMP-9是降解Ⅳ型胶原最主要的酶,在血管基底膜降解的早期发挥重要作用。因此,抑制MMP-2和MMP-9的表达可有效防止血管基底膜降解,进而减少肿瘤血管的生成[23]。研究证明,MMP-2与MMP-9表达水平的高低与肿瘤转移密切正相关[18,24-25],推测,MMP-2与MMP-9蛋白表达水平与淋巴管生成及迁移密切相关。
近年来的研究发现,中草药提取物乃至复方制剂在辨证论治的基础上,运用中医理论来指导用药,对肿瘤的发生发展及转移有重要影响[26]。如川芎具有活血化瘀的功效,对恶性肿瘤的侵袭和转移有一定的治疗效果[27];解毒消癥饮对体外血管生成有着一定程度抑制作用[28];清解扶正颗粒能有效抑制体外淋巴管生成[29]。BBD同样具有清热利湿,活血解毒的功效,其是否能够一定程度上抑制淋巴管生成尚未可知。因此,本研究选择人淋巴内皮细胞为研究对象,考察BBD在体外抑制淋巴管生成的能力。
MTT及Hoechs33258染色实验发现,随着BBD浓度增加,对HLECs增殖的抑制作用逐渐增加,促凋亡能力也逐渐增加,说明BBD能够抑制HLECs增殖,促进HLECs凋亡;细胞划痕实验和Transwell实验发现,BBD能够抑制HLECs的损伤修复能力及迁移能力,且呈现明显剂量依赖性;管腔形成实验及Westem Blot检测发现,BBD能够抑制HLECs的管腔生成能力,显著下调淋巴管生成相关蛋白VEGF-C、VEGFR-3、MMP-2及MMP-9蛋白表达水平。
综上所述,BBD可以促进HLECs凋亡,抑制HLECs增殖、迁移及淋巴管的生成,其作用可能与下调VEGF-C、VEGFR-3、MMP-2和MMP-9蛋白表达水平有关。

