预测血液透析患者发生低血压的风险列线图模型的建立及护理对策
傅华珍 丁小容 陈 丹 姜 蕾 宋长帅 任 慧
血液透析(Hemodialysis,HD)是临床治疗肾功能衰竭患者的方式之一[1],其原理类似于半透膜,它将体内血液流向体外透析设备,通过超滤、弥散、吸附和对流将血液与相似机体浓度电解质溶液进行物质交换,从而清除体内代谢废物以及各种有害物质,同时维持水、电解质及酸碱平衡,最后将净化正常的血液输送回体内[2]。低血压(Intradialytic hypotension,IDH)是血液透析患者比较普遍的并发症,其发生率高达20%~30%[3],尤其在高龄、糖尿病肾衰竭、高甲状旁腺素(PTH)、自主神经病变、营养不良等患者中极易发生。而患者IDH可以导致透析血流量不足,超滤困难,透析不充分;还可以造成心绞痛、心律失常甚至心肌梗死;肾功能进一步衰竭以及脑供血不足致脑梗塞的发生;严重者可以造成透析患者死亡[4]。因此,分析HD患者发生IDH 的相关危险因素显得十分重要,同时对于行HD患者的护理提供一定的指导。本研究回顾性分析2018年1月-2019年12月200例血液透析患者的临床资料,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月-2019年12月200例血液透析患者的临床资料。纳入标准:(1)规律血液透析龄≥6个月,每周透析2~3次,透析过程顺利;(2)年龄≥18岁;(3)认知能力正常,已签署知情同意书;(4)无相关过敏反应症状。排除标准:(1)有发热或者感染等临床症状;(2)合并严重心血管系统类疾病,甲状腺功能病变;(3)伴有消化道出血或其他类型出血症状;(4)严重肝功能损伤。本研究已获得院医学伦理委员会审核批准。
1.2 方法
分析和统计200例血液透析患者的临床资料,主要包括患者年龄、性别、病程、体质量指数(BMI)、透析龄、超滤率、合并糖尿病、糖尿病肾衰竭、血红蛋白、低密度脂蛋白-胆固醇(LDL-C)、白蛋白、高敏C反应蛋白(hs-CRP)、高PTH、血肌酐、血尿素氮、自主神经功能病变、营养不良。构建发生低血压风险列线图模型,评估模型的预测效能。
1.3 统计学方法
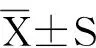
2 结果
2.1 血液透析患者IDH的发生率
200例血液透析患者中发生IDH 49例,发生率为24.5%,未发生IDH 151例。
2.2 血液透析患者发生IDH的单因素分析,表1
表1 血液透析患者发生IDH的单因素分析
结果显示,年龄、糖尿病肾衰竭、PTH、自主神经功能病变、营养不良比较差异有统计学意义(P<0.05)。
2.3 血液透析患者发生IDH的Logistic多因素回归分析,表2~3

表2 变量赋值
以IDH发生情况为因变量,以单因素分析得到的5项具有统计学意义的危险因素(高龄、糖尿病肾衰竭、高PTH、自主神经功能病变、营养不良)为自变量进行Logistic多因素回归分析,结果显示,高龄、糖尿病肾衰竭、高PTH、自主神经功能病变、营养不良是血液透析患者发生IDH的独立危险因素(P<0.05)。
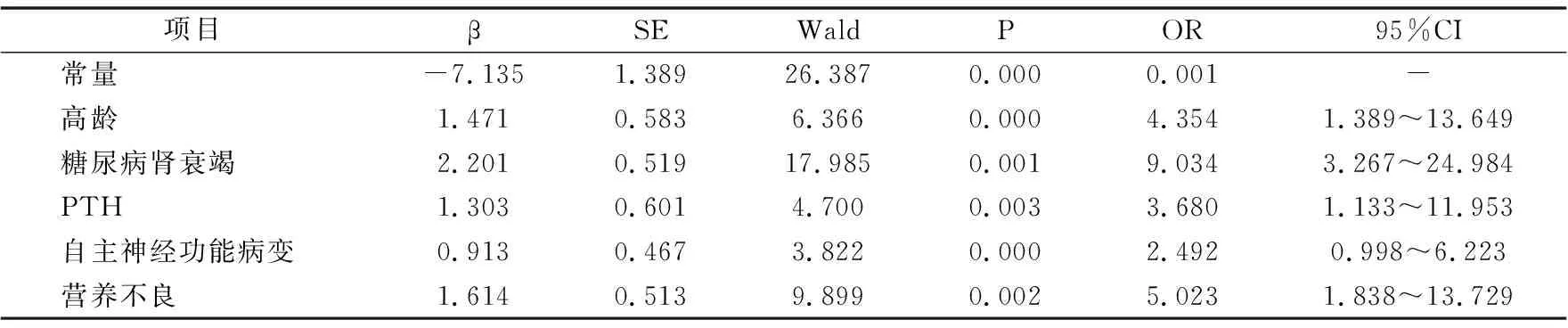
表3 血液透析患者发生IDH的多因素分析
2.4 预测血液透析患者发生IDH的列线图风险模型的建立
本研究基于Logistic多因素分析得出的独立危险因素(高龄、糖尿病肾衰竭、高PTH、自主神经功能病变、营养不良),建立风险列线图预测模型,可将Logistic多因素回归结果可视化呈现,可预测单独危险因素或组合危险因素下发生IDH的风险性,见图1。纳入原始数据1000次重复抽样后(行Bootstrap 法)采用校准曲线进行内部验证该模型,以评估列线图风险预测模型的精准度和区分度。预测值基本接近于实际值,见图2。C-index指数0.817(95%CI:0.798~0.845),表明该模型精准度和特异性较好,见图3。因校准曲线基本呈对角线趋势,C-index指数预测性较好,因此该风险预测列线图模型的精准度和区分度较好。
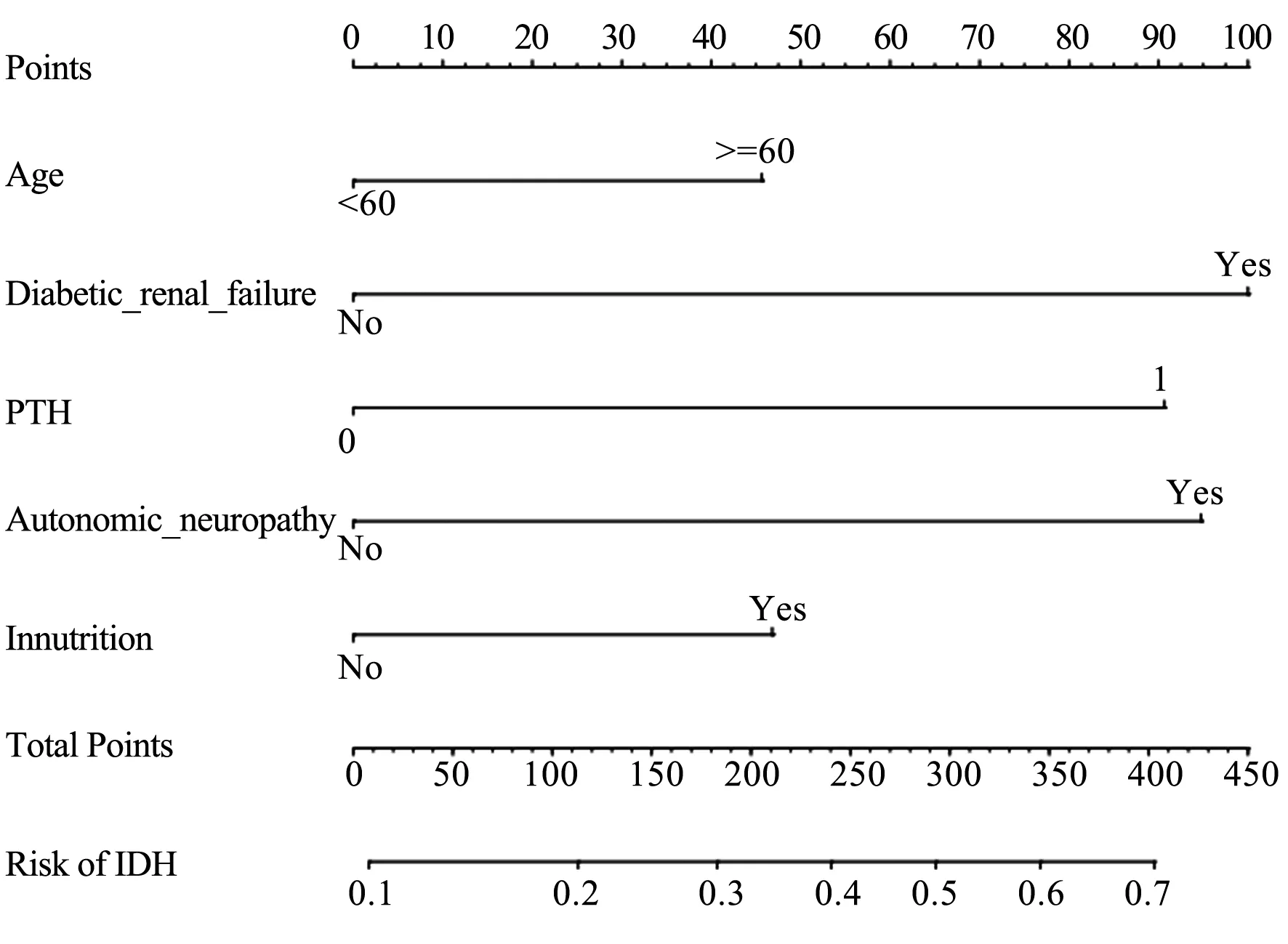
图1 预测血液透析患者发生IDH的列线图风险模型的建立
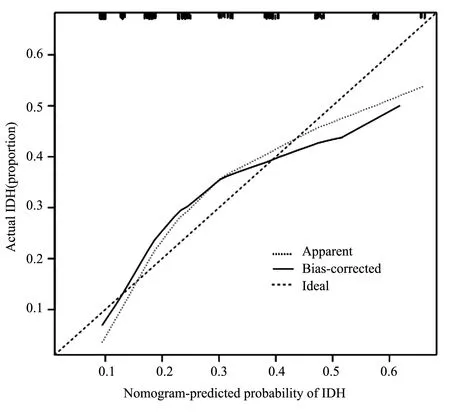
图2 列线图模型预测血液透析患者发生IDH的风险的验证
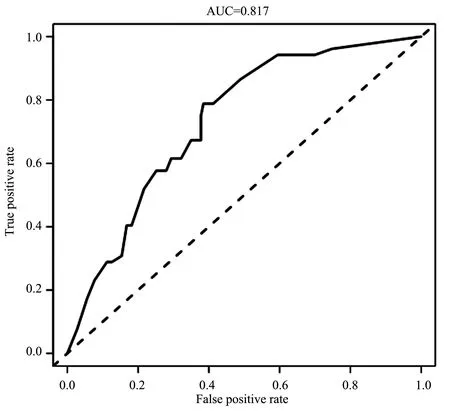
图3 列线图模型预测血液透析患者发生IDH的ROC曲线
3 讨论
血液透析过程中常见的并发症之一是低血压,患者发生该并发症的风险为20%~30%之间[5]。由于透析过程中血压异常降低,往往提前结束或中断血液透析,致使终末期肾脏病患者血液透析不充分、患者耐受性较差。另外,低血压也可导致机体相关器官供血不足,形成水钠潴留,严重影响血液透析的疗效,对患者生活质量造成不良的影响[4]。若长期发生IDH可加重肾功能减退,诱发各种并发症,形成动静脉血栓及内瘘功能丧失,患者的预后及其生存质量严重下降,是导致致死率高的独立危险因素[6]。目前,有关研究表明与患者年龄、糖尿病肾衰竭、PTH、自主神经功能病变、营养不良、透析膜的生物相容性等因素有一定的联系[7]。因此,分析血液透析患者发生IDH的独立危险因素,并针对个体制定针对性护理措施,有助于改善患者的预后,提高血液透析的临床疗效。
本研究结果显示,高龄、糖尿病肾衰竭、高PTH、自主神经功能病变、营养不良是血液透析发生IDH的独立危险因素。(1)高龄患者是血液透析发生IDH的高发群体,年龄越大越容易发生IDH。其主要机制为患者机体免疫调节功能随着年龄的增加而不断的降低,而高龄患者行血液透析时,由于体内血液环境发生一定的改变,其血液成分发生微量变化以及血循环不足,患者调节能力差导致低血压发生风险增加[8]。因此,对于高龄血液透析患者,首先分析体内水潴留水平,进行适当预充,透析过程中应缓慢进行超滤;结束超滤后,应让患者适当休息片刻再起,避免出现体位性IDH或突发性晕厥[9]。(2)糖尿病肾衰竭患者发生IDH的风险高于对照组(P<0.05),糖尿病肾衰竭可导致多发性微血管病变,致使患者肾功能不全,以及心脏血流动力学随之发生变化,患者血液透析过程中极易发生IDH。另外,糖尿病肾衰竭患者会伴随心律失常、血管血栓等各种并发症,不仅增加了IDH 的风险,更严重威胁患者的生存健康[10]。因此,糖尿病肾衰竭患者行血液透析,建议先单超滤,然后进行透析,即序贯透析疗法。若患者条件允许,可以保障透析频率为3~4 次/周,既可以改善患者的生活质量,也可以减少IDH 的发生率。(3)PTH对血管具有很强的扩张作用,同时对于去甲肾上腺素、去氧肾上腺素以及血管紧张素具有较强的拮抗作用,平滑肌的收缩受到抑制,诱发IDH发生。据报道[4],PTH≥500pg/ml的IDH发生率远高于PTH<500pg/ml的患者(P<0.05)。因此,针对高PTH患者,其透析方式应为低温可调钠,控制在35.5℃的透析温度,可以升高患者渗透压,有利于儿茶酚胺形成与释放,进而增强外周阻力,稳定血压。Mustafa等[11]研究表明,降低透析液温度可以有效改善慢性血液透析患者的预后疗效。(4)自主神经功能病变是血液透析发生IDH的重要原因之一,患者超滤末期交感神经张力持续性降低,而自主神经功能紊乱,交感神经刺激外周血管能力变差,血液透析时外周血管阻力降低,从而导致患者发生或进一步加深IDH。对于自主神经功能病变患者,可给予一定的药物协助刺激,如选择性外周血管受体类激动剂的应用,主要针对小动脉或微静脉血管,促进血管收缩,增加外周血管阻力,进而升高血压[12]。(5)营养不良是血液透析发生IDH的主要原因之一,患者血液透析同时会造成氨基酸和蛋白质的流失,临床主要表现为低血红蛋白、贫血、白蛋白低,对血液透析耐受性较差,而且贫血可造成血管扩张,其IDH的风险性更高[13]。患者需补充充足优质蛋白,主要为必需氨基酸含量丰富且代谢废物少,多食谷类食物,避免脂肪摄入,贫血患者给予一定量的铁剂补充。
本研究基于危险因素建立了预测血液透析患者发生IDH的列线图模型,结果显示,高龄为46分、糖尿病肾衰竭为100分、PTH为90分、自主神经功能病变为95分、营养不良为48分。提示医务人员可以通过患者各项目得分情况,预测血液透析患者发生IDH的发生概率。此外,模型验证结果显示C-index为0.817(95%CI:0.798-0.845),校正曲线的预测值与实测值基本一致,内部验证ROC曲线下面积(AUC)为0.817,以上均表明本研究列线图具有良好的辨别度和预测效能。
综上所述,高龄、糖尿病肾衰竭、高PTH、自主神经功能病变、营养不良是血液透析患者发生IDH 的独立危险因素,其建立的风险预测列线图模型精准度和区分度较好,临床应用价值高,针对不同的危险因素采用相应的护理对策,可以降低LDH的发生率。

