优秀运动员运动诱发性支气管痉挛:机制诱因、运动表现与诊治预防
刘 猛 ,高炳宏
运动诱发性支气管痉挛(exercise-induced bronchoconstriction,EIB)是指剧烈运动诱发的暂时性气道狭窄,其可单独发生,亦可伴有呼吸不适等症状。运动医学研究报道,运动员的EIB发病率(11%~50%)远高于普通人群(4%~20%),EIB等呼吸道疾病已成为运动员群体的第一大慢性疾病(Couto et al.,2018)。EIB不仅会引发咳嗽、胃部疼痛及呼吸困难等不适症状,还会干扰训练竞赛,限制竞技能力的发展与提升(Price et al.,2014b),严重时还可诱发运动猝死等重大疾病。1980—2006年,美国共有182名运动员死于非创伤性运动猝死,28例与EIB有关(Maron et al.,2009)。BecKER等(2004)调查的263例运动猝死案中,亦有23.1%与EIB直接或间接相关。由此,EIB已成为威胁运动员生命健康的重要因素,值得警惕。
优秀运动员是EIB高发群体,其EIB发病率(27%~61%)远超同项目普通运动员(Weiler et al.,2016)。德国冬奥运动员的EIB阳性率为34.3%(Selge et al.,2016)。波兰夏奥运动员中,22.4%患有EIB,22.5%存在EIB疑似症状(Kurowski et al.,2016)。11.8%的芬兰冬奥运动员需要长期进行EIB药物治疗(Aavikko et al.,2012)。另有数据表明,优秀运动员的EIB发病率正呈快速上升趋势,意大利与芬兰奥运代表团的运动员EIB发病率已分别由11.3%、9.4%迅速升至17.2%、12.6%(Bonini et al.,2015a)。世界反兴奋剂机构(World Anti-Doping Agency,WADA)公布的EIB治疗用药豁免(therapeutic use exemption,TUE)申请率,亦由4.2%增至7.2%。受EIB高发因素影响,近年来优秀运动员EIB违规治疗或药物滥用事件迭出,已引起国际社会的高度关注(Fitch,2012)。
作为全球运动医学领域关注与研究的焦点,优秀运动员的EIB研究成果被多国成功应用于奥运参赛备战与大众健康防护。然而,目前国内对优秀运动员EIB的关注较少,研究成果鲜见报道,这无疑会对我国奥运参赛备战及大众体育推广产生不利影响。本研究通过梳理国内外相关研究成果,对优秀运动员EIB的产生机制与诱发因素、运动表现影响及诊治预防3个方面进行整理、分析与归纳。
1 优秀运动员EIB的产生机制与诱发因素
1.1 优秀运动员EIB的产生机制
长期在极端(严寒、酷热等)或非健康(雾霾、刺激物等)的空气环境中高强度运动,是导致优秀运动员EIB高发的主要原因(石月 等,2018;Ali et al.,2012)。呼吸过程中,机体会对进入气道的干冷气体进行加温、加湿处理,造成气道表面水分及热量的丢失(Rundell et al.,2018),正常情况下,机体通过自我调节机制进行平衡性补充,维持气道内的生态平衡及粘膜渗透压稳定,但高强度运动时通气量陡增(最高可达200 L/min),大量干冷气体直接灌入下呼吸道,导致气道表面水分热量迅速流失(Niinimaa et al.,1980),进而引发 Na+、Cl-、K+等离子浓度升高、粘膜纤毛清除率下降以及粘膜表面体液渗透压升高,刺激肥大细胞释放白三烯、前列腺素E2等炎症介质。白三烯等会激活特异性受体,引发气道平滑肌收缩与粘液分泌,最终导致EIB发生(Ali et al.,2012)。运动结束后,气道开启重加温过程,引发粘膜反应性充血、微血管通透性增加等连锁反应,导致气道水肿及炎症介质释放,进一步促进EIB的产生(McFadden et al.,1982)。
高通气量呼吸或刺激物造成的气道上皮细胞损伤,也是导致优秀运动员EIB发生的重要原因。Bonsignore等(2003)指出,55%的越野滑雪优秀运动员在赛后痰液检测中存在出破损上皮细胞数量显著增多的情况,面临更高的EIB发病风险。Bougault等(2009)发现,赛后出现支气管痉挛症状的优秀游泳运动员,其痰液中的上皮细胞数量远超其他无症状运动员。该研究认为,运动中氯基化合物的大量吸入造成气道上皮细胞损伤,是导致上述问题的主要原因。此外,气道上皮损伤标记物——克拉氏细胞蛋白(clara cell secretory protein 16,CC16)的发现也有力支撑了上述观点。Anderson等(2008)指出,高强度运动后,部分运动员出现呼吸道疼痛等不适症状,伴有血清CC16水平的显著增加,这主要归因于高通气量呼吸造成的气道上皮组织应激性损伤。Chimenti等(2010)在马拉松运动员的赛后检测中发现其血清白介素-8浓度与CC16水平显著升高。此外,高通气量呼吸或刺激物引发的气道炎症(Bougault et al.,2012)、反复高强度运动引起的迷走神经主导强化(Kaltsatou et al.,2011)等都会促进EIB产生。
1.2 优秀运动员EIB的诱发因素
1.2.1 运动因素
运动因素是诱发EIB的第一因素。运动状态(强度、时间及持续性)(表1)是造成不同运动项目EIB发病率差异的主要原因(Carlsen et al.,2016)。运动强度与时间是诱发EIB的关键因素,二者缺一不可。诸如短跑或冰壶,虽然运动强度极高或运动时间持久,但其EIB发病率均显著低于同场地的高强度、长时性运动项目。研究显示,高强度耐力性运动项目的EIB发病率占据统治性地位。国际奥委会医学委员会(International Olympic Committee Medical Commission,IOC-MC)数据显示(Fitch,2012),在2002—2010年的5届奥运会中(冬奥3届,夏奥2届),TUE(EIB)申请率前3名均为高强度耐力性项目,其中冬奥会为越野滑雪、冬季两项及速度滑冰,夏奥会为铁人三项、公路自行车及游泳。运动医学界认为,运动强度为80%~85%MHR、运动时间为6~8 min(或以上)运动项目的EIB发病风险最高(Couto et al.,2018)。EIB的经典诊断方法——运动激发试验,就是基于此原理设计的。在运动强度与时间的基础上,运动持续性是影响EIB产生的又一关键因素。Levai等(2014)在对优秀游泳与拳击运动员的研究中发现,尽管其运动强度、时间高度相似,但EIB发病率却存在巨大差异(游泳65%;拳击9%)。其分析认为,游泳和拳击分属持续性、间歇性高强度运动项目,这是导致上述差异的重要原因。Levai等(2016)在后期的重复性研究中亦得出类似的结论。

表1 不同运动项目EIB发病率Table 1 The Risk of EIB in Different Sports
1.2.2 环境因素
长期暴露于特定运动环境中,反复吸入或接触某类型气体或污染(过敏)源,是诱发优秀运动员EIB的核心因素(Rundell et al.,2015)。不同运动项目因所处运动环境有别,诱发因素也不同。对于雪上项目,干冷气体的吸入是EIB的主要诱发因素。冬季雪场的空气温度(-20℃~-10℃)与湿度(20%~40%RH)显著低于肺部的气体交换标准(37 ℃,99%RH)(Kennedy et al.,2019)。Fadden等(1982)指出,运动员在-17℃环境中以60 L/min的通气强度呼吸4 min后,气道温度下降4℃,体液丢失10.3 g,长期吸入此类空气会造成多级支气管(尤其是10~12级)炎症以及气道上皮细胞损伤,最终导致EIB产生。泳池类项目EIB的产生,与泳池消毒剂(次氯酸钠等)紧密相关(Carter et al.,2019)。次氯酸钠氯会与水中有机物发生取代反应生成氯仿,与含氮化合物(唾、尿、汗)反应生成氯胺,这两类物质通过呼吸道、皮肤等进入体内,引发气道炎症及上皮细胞损伤,诱发支气管平滑肌痉挛。冰上项目EIB的诱发源主要为覆、制冰设备产生的废气或粉尘(Cox et al.,2019)。它们会在各级支气管及肺部沉积,引发多级支气管炎症及小气道关闭。此外,高通气量呼吸会强化粉尘沉积率,进一步提升EIB发病风险(Rundell et al.,2014)。公路竞赛类项目的EIB诱发因素众多,极端天气、雾霾、臭氧及车辆尾气(NO2、SO2等)皆会诱发EIB(Marry et al.,2010;Rundell et al.,2015)。Salvi等(1999)发现,受试者暴露于汽车尾气环境中1 h后,其中性粒细胞、肥大细胞及CD41淋巴细胞其显著性增加。Weng等(2018)发现,优秀公路自行车选手的白介素-17A水平在赛后出现显著性升高。此外,雾霾、臭氧等会刺激机体产生大量自由基,破坏线粒体与细胞膜,改变基因表达,加剧气道炎症产生(Kehrer et al.,2015)。
1.2.3 其他因素
哮喘病(家族)史、种族及性别等因素,也会诱发和影响EIB的产生。哮喘病(家族)史会导致更高的EIB发病率,约90%的哮喘运动员同时患有EIB,具有哮喘病(家族)史运动员的EIB发病率为其他运动员的2倍(Giacco et al.,2015)。因此,在青少年中选材时进行EIB筛查诊断及家族病史调查,确有必要。不同种族之间的EIB发病率亦存在差异。Jones等(1996)在对593名青春期前儿童的EIB诊断研究中发现,亚裔儿童的EIB发病率最高(12.3%),之后依次为非裔(9.1%)、英格兰裔(4.5%)、苏格兰裔(2.6%)。针对家长调查显示,亚裔家长的EIB发病率最高,其原因需进一步探讨。性别因素亦会影响EIB的产生。Baets等(2005)对15 241名青少年的EIB诊断研究显示,女、男孩的EIB阳性率分别为8.5%、6.4%。美国奥委会数据显示,1998年长野冬奥会美国代表团女性与男性运动员的EIB发病率分别为26%、18%(Weiler et al.,2000)。由此推断,女性运动员更易患EIB。
优秀运动员EIB的产生机制是一个复杂的病理生理学过程,是诸多外部因素(空气条件、刺激或污染物、运动状态等)与人体内部各系统(呼吸、免疫、神经等)长期相互作用的结果(图1)。
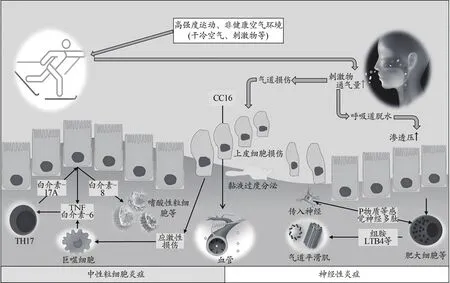
图1 EIB诱发因素与发生机制的关系Figure 1.TheAffect Factors and Mechanisms of Exercise-Induced Bronchoconstriction
2 EIB对优秀运动员运动表现的影响
重大比赛期间,受高强度竞赛、陌生场馆环境及赛前压力等因素影响,运动员会面临更高的EIB发病风险(Carlsen et al.,2016)。甚有部分运动员因EIB突发或漏检与奥运金牌失之交臂(Haahtela et al.,2008)。相关资料显示(中国反兴奋剂中心,2019),2016年里约奥运会英国代表团(n=366)53名选手申请了赛内TUE(EIB);2018年平昌冬奥会上,仅挪威代表团(n=109)就携带了超6 000份的EIB药物,用于赛内、赛外的EIB预防与治疗。虽然鲜见关于EIB对运动表现影响的研究,但从各奥运强国对重大比赛期间EIB治疗的高度重视来判断,EIB极有可能对运动表现产生不利影响。
EIB的产生机制复杂,涉及因素颇多,对优秀运动员运动表现的影响也可能是复杂的、多层次的。本文将从5个方面阐述与分析。
2.1 最大摄氧量下降
EIB是否对优秀运动员的最大摄氧量(V˙O2max)产生影响,目前学术界尚未达成共识。Freeman等(1990)发现,在标准实验条件下(20℃,60%RH),轻度EIB症状运动员仍会表现出较好的V˙O2max[(61.8±6.3)ml·kg-1·min-1]。Renata等(2012)指出,同等竞技水平的EIB与健康运动员的V˙O2max无显著性差异。然而,应当注意的是,这两个研究均在标准实验条件下完成,未能反映真实运动情境中运动员受到的来自周围环境因素的影响。
低温、空气干燥等是诱发EIB的主要环境因素,探讨EIB与V˙O2max的关系时应充分考虑这些因素的影响。Stensrud等(2006,2007)通过在实验室模拟干冷的运动环境,比较EIB运动员在不同条件下运动时V˙O2max的变化情况,发现在同等温度条件下,运动员在干燥(40%RH)与潮湿(95%RH)环境中运动时的V˙O2max分别为46.5 ml·kg-1·min-1与 48.6 ml·kg-1·min-1(P=0.001),第 1 秒用力呼气容积(forced expiratory volume in one second,FEV1)下降率分别为24%和12%;在同等湿度条件下,运动员在低温(-18 ℃)环境运动时的V˙O2max下降6.5%(P=0.004),FEV1下降31%,跑步峰值速度也显著性下降(P=0.02)。其认为,运动过程中,EIB不仅能导致V˙O2max下降,还会削弱机体的运动表现。Sonna等(2001)在对美国新兵训练的研究中发现,经过2个月的规律性、中高强度有氧训练,健康士兵的 V˙O2max显著提升[训练前(50.6±0.9)ml·kg-1·min-1,训练后(52.2±1.8)ml·kg-1·min-1;P<0.001],EIB 士兵的V˙O2max略有下降[训练前(53.5±3.2)ml·kg-1·min-1,训练后(52.2±1.8)ml·kg-1·min-1],认为 EIB可能是导致以上结果的主要原因。另外,β2-受体激动剂等EIB治疗药物能有效改善EIB运动员的V˙O2max,但对健康运动员无任何影响(Hafedh et al.,2019)。这一发现进一步佐证前述的研究推论。
2.2 呼吸道气流受限
EIB导致的气道狭窄或变形会引发阻塞性通气功能改变,造成呼吸道气流受限。其症状主要表现为以下两方面。
1)呼气流速下降(钟南山等,2018)。EIB发作时,FEV1及用力肺活量(forced vital capacity,FVC)等呼气流速指标显著下降。其中,FEV1下降率是公认的EIB阳性判定标准。EIB诱发的气道狭窄主要发生在运动后,运动中不会出现呼吸道气流受限(Teixeira et al.,2012)。然而,Moreira等(2011)发现,EIB优秀游泳运动员在运动时不仅痰液中的嗜酸性、中性粒细胞较运动前显著增加,而且出现不同程度的支气管扩张反应。该研究指出,在高通气量与氯化物的双重刺激下,运动会迅速诱发呼吸道炎症,并引发呼吸道气流受限。McCreanor等(2007)将招募的60名EIB受试者随机分为2组,让其分别在伦敦牛津街(PM2.5=28.3 μg/m³)与海德公园(PM2.5=11.9 μg/m³)健步走2 h,结果显示:2组受试者的FEV1值在运动中与运动后均显著下降;与公园组相比,街道组受试者的FEV1与FVC值分别多下降6.1%与5.4%。McCreanor等(2007)认为,运动过程中,EIB会引发呼吸道气流受限,非健康的运动环境可能会加剧这一趋势。
2)呼吸潮气流速容量环特征改变。EIB会引发最高呼气流量(peak expiratory flow,PEF)等指标的变化,而PEF是反映气道通畅性及呼吸肌力量的重要指标。Price等(2014a)发现,高强度运动时,健康运动员的PEF通常出现在呼气相中点,呼气末容积(end-expiratory lung volume,EELV)轻微下降(图2A);但是EIB运动员的PEF明显提前,呼气相降支向容量轴方向凹陷(图2B),凹陷愈明显,气流受限愈重,EELV值不降反升。另有研究指出,高强度运动时,EIB运动员的EELV会接近或超过功能残气量,严重扰乱呼吸道气流的流畅性和连续性(Haverkamp et al.,2005)。
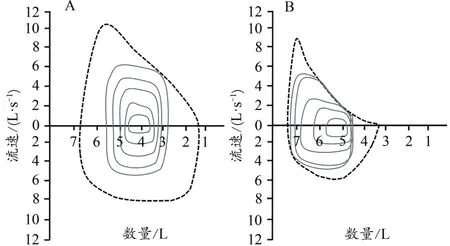
图2 呼吸潮气流速容量环Figure 2.Maximal Flow-Volume Loops during Incremental Maximal Exercise
2.3 呼吸肌耗氧量增加
呼吸肌耗氧量会随运动强度增加而增加。机体由安静状态转向运动状态时,呼吸肌与肌体耗氧量比值会由3%迅速增至5%~10%,部分优秀运动员在极限状态下可高达16%(Vella et al.,2006)。相比普通人,优秀运动员的肌体代谢需求更高,尤其是在超高强度运动时,机体的通气需求可能逼近或超过呼吸系统极限,引发呼吸道的应力性挤压以及肺、胸腔壁等组织弹性负荷的增加,进而导致呼吸肌耗氧量提升(Dominelli et al.,2017)。Harms等(1998)发现,优秀自行车运动员进行力竭运动实验时,即使腿部肌肉耗氧量已达峰值期,或处于下降阶段,肌体的总耗氧量仍在持续增加,主要用于满足呼吸肌增加的氧耗。当呼吸肌耗氧量达到机体极限时,机体开始疲劳。
Aaron等(2012)在模拟实验中发现,在呼吸道气流受限条件下运动时,健康受试者的呼吸肌与肌体耗氧量比值高达15%,远超正常气流条件下的比值(8%)。该研究指出,气流受限会增加呼吸肌额外做功负荷,可导致呼吸肌提前疲劳。Dempsey等(2006)指出,EIB引发的气流受限会增加呼吸肌做功负荷,可能引发两个后果:1)承受同等运动负荷时,呼吸肌耗氧量增加;2)易造成呼吸肌提前疲劳。基于上述研究,本文提出两个假设:1)通过药物治疗可缓解呼吸道气流受限症状,减少呼吸肌额外做功负荷,延缓呼吸肌疲劳;2)运动前、后或运动间歇进行高压吸氧干预可能延缓EIB运动员的呼吸肌疲劳,加速其运动后的机能恢复。由于目前鲜见相关研究,上述假设有待进一步验证。
2.4 呼吸困难与主观疲劳感产生
呼吸困难是一种呼吸不适的感觉,主观上表现为吸气不足、呼气费力,客观上表现为呼吸频率、深度和节律变化。呼吸困难是EIB的典型症状之一,80%~90%的EIB运动员在运动中或后有明显的呼吸困难症状(Weiler et al.,2016)。主观疲劳感是人体运动的重要调节器,能准确区分疲劳与努力信号,在保证人体正常运动的同时,避免超量负荷或过度运动。呼吸困难与主观疲劳感相互关联,共同参与人体运动的反馈与调节(Parshall et al.,2012)。
运动时,EIB引发的呼吸困难会使机体提前产生主观疲劳感,导致运动能力下降(Lougheed et al.,2006)。正常情况下,运动会引发肺通气量的适应性生理变化,满足机体的氧代谢需求。随着运动强度增加,机体氧代谢需求提升,位于肺、胸壁等组织的机械感受器会将缺氧信号传入中枢神经系统,由运动皮质将努力信号传递至呼吸肌,驱动其提升通气效果。运动皮质亦会将努力信号副本一并发送至感觉皮质,此过程称为伴随发送(corollary discharge)(Nishino et al.,2011)。若中枢系统接收的缺氧与运动皮质传出的努力信息相匹配,感觉系统则反馈合理或奋进信号,让运动皮质保持目前强度的信号传出水平;若接收与传出的信息不匹配,感觉系统则反馈胸闷或呼吸渴求信号(即呼吸困难),并引发主观疲劳感。随着传入与传出信息的匹配差异变大,主观疲劳感随之增强,达到极限值时,机体会发出刹车或降速信号,迫使机体停止运动或降低运动强度(Widdicombe et al.,2009)。对于EIB运动员,其肺通气量的适应性变化不仅要满足正常运动的氧代谢需求,还要克服呼吸道气流受限、气道壁弹性负荷增加等的影响,这会强化缺氧信息的输入(Turner et al.,2011)。在运动缺氧和吸气不足等多重因素的刺激下,输入与输出的信息平衡会被提前打破,导致主观疲劳感提早发生。因此,同等运动负荷条件下,EIB运动员可能提前发生运动疲劳(Price et al.,2014a)。
2.5 通气与血流比例失调
多数耐力性项目(如马拉松、越野滑雪等)优秀运动员在高强度运动时,会出现运动性诱发动脉血氧不足(exercise-induced arterial hypoxemia,EIAH)。与健康运动员相比,EIB优秀运动员会面临更高的EIAH风险(Bussotti et al.,2014)。Haverkamp等(2005)在对21名中度EIB症状受试者[V˙O2max:(48.2±7.0)ml·kg-1·min-1]的跑台力竭实验中发现:实验过程中,19人出现气道气流受限症状,其中8人表现出中等程度的EIAH(动脉血氧饱和度<94%)以及动脉血氧分压的显著性下降(运动前93.0 mmHg;运动后79.7 mmHg)。该研究认为,EIB引发的呼吸道气流受限会造成通气/血流比例失调,导致EIAH发生。Muñoz等(2008)发现,11名EIB运动员进行支气管激发测试后,每分通气量、心输出量及摄氧量分别增加123%、48%及54%,动脉血氧分压则下降14 mmHg,认为接受激发试验后,呼吸道气流受限引发的通气/血流比例失调是导致上述结果的主因。此外,EIB气道炎症的无规律分布,还会造成多级气道的非均匀式狭窄或变形,产生独特的EIB通气/血流模式,进一步加剧EIAH的发生风险。
总之,EIB优秀运动员高强度运动时,因气道狭窄或变形等引发的气流受限,会增加呼吸肌做功负荷、通气与血流比例失调等呼吸功能障碍,引发呼吸肌疲劳、肺通气效率下降、动脉血氧不足等问题。同时,在支气管痉挛及小气道关闭等因素刺激下,呼吸相关感觉系统被激活,主观疲劳感提前发生。上述因素的相互作用会影响机体骨骼肌的做功效率及输出功率,降低EIB运动员的运动表现 能力,使其直接或间接丧失赛场竞争优势(图3)。
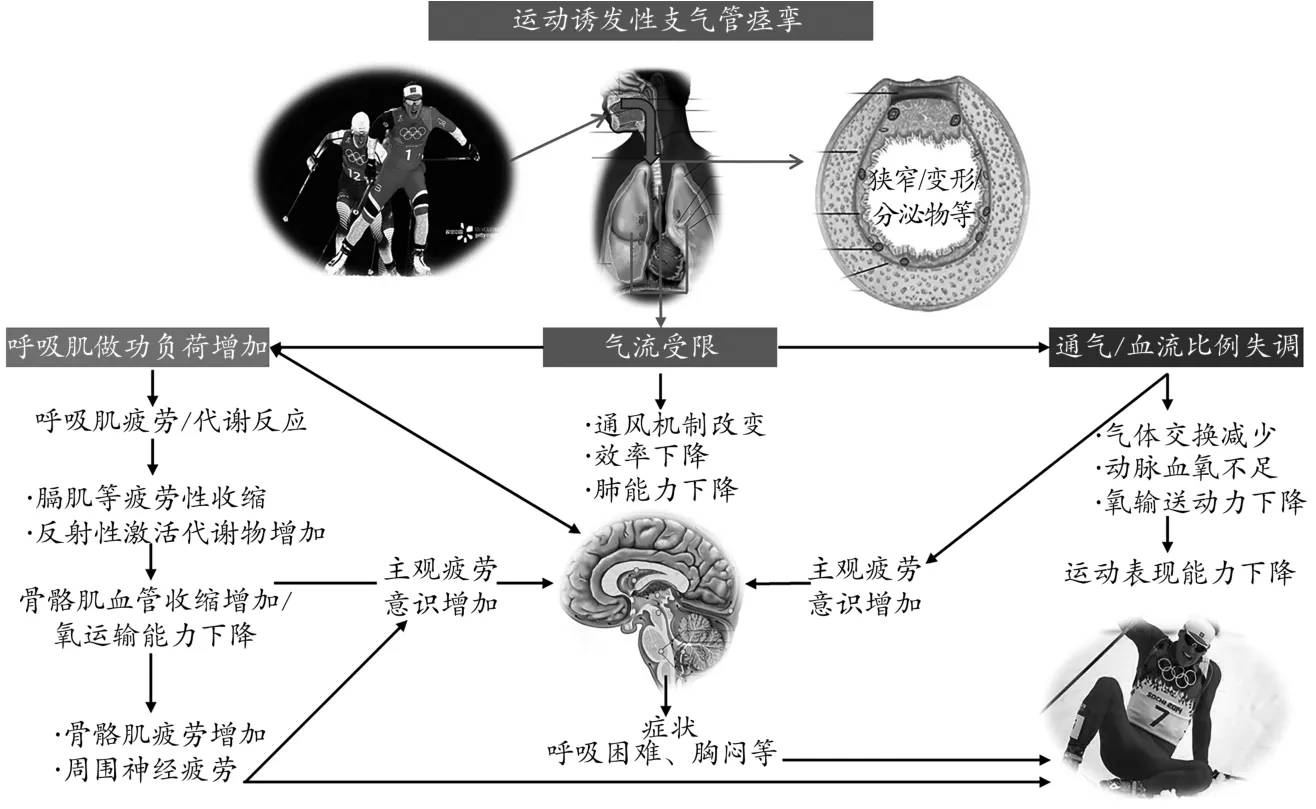
图3 EIB对运动表现影响的推理图Figure 3.The Mechanism of EIBAffecting Exercise Performance
3 优秀运动员EIB的诊治与预防
3.1 优秀运动员EIB的诊断
临床与实验室检查是EIB诊断的主要手段,呼吸病史或不适症状仅可作为辅助参考(Bonini et al.,2015b)。目前,EIB的诊断方法分为支气管激发和舒张试验两大类,共计10余种,其中,IOC-MC与WADA官方认定的诊断方法有6种(表2)。由于不同诊断方法的激发与舒张方式、测试流程及设备等差异较大,诊断标准也不同。
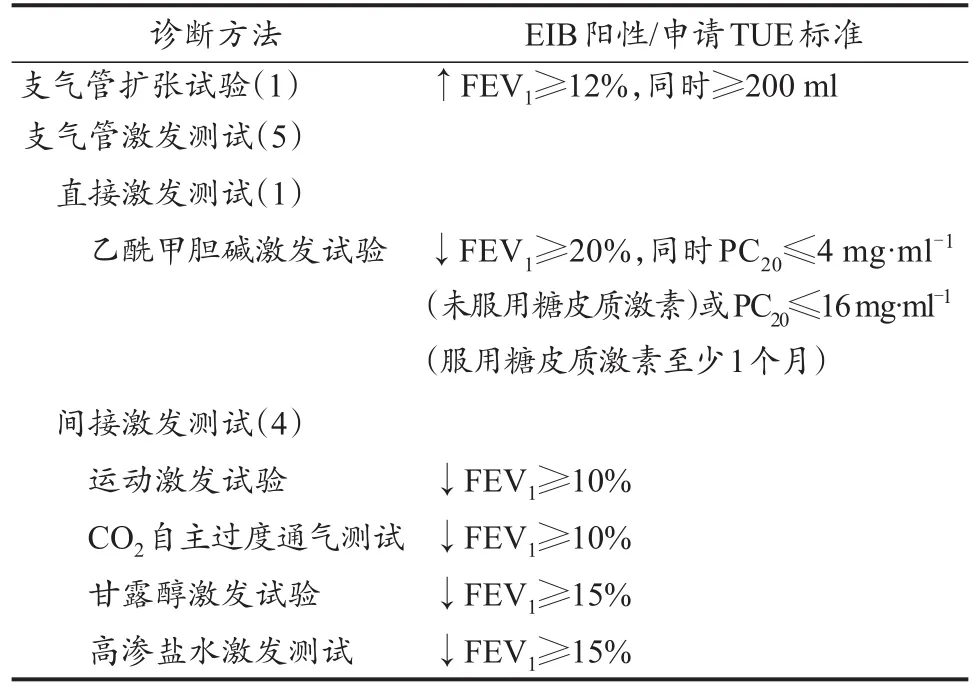
表2 IOC-MC认定的EIB诊断方法、阳性判定与TUE(EIB)申请标准Table 2 International Olympic Committee Criteria for the Diagnosis of Exercise-Induced Bronchoconstriction and Permission toApply Therapeutic Use Exemption
运动激发试验(exercise challenge test,ECT)是目前应用广泛、运动员接受度高的EIB诊断方法。它具有安全无创、操作简便等优点,易于在一线运动队推广使用。ECT包括场地运动激发试验(field test,FT)与实验室运动激发试验(laboratory exercise test,LT)。FT通常采用运动专项训练作为激发手段(如游泳、速滑等),LT则通常采用跑台或功率自行车测试作为激发手段。试验时,两种方法均要求运动员以80%MHR强度持续运动6~8 min,然后测量运动后第1、3、5、10和15 min的FEV1,若FEV1下降率≥10%,为EIB阳性。也有研究以FEV1下降率≥13%或15%为阳性标准(Rundell et al.,2004)。ECT敏感度中等,优秀运动员尤其是体能类项目运动员测试时易因刺激强度不足导致EIB阳性漏检或假阴性。Haahtela等(2008)发现,2名芬兰世界级游泳运动员曾因ECT测试漏检而错失奥运金牌。有学者指出,赛后即刻(如越野滑雪、马拉松赛等)进行ECT测试具有更高的诊断准确度(Chimenti et al.,2010)。ECT测试时,采用90%MHR或以上强度可显著提高诊断敏感度,但风险较高,使用者较少。
CO2自主过度通气(eucapnic voluntary hyperpnea,EVH)、乙酰甲胆碱激发等也是常用的EIB诊断方法。由于特异性好,敏感度高,EVH被IOC-MC视为EIB诊断的“金标准”,其诊断报告是申请TUE(EIB)的医学依据(Hull et al.,2016)。Holzer等(2002)对42名EIB疑似症状运动员分别采用乙酰甲胆碱激发和EVH试验法进行诊断,结果显示,两种方法的EIB阳性率分别为21.1%和59.5%,其中,乙酰甲胆碱激发试验诊出的9例阳性在EVH试验时再次被诊断为EIB阳性。Castricum等(2010)对33名优秀游泳运动员分别采用FT、LT及EVH试验法进行EIB诊断,结果显示:3种方法分别确诊1例、4例和18例EIB阳性运动员,FT试验的全部阳性运动员(1例)和LT试验的75%阳性运动员(3例)在EVH试验中亦被诊断为EIB阳性。上述研究充分证明EVH具有较高的敏感性与准确性。但是,EVH操作复杂,设施昂贵,在运动队中的推广难度较大。此外,甘露醇、高渗盐水激发试验也是被IOCMC认可的EIB诊断方法,但其容易诱发咳嗽、呼吸不适等症状,在运动队中使用率较低。
3.2 优秀运动员EIB的治疗
3.2.1 药物治疗
药物治疗是目前应对EIB的主要手段(Fitch,2019)(表3)。β2-受体激动剂是治疗EIB的常用药物,可直接舒张支气管平滑肌,缓解支气管痉挛症状。根据药效持续时间,β2-受体激动剂分为两种——短效与长效。短效β2-受体激动剂是治疗急性EIB的首选药物,起效快,反应敏感度高,药效可维持2~4 h(Fitch,2006),运动前15 min使用会起到良好的预防效果,其代表药物有沙丁胺醇、特布他林等。长效β2-受体激动剂的药效持续时间长,具备良好的支气管平滑肌舒张与抗炎效果,重症EIB运动员可长期服用,其代表药物有沙美特罗、福莫特罗等。根据禁用物质清单,上述4种药物均属于赛内与赛外禁用或限用药物。若运动员因病需要使用此类药物,必须凭WADA认可的EIB诊断证明申请TUE,否则视为兴奋剂违规。糖皮质激素也是常见的EIB治疗药物,具有较好的抗炎、抗过敏及抑制免疫反应效果,但副作用较大,若使用不当或长期大量使用,机体容易产生许多不良反应及并发症,严重时会危及生命。因此,运动员使用该药物时应当严格遵照医嘱。而且,糖皮质激素属于赛内禁用物质。EIB治疗药物还包括白三烯调节剂、抗胆碱药物等,但其TUE获准率及治疗效果等均不及β2-受体激动剂与糖皮质激素(Allen et al.,2019)。

表3 EIB治疗主要药物与2020禁用清单——使用状态及对运动能力的影响Table 3 EIB Medications and the Prohibited List(2020)—Status and Impact on Sport Performance
TUE和运动表现的关系,目前尚未明确(Hayden et al.,2019)。Babette等(2011)对26篇有关EIB药物与运动表现关系的研究进行荟萃分析,发现42%的研究认为EIB药物能直接或间接提升运动表现,其余研究则认为两者无相关性。Hostrup等(2018)发现,运动前30 min吸入高剂量特布他林(15 mg)能显著增加运动员的最大收缩肌力[(681±68)N vs.(738±64)N],提升Wingate测试输出功率。Hostrup等(2020)也发现,补充β2-受体激动剂治疗可改善多项人体机能,如促进人体蛋白合成代谢、增加肌肉量等。上述研究均认为使用EIB药物可能有助于提升运动表现。也有学者持不同观点。Koch等(2015b)指出,虽然运动前30 min吸入沙丁胺醇(1 600 μg)能显著增加自行车运动员的FEV1(6.4%)和每分通气量(4.9%),但没有对其10 km竞速成绩产生积极影响。Molphy等(2018)也发现,运动前20 min补充特布他林并不能直接提升运动员3 km跑成绩。可见,研究虽已证实EIB药物会直接或间接地改善部分人体生理机能,但是否对运动表现产生积极影响尚需进一步探讨。
3.2.2 非药物治疗
非药物治疗是改善EIB的重要补充手段,通过调整饮食结构、补充营养剂等可有效降低EIB发病风险。Mickleborough等(2006)发现,增加鱼油饮食可改善EIB受试者的心肺功能,减少支气管平滑肌痉挛,显著降低诱导痰细胞数量及LTC4等炎症细胞因子浓度。Dickinson等(2018)指出,合理补充锌铁微量元素,适量食用可乐饮料或巧克力制品,也能缓解EIB的产生。Vanhaitsma等(2010)发现,预先补充咖啡因(9 mg/kg)可有效减缓EIB运动员运动后的FEV1下降率(运动前:14.3%;运动后:9.0%)。研究还发现,补充咖啡因与服用短效β2-受体激动剂对EIB的治疗效果无统计学差异,FEV1下降率分别为6.8%和4.0%。Liu等(2017)发现,橘皮素可有效抑制呼吸道炎症产生,降低速发性变态反应风险,或可用于治疗EIB。考虑到橘皮素源自柑橘,具有口服吸收好、无兴奋剂违禁物质等优点,其非常适宜运动员群体,具有巨大潜力。
3.3 优秀运动员EIB的预防
3.3.1 运动环境改善
极端天气或非健康的运动环境是EIB发生的重要因素。因此,减少极端天气暴露和改善运动环境空气质量是EIB预防的关键。对于室外项目,合理增加空气的温度和湿度能有效降低EIB发病率。Bolger等(2011)发现,优秀运动员在干冷(4℃,2.5 mg H2O/L)与温湿(25℃,21.5 mg H2O/L)条件下对运动激发试验的反应差别较大,运动后的FEV1下降率分别为18.1%和1.7%,CC16依次为1.91 ng/μmol和 0.35 ng/μmol。Kennedy等(2019)指出,若运动时吸入空气的湿度与气道湿度(99%RH)相似,EIB发病风险大幅降低。对于泳池项目,严格控制泳池消毒剂含量,制定并推广符合精英运动员项目特征的消毒标准,是遏制泳池项目EIB高发的根本措施。Drobnic等(1996)发现,优秀游泳运动员在WHO氯标准的泳池(氯含量≤3 mg/L)中高强度运动2 h,吸入的氯基化合物为6~8 g,约为普通人的4倍。提示,优秀运动员需要执行更严格的氯标准。2013年,英国奥组委将泳池氯标准更改为0.5~1.0 mg/L,但具体效果尚未见报道。另外,提升室内排风效率,降低空气(尤其是池水表面空气)中氯基化合物的浓度(Kotsiou et al.,2019),以及加快池水更换频率,合理安排水陆训练时间(宋小波等,2017)等,都能有效预防泳池项目运动员发生EIB。此外,运动场馆选址远离交通枢纽及工业园区等;减少汽车尾气或工业污染影响(Rundell et al.,2006);现有运动场馆加盖防霾设施,强化场馆内的除霾、尘、螨、味等措施,减少刺激性EIB发生;科学设置竞赛日程,避免季节性花粉或豚草过敏等,都是预防EIB发生的有效措施。
3.3.2 自我防护措施
除了改善运动环境外,采用适应性热身或防护面罩(heat and moisture exchange mask,HME)等自我防护措施也能有效预防EIB的产生。热身运动会刺激肥大细胞脱颗粒、儿茶酚胺的分泌及前列腺素E2的增加,使机体产生短暂的EIB不应期(持续1~2 h)。目前,预防EIB的热身运动方式有4种:高强度间歇运动、高强度持续性运动、低强度持续性运动和非固定强度运动。其中,低强度持续性运动(60%MHR,30 min)效果最佳,能削弱12.6%的EIB反应(Elkins et al.,2013)。HME是一种置有发热介质的软质头套,会在面罩腔室内将吸入的干冷气体进行加热、加湿处理,使吸入气体接近或达到肺部的气体交换标准,减少气道水分蒸发和热量丢失。Beuther等(2006)招募了13名EIB受试者分别佩戴HME和裸面在低温环境中(-15℃)进行运动激发试验,发现FEV1下降率分别为4.3%±1.6%和19.0%±4.9%。Seifert等(2017)采用35 KJ定额输出功率测试法,比较受试者在3种实验条件下(-9℃,佩戴HME;-9℃,裸面;22℃,裸面)完成定额功率的时间,发现佩戴HME用时最短[(133.8±8.6)s],其次为常温裸面[(134.9±8.8)s],低温裸面用时最长[(138.0±8.4)s]。
可见,EIB的诊治预防直接关系到优秀运动员的备战参赛及生命健康。在严格遵照权威机构指导意见的基础上,正确选择EIB诊断方法与治疗手段,改善运动环境,强化自我防护措施,可有效缓解EIB症状,减少EIB产生。
4 总结与展望
优秀运动员EIB研究是一项复杂的系统工程,涉及运动、环境、生理、病理及兴奋剂管理等多方面因素,是IMCOC及全球运动医学界现在和未来研究关注的重点。目前,关于优秀运动员EIB的研究主要集中在发病机制特征与诊治预防上,鲜见对EIB与运动表现关系的研究,尚有许多问题亟待解决。如何准确评估运动状态(强度、时间等)及环境因素与EIB发病的相关性;如何科学量化EIB对运动表现的影响;运动停止后,如何精准确定EIB症状的消除周期及复发性等,这都需要进一步探讨与研究。与国际相关研究相比,国内优秀运动员的EIB研究成果鲜见报道,尚存在大量研究空白,如国内优秀运动员(尤其是冬季、游泳等高危项目)的EIB发病率调查、国内优秀运动员的EIB诊治预防、重大赛事期间EIB的反兴奋剂管理及TUE申请等,都需要国内学者给予重点关注与及早研究。

