米炒北沙参的质量标准研究
王新娣 石晓峰 张晓萍 刘东彦 沈薇 范彬 马趣环



中圖分类号 R917;R284.1 文献标志码 A 文章编号 1001-0408(2022)08-0962-06
DOI 10.6039/j.issn.1001-0408.2022.08.10
摘 要 目的 建立米炒北沙参的质量标准。方法 取米炒北沙参饮片样品,进行外观性状观察、粉末显微鉴别、薄层色谱(TLC)鉴别,按2020年版《中国药典》(四部)通则方法检测其中水分、总灰分、酸不溶性灰分、水溶性浸出物及酸溶性浸出物的含量,采用高效液相色谱(HPLC)法测定其中补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素的含量。结果 米炒北沙参饮片为类圆形小段,略粗糙,表面呈黄色(去皮)或深黄棕色(有皮),气特异,味微甘。其粉末呈黄白色,显微镜下可见分泌物和分泌细胞、导管、糊化淀粉粒、射线细胞、薄壁细胞等。TLC图斑点清晰,供试品色谱中,在与异欧前胡素对照品色谱相应的位置上,显相同的蓝色荧光斑点。9批米炒北沙参饮片的水分含量为5.82%~6.27%,总灰分含量为3.19%~3.59%,酸不溶性灰分含量为0.21%~0.27%,水溶性浸出物含量为24.91%~30.30%,醇溶性浸出物含量为20.66%~25.83%。补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素检测质量浓度的线性范围分别为0.240~2.400、0.320~3.200、0.224~2.240、0.292~2.920、0.208~2.080 μg/mL(r均大于0.999 0);定量限分别为0.032 0、0.030 0、0325 0、0.032 0、0.045 0 µg,检测限分别为0.100 8、0.089 6、0.071 5、0.090 0、0.132 0 µg;精密度、稳定性(24 h)、重复性试验的RSD均小于3%;平均加样回收率分别为100.56%(RSD=1.36%,n=6)、100.73%(RSD=2.25%,n=6)、100.36%(RSD=0.98%,n=6)、98.24%(RSD=0.40%,n=6)、99.40%(RSD=0.35%,n=6)。上述5个成分的含量分别为5.85~13.31、8.63~33.38、6.23~15.25、6.12~12.98、5.52~10.77 µg/g,总含量为34.20~83.41 µg/g。结论 初步拟定米炒北沙参饮片中水分、总灰分、酸不溶性灰分分别不得过7.30%、4.10%、0.30%,水溶性浸出物和醇溶性浸出物分别不得少于21.00%、18.00%,香豆素类成分的总含量分别不得少于52.03 μg/g(有皮)、26.34 μg/g(去皮)。所建质量标准可用于米炒北沙参的质量控制。
关键词 米炒北沙参;质量标准;显微鉴别;薄层色谱;高效液相色谱法;含量测定
Study on quality standard for rice-fired Glehnia littoralis
WANG Xindi1,SHI Xiaofeng1,ZHANG Xiaoping2,LIU Dongyan1,SHEN Wei1,FAN Bin1,MA Quhuan1(1. Gansu Academy of Medical Science, Lanzhou 730050, China; 2. Lanzhou Institutes for Food and Drug Control, Lanzhou 730030, China)
ABSTRACT OBJECTIVE To establish a quality standard for rice-fired Glehnia littoralis. METHODS Appearance observation, powder microscopic identification and thin-layer chromatography (TLC) identification were performed for the samples of rice-fired G. littoralis decoction piece. According to the relevant methods stated in 2020 edition of Chinese Pharmacopoeia(part Ⅳ), the contents of moisture, total ash, acid-insoluble ash, water-soluble extract and acid-soluble extract were determined. The contents of psoralen, zanthoxylin, bergapten, imperatorin and isoimperatorin were determined by high performance liquid chromatography (HPLC). RESULTS The rice-fired G. littoralis decoction pieces were round-like small segments, slightly rough, yellow (peeled) or dark yellowish brown (with peel), special gas and slightly sweet taste. The powder was yellowish white. Under the microscope, secretions and secretory cells, ducts, gelatinized starch granules, ray cells, parenchyma cells, etc. could be seen. TLC showed the spots developed clearly. In the chromatogram of the test sample, there was the same blue fluorescent spot at the corresponding position of the chromatogram of isoimperatorin control sample. The moisture, total ash, acid-insoluble ash, water-soluble extract and ethanol-soluble extract from 9 batches of samples were 5.82%-6.27%, 3.19%-3.59%, 0.21%-0.27%, 24.91%-30.30% and 20.66%-25.83%, respectively. The linear range of psoralen, zanthotoxin, bergapten, imperatorin and isoimperatorin were 0.240-2.400, 0.320-3.200, 0.224-2.240, 0.292-2.920, 0.208-2.080 µg/mL (all r>0.999 0). Limits of quantitation were 0.032 0, 0.030 0, 0325 0, 0.032 0, 0.045 0 µg, respectively. Limits of detection were 0.100 8, 0.089 6, 0.071 5, 0.090 0, 0.132 0 µg, respectively. RSDs of prescision, stability (24 h) and reprodu- cibility tests were less than 3%. Average recoveries were 100.56%(RSD=1.36%,n=6), 100.73%(RSD=2.25%,n=6), 100.36%(RSD=0.98%,n=6), 98.24%(RSD=0.40%,n=6)and 99.40%(RSD=0.35%,n=6), respectively. The contents of above five components were 5.85-13.31, 8.63-33.38, 6.23- 15.25, 6.12-12.98, 5.52-10.77 µg/g, respectively. The total contents were 34.20-83.47 µg/g. CONCLUSIONS It is preliminarily proposed that the moisture, total ash and acid-insoluble ash should not exceed 7.30%, 4.10%, 0.30%. The water-soluble extract and ethanol-soluble extract are no less than 21.00% and 18.00%, respectively. The total content of coumarin should not be less than 52.03 µg/g (with peel) and 26.34 μg/g (peeled). Established quality standard can be used for the quality control of rice-fired G. littoralis.
KEYWORDS rice-fired Glehnia littoralis; quality standard; microscopic identification; TLC; HPLC; content determination
北沙参为伞形科植物珊瑚菜Glehnia littoralis Fr. Schmidt ex Miq.的干燥根,异名海沙参、莱阳参、辽沙参、银条参、野香菜根,具有养阴清肺、益胃生津的功效[1]。北沙参始载于《神农本草经》,列为上品,现收载于2020年版《中国药典》(一部),是我国常用传统中药,可用于治疗肺热燥热、劳嗽痰血、热病津伤、咽干口渴等症[2],主产于我国江苏、辽宁、山东、河北等地。现代药理研究表明,北沙参具有镇痛、降压、平喘、抗病毒、抗炎、抗菌、抗心律失常、抗肿瘤等作用[3]。该药主要含有香豆素类、聚炔类、萜类、黄酮类、糖苷类、挥发油类等化学成分[4-8],其中补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素等香豆素类成分是北沙参的主要药效成分[6]。
文献记载,北沙参的炮制方法主要有切制、蜜炙、米炒、炒黄等,而临床上常用的炮制品主要是由生品切段所得。大米性甘、味平,具有调理脾胃、补中益气、止渴、止泻痢等作用,北沙参经大米炒制后,可增强其补脾益胃之功,偏于和胃止泻[9]。米炒北沙参记载于《中药炮炙经验集成》[10]。笔者查阅文献发现,虽然有部分省市的炮制规范记载了米炒北沙参,但相对简单且不够全面,如2009年版《甘肃省中药炮制规范》收载的米炒北沙参仅有性状描述、水分和总灰分检查项[11]。此外,虽已有研究报道了北沙参药材中香豆素类成分的提取及含量测定[12-17],但尚未见米炒北沙参质量标准研究的相关报道,因此有必要对该炮制品的质量標准进行完善,以全面控制其质量。基于此,本研究采用显微镜和薄层色谱(thin-layer chromatography,TLC)法对米炒北沙参进行定性研究,按2020年版《中国药典》(四部)要求[18]对其水分、总灰分、酸不溶性灰分及浸出物等进行定量研究,同时采用高效液相色谱(high performance liquid chromatography,HPLC)法测定其中补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素的含量,旨在为完善米炒北沙参的质量标准提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有1220型HPLC仪(日本Shimadzu公司)、BX53+DP73型正置显微镜(日本Olympus公司)、Linomat型薄层半自动(点样)成像系统[瑞士卡玛(中国)技术支持中心]、ML1612型马弗炉(天津拓至明实验仪器技术开发有限公司)、AE260型万分之一电子天平[梅特勒-托利多仪器(上海)有限公司]、SK3310LHC型超声波清洗器(上海科导超声仪器公司)等。
1.2 主要药品与试剂
补骨脂素对照品(批号110739-201918,纯度99.7%)、欧前胡素对照品(批号110826-201918,纯度99.8%)、异欧前胡素对照品(批号110827-202113,纯度99.6%)均购自中国食品药品检定研究院;佛手柑内酯对照品(批号MUST-19063003,纯度>98%)、花椒毒素对照品(批号MUST-19110108,纯度>98%)均购自成都曼思特生物科技有限公司;硅胶GF254薄层板(批号20190225)购自青岛鼎康硅胶有限公司;乙腈为色谱纯,其余试剂均为分析纯,水为超纯水。
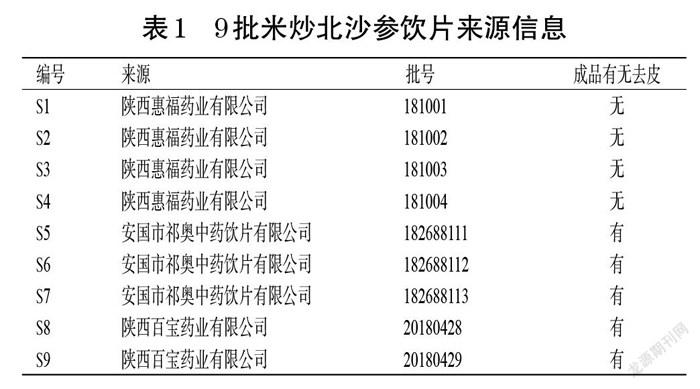
9批米炒北沙参饮片于2019年12月由甘肃省食品药品研究院统一购自陕西惠福药业有限公司、安国市祁奥中药饮片有限公司、陕西百宝药业有限公司,经甘肃省食品药品研究院马潇主任中药师鉴定为伞形科植物珊瑚菜G. littoralis Fr. Schmidt ex Miq.干燥根的炮制品。9批米炒北沙参饮片来源信息见表1。
2 方法与结果
2.1 外观性状
米炒北沙参饮片为类圆形小段,微具焦斑,略粗糙,表面呈黄色(去皮)或深黄棕色(有皮);具细纵皱纹及纵沟,并有棕黄色点状支根痕;切断面皮部浅黄色,木部黄色,略呈角质样;质脆,易折断;气特异,味微甘。米炒北沙参饮片的外观性状见图1。
2.2 鉴别
2.2.1 粉末显微鉴别 取米炒北沙参饮片,粉碎,粉末过四号筛,取适量,置于显微镜下观察。本品粉末呈黄白色;分泌道常破碎,含黄棕色分泌物,有的可见条状金黄色分泌物,直径约69 µm;导管众多,可见网纹导管和螺纹导管散在或成群存在,主要为网纹导管,壁厚,网孔长而宽,直径为16~88 µm;糊化淀粉粒细胞极多,呈不规则块状;木栓细胞表面观呈类方形或类长方形,垂周壁平直或略弯曲;射线细胞呈类长方形,与薄壁细胞垂直,高4~6列细胞,宽1~2列细胞。米炒北沙参饮片的粉末特征见图2。
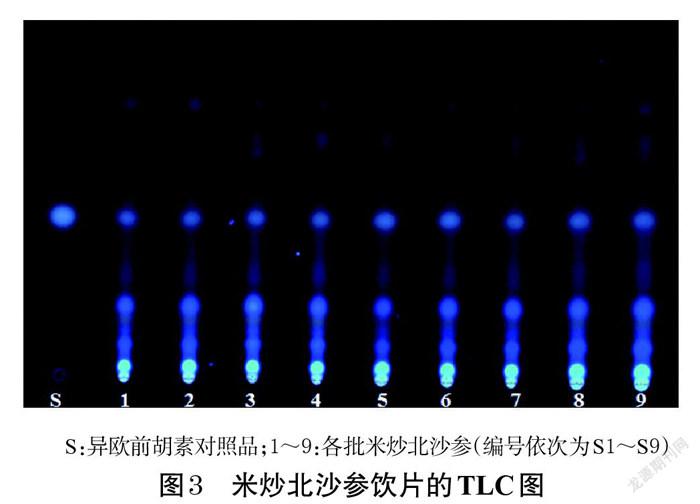
2.2.2 TLC鉴别 取9批米炒北沙参饮片粉末10.0 g,分别加70%甲醇100 mL,加热回流1 h,滤过,滤液蒸干,残渣加水20 mL复溶,用乙酸乙酯振摇萃取2次,每次50 mL,合并乙酸乙酯萃取液,蒸干,残渣加甲醇1 mL复溶,作为供试品溶液。另取异欧前胡素对照品适量,加甲醇制成质量浓度为1 mg/mL的对照品溶液。按照2020年版《中国药典》(四部)通则“0502薄层色谱法”操作[18],吸取上述供试品溶液、对照品溶液各5 µL,分别点于同一硅胶GF254薄层板上,以石油醚(60~90 ℃)-乙酸乙酯(4 ∶ 1,V/V)为展开剂,展开,取出,晾干,置于紫外灯(356 nm)下检视。结果显示,供试品色谱中,在与对照品色谱相应的位置上,显相同的蓝色荧光斑点。结果见图3。
2.3 水分
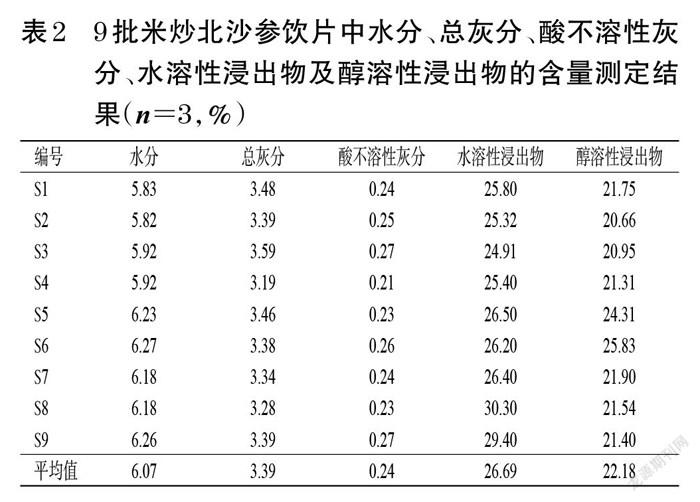
取9批米炒北沙参饮片粉末,按2020年版《中国药典》(四部)通则“0832水分测定”项下“第二法(烘干法)”测定水分[18],每样品平行测定3次。结果显示,9批米炒北沙参饮片的水分含量为5.82%~6.27%,平均含量为6.07%。将水分含量的平均值上浮20%,作为水分限度标准,即暂定水分不得过7.30%。结果见表2。
2.4 总灰分
取9批米炒北沙参饮片粉末,按2020年版《中国药典》(四部)通则“2302总灰分测定法”测定总灰分[18],每样品平行测定3次。结果显示,9批米炒北沙参饮片的总灰分含量为3.19%~3.59%,平均含量为3.39%。由于各批样品总灰分含量差异较小,故将总灰分含量的平均值上浮20%,作为总灰分限度标准,即暂定总灰分不得过4.10%。结果见表2。
2.5 酸不溶性灰分
取9批米炒北沙参饮片粉末,按2020年版《中国药典》(四部)通则“2302酸不溶性灰分测定法”测定酸不溶性灰分[18],每样品平行测定3次。结果显示,9批米炒北沙参饮片的酸不溶性灰分含量为0.21%~0.27%,平均含量为0.24%。由于各批样品中酸不溶性灰分含量较稳定,故将酸不溶性灰分含量的平均值上浮20%,作为酸不溶性灰分限度标准,即暂定酸不溶性灰分不得过0.30%。结果见表2。
2.6 浸出物
取9批米炒北沙参饮片粉末,按2020年版《中国药典》(四部)通则“2201浸出物测定法”项下“冷浸法”,以水为溶剂测定水溶性浸出物含量[18],每样品平行测定3次。结果显示,9批米炒北沙参饮片的水溶性浸出物含量为24.91%~30.30%,平均含量为26.69%。将水溶性浸出物含量的平均值下浮20%,作为水溶性浸出物限度标准,即暂定水溶性浸出物不得少于21.00%。结果见表2。
取9批米炒北沙参饮片粉末,按2020年版《中国药典》(四部)通则“2201浸出物测定法”项下“热浸法”,以50%乙醇为溶剂测定醇溶性浸出物含量[18],每样品平行测定3次。结果显示,9批米炒北沙参饮片的醇溶性浸出物含量为20.66%~25.83%,平均含量为22.18%。將醇溶性浸出物含量的平均值下浮20%,作为醇溶性浸出物限度标准,即暂定醇溶性浸出物不得少于18.00%。结果见表2。
2.7 含量测定
2.7.1 色谱条件 以Eelipse Plus C18(250 mm×4.6 mm,5 µm)为色谱柱,以水(A)-乙腈(B)为流动相进行梯度洗脱(0~15 min,24%B→42%B,15~19 min,42%B;19~25 min,42%B→65%B;25~35 min,65%B→62%B;35~40 min,62%B→75%B);检测波长为302 nm;柱温为25 ℃;进样量为20 μL。
2.7.2 混合对照品溶液的制备 取补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素对照品适量,精密称定,置于10 mL量瓶中,分别加甲醇溶解并稀释至刻度,摇匀,制得上述5个成分质量浓度分别为0.012 0、0.016 0、0.011 2、0.014 6、0.010 4 mg/mL的混合对照品溶液。
2.7.3 供试品溶液的制备 精密称取米炒北沙参饮片粉末(过四号筛,下同)2.0 g,置于50 mL具塞锥形瓶中,加入75%甲醇30 mL,称定质量,超声(功率160 W,频率59 kHz)处理50 min,取出,冷却至室温,再次称定质量,用75%甲醇补足减失的质量,以3 000 r/min离心10 min,取上清液,即得供试品溶液。
2.7.4 空白溶液 以75%甲醇为空白溶液。
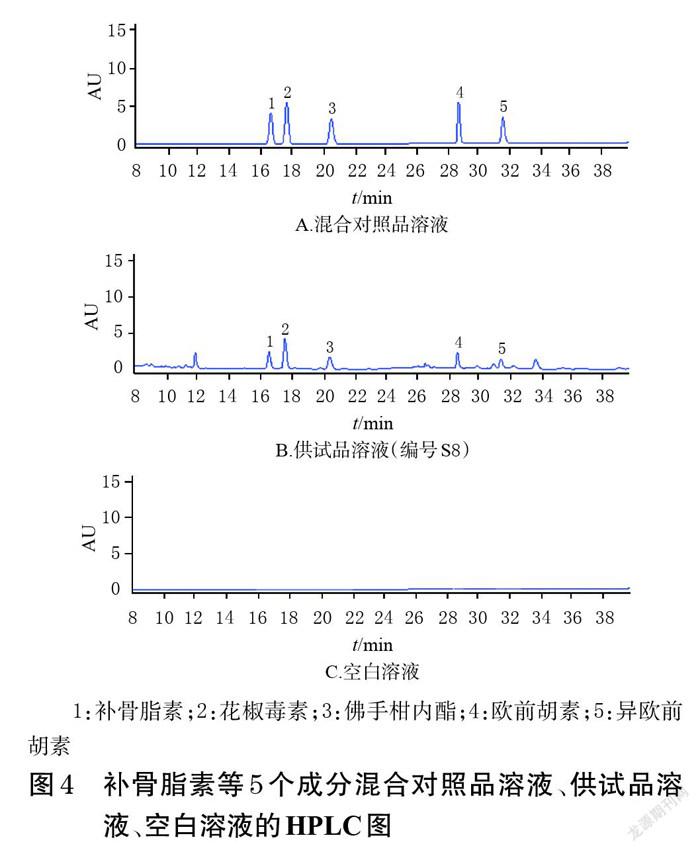
2.7.5 系统适用性试验 取上述混合对照品溶液、供试品溶液、空白溶液适量,按“2.7.1”项下色谱条件进样测定,记录色谱图,详见图4。由图4可知,理论板数按花椒毒素计不低于4 000,各待测成分均基线分离,各色谱峰与相邻色谱峰的分离度均大于1.2,空白溶液对测定无干扰。
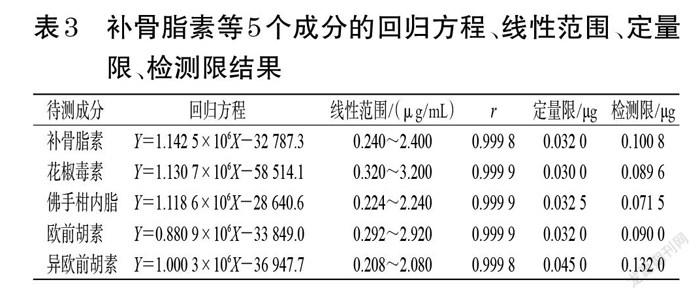
2.7.6 线性关系考察 精密吸取“2.7.2”项下混合对照品溶液100、200、300、400、500、750、1 000 μL,置于5 mL量瓶中,加甲醇稀释至刻度,摇匀,制得相应质量浓度的系列线性工作溶液,按“2.7.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(X)为横坐标、峰面积(Y)为纵坐标进行线性回归,结果见表3。
2.7.7 定量限与检测限考察 精密吸取“2.7.2”项下混合对照品溶液适量,用甲醇倍比稀释,按“2.7.1”项下色谱条件进样测定,以信噪比10 ∶ 1、3 ∶ 1分别计算定量限和检测限,结果见表3。
2.7.8 精密度试验 取“2.7.2”项下混合对照品溶液,用甲醇稀释10倍,按“2.7.1”项下色谱条件连续进样测定6次,记录峰面积。结果显示,补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素峰面积的RSD分别为0.59%、0.87%、0.90%、0.80%、0.96%(n=6),表明仪器精密度良好。
2.7.9 稳定性试验 取“2.7.3”项下供试品溶液(编号S8),分别于室温下放置0、2、4、6、8、10、24 h时按“2.7.1”项下色谱条件进样测定,记录峰面积。结果显示,补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素峰面积的RSD分别为1.32%、1.41%、1.59%、2.24%、2.19%(n=7),表明供试品溶液于室温下放置24 h内稳定性良好。
2.7.10 重复性试验 取米炒北沙参饮片(编号S8)粉末适量,共6份,按“2.7.3”项下方法制备供试品溶液,再按“2.7.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。结果显示,补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素的平均含量分别为7.70、13.62、7.74、7.00、5.57 μg/g,RSD分别2.30%、0.86%、1.70%、2.00%、1.98%(n=6),表明方法重复性良好。
2.7.11 加样回收率试验 精密称取已知含量的米炒北沙参饮片(编号S8)粉末,每份约1.0 g,共6份,分别精密加入补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素对照品溶液(相应对照品溶液按“2.7.1”项下方法配制)适量,按“2.7.3”项下方法制备供试品溶液,再按“2.7.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表4。
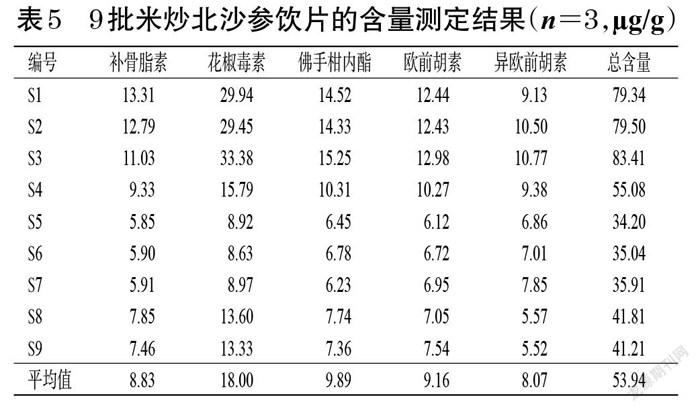
2.7.12 样品含量测定 取9批米炒北沙参饮片粉末各2.0 g,精密称定,按“2.7.3”项下方法制备供试品溶液,再按“2.7.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。每样品平行测定3次,结果见表5。
3 讨论
3.1 TLC条件的选择
3.1.1 对照品 本课题组前期研究结果显示,欧前胡素、补骨脂素、花椒毒素、佛手柑内酯的荧光斑点不清晰,在增加点样量后发现,样品的斑点分离度差,但异欧前胡素的TLC斑点清晰,分离度较好,且样品在异欧前胡素对照品位置处显相同的蓝色荧光斑点,故选择异欧前胡素为对照品进行TLC鉴别。
3.1.2 展开剂 本课题组前期考察了石油醚、乙酸乙酯、乙醚、乙醇、甲醇、90%甲醇、70%甲醇、50%甲醇等不同提取溶劑对TLC分离的影响,结果显示,以70%甲醇为提取溶剂时,TLC斑点清晰,各成分分离度良好,故选择70%甲醇为提取溶剂。同时,本课题组还对石油醚(60~90 ℃)-乙酸乙酯-甲醇、石油醚(60~90 ℃)-丙酮、三氯甲烷-甲醇、石油醚(60~90 ℃)-乙酸乙酯等不同展开系统进行了比较,结果显示,以石油醚(60~90 ℃)-乙酸乙酯(4 ∶ 1,V/V)为展开剂时,荧光斑点清晰,主斑点的比移值较适宜,且该方法在不同相对湿度和温度条件下的耐用性良好,故选择石油醚(60~90 ℃)-乙酸乙酯(4 ∶ 1,V/V)为展开剂。
3.2 浸出物测定条件的选择
本课题组前期分别采用冷浸法和热浸法测定水溶性浸出物含量,结果显示,由于米炒北沙参的含糖量可能较高,使得热浸法所得溶液较为黏稠,难以滤过,故选择冷浸法测定水溶性浸出物的含量。同时,本课题组根据已有文献[19]和2020年版《中国药典》(四部)[18],分别以无水乙醇和90%、80%、70%、60%、50%乙醇为溶剂,以浸膏率为指标,考察了乙醇体积分数对醇溶性浸出物提取的影响,结果显示,当以50%乙醇为溶剂时,所得提取物的浸膏率较高,故选择50%乙醇为醇溶性浸出物的溶剂。
3.3 含量测定色谱条件的选择
本课题组前期考察了甲醇-水、甲醇-水(含0.1%磷酸)、乙腈-水等流动相系统对待测成分色谱分离的影响。结果显示,当以乙腈-水为流动相时,5个成分均能实现基线分离。同时,本课题组对5个成分进行了全波长扫描(190~400 nm),结果显示,5个成分的吸收主要集中在200~360 nm,且在302 nm波长处无干扰,有较大吸收,故选择检测波长为302 nm。
3.4 含量测定供试品溶液提取条件的选择
本课题组前期考察了不同提取溶剂(甲醇、95%甲醇、85%甲醇、75%甲醇、65%甲醇、55%甲醇)、料液比(1 ∶ 5、1 ∶ 10、1 ∶ 15、1 ∶ 20、1 ∶ 25、1 ∶ 30,g/mL)、提取时间(10、20、30、40、50、60 min)对提取率的影响,结果显示,当提取溶剂为75%甲醇、料液比为1 ∶ 15(g/mL)、提取时间为50 min时,提取率较高,故选择上述提取条件。
3.5 含量测定结果分析
9批米炒北沙参饮片虽然都含有补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素,但从含量测定结果看,不同批次样品中5个成分的含量存在差异较大,总含量为34.20~83.41 µg/g,其中S1~S4有皮米炒北沙参饮片的总含量为55.08~83.41 µg/g,平均含量为74.33 µg/g;S5~S9去皮米炒北沙参饮片的总含量为34.20~41.81 µg/g,平均含量37.63 µg/g,S5~S7的总香豆素平均含量低于S8~S9的总香豆素平均含量。这提示样品含量差异可能与炮制时有无去皮和饮片来源有关。将S1~S4有皮米炒北沙参饮片的平均总含量下浮30%作为限度标准[19],即52.03 µg/g;将S5~S9去皮米炒北沙参饮片的平均总含量下浮30%作为限度标准[19],即26.34 µg/g。基于上述数据,暂定有皮米炒北沙参饮片中香豆素类成分的总含量不得少于52.03 µg/g,去皮米炒北沙参饮片不得少于26.34 µg/g。
4 结语
本研究按2020年版《中国药典》(四部)通则方法检测了米炒北沙参饮片中水分、总灰分、酸不溶性灰分、浸出物的含量,同时对5个香豆素类成分的含量进行了测定,初步拟定了如下标准:米炒北沙参饮片中水分不得过7.30%,总灰分不得过4.10%,酸不溶性灰分不得过0.30%,水溶性浸出物不得少于21.00%,醇溶性浸出物不得少于18.00%;有皮米炒北沙参饮片中香豆素类成分的总含量不得少于52.03 µg/g,去皮米炒北沙参饮片不得少于26.34 µg/g。所建质量标准可用于米炒北沙参的质量控制。由于米炒北沙参饮片的来源有限,本研究只收集到陕西惠福药业有限公司、安国市祁奥中药饮片有限公司、陕西百宝药业有限公司的饮片,样本量较小,故后续仍需扩大样品批次进行分析。
参考文献
[ 1 ] 江苏新医学院.中药大辞典:上册[M].上海:上海人民出版社,1977:644.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:103-104.
[ 3 ] 原忠.北沙参化学成分及生物活性的研究[D].沈阳:沈阳药科大学,2002.
[ 4 ] 刘伟,李中燕,田艳,等.北沙参的化学成分及药理作用研究进展[J].国际药学研究杂志,2013,40(3):291-294.
[ 5 ] 王丽莉.北沙参外皮化学成分及其生物活性的研究[D].沈阳:沈阳药科大学,2009.
[ 6 ] KITAJIMA J,OKAMURA C,ISHIKAWA T,et al. Monoterpenoid glycosides of Glehnia littoralis root and rhizoma[J]. Chem Pharm Bull,1998,46(10):1595-1598.
[ 7 ] FENG Z J,ZHANG X H,ZHANG J P,et al. A new aromatic glycoside from Glehnia littoralis[J]. Nat Prod Res,2014,28(8):551-554.
[ 8 ] 張韶瑜,孟林,高文远,等.香豆素类化合物生物学活性研究进展[J].中国中药杂志,2005,30(6):410-414.
[ 9 ] 程果,徐国兵.香豆素类化合物的药理作用研究进展[J].中成药,2013,35(6):1288-1291.
[10] 卫生部中医研究院中药研究所卫生部药品生物制品检定所.中药炮炙经验集成[M].北京:人民卫生出版社,1963.
[11] 甘肃省食品药品监督管理局.甘肃省中药炮制规范[S].兰州:甘肃文化出版社,2009:36-37.
[12] 苏星,李相坤,吴弢,等.北沙参药材的薄层色谱指纹图谱研究[J].中药材,2012,35(2):210-213.
[13] 冯子晋,卢小玲,张建鹏,等.北沙参中香豆素类与聚炔类成分的含量测定研究[J].中国海洋药物,2014,33(3):20-26.
[14] 李宝国,石俊英. HPLC法测定不同产地北沙参药材中香豆素的含量[J].中药材,2005,28(6):475-476.
[15] 董芳,刘汉柱,辛华.不同生长年份北沙参中香豆素含量的比较研究[J].中国农学通报,2009,25(19):295-297.
[16] 王平,吴赵云,吴树华,等.不同产地北沙参中欧前胡素和异欧前胡素含量分析[J].上海中医药杂志,2011,45(2):72-74.
[17] 冯子晋,卢小玲,张建鹏,等.北沙参中香豆素的提取工艺研究[J].时珍国医国药,2014,25(2):282-283.
[18] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:59,61,114,230,232,234.
[19] 程访.北沙参镇咳祛痰的药效物质基础及质量标准研究[D].南昌:江西中医药大学,2019.
(收稿日期:2021-11-08 修回日期:2022-03-03)
(编辑:陈 宏)

