鬼针草总黄酮对HepG2细胞胰岛素抵抗的影响
庞晓军 卢琳琳 黎东旺 赵一宇 刘国勇

中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2022)08-0968-07
DOI 10.6039/j.issn.1001-0408.2022.08.11
摘 要 目的 探究鬼针草总黄酮(TFB)对人肝癌HepG2细胞胰岛素抵抗(IR)的影响。方法 取鬼针草,用80%乙醇回流提取,制得TFB。利用棕榈酸体外诱导HepG2细胞复制IR模型,考察低、中、高质量浓度(20、40、80 mg/L)TFB对细胞葡萄糖消耗量的影响;以二甲双胍为阳性对照,考察低、中、高质量浓度(20、40、80 mg/L)TFB对细胞中胰岛素受体底物1(IRS-1)、c-Jun氨基端激酶(JNK)和蛋白激酶C(PKC)表达的影响。采用分子对接技术探讨槲皮素、槲皮苷等8个TFB主要活性成分与IRS-1、JNK、PKC蛋白的相互作用。结果 TFB低、中、高质量浓度组细胞的葡萄糖消耗量均较模型组显著升高(P<0.05或P<0.01)。与正常组比较,模型组细胞中的IRS-1、JNK蛋白的表达量均显著降低,PKC蛋白的表达量显著升高(P<0.01);与模型组比较,TFB低、中、高质量浓度组和二甲双胍阳性对照组能上调IRS-1、JNK蛋白的表达并下调PKC蛋白的表达(P<0.05或P<0.01)。TFB中的海生菊苷与IRS-1蛋白的分子对接能量打分值为-7.9 kcal/mol(1 kcal=4.816 kJ),海生菊苷、芦丁与JNK蛋白的分子对接能量打分值均为-9.3 kcal/mol,槲皮苷与PKC蛋白的分子对接能量打分值为-4.9 kcal/mol,成分与蛋白间的相互作用包括形成氢键、疏水键等。结论 TFB对HepG2细胞IR有显著的改善作用,其机制可能与调节IRS、JNK、PKC蛋白的表达有关;海生菊苷、芦丁和槲皮苷可能是改善IR的潜在活性成分。
关键词 鬼针草总黄酮;人肝癌HepG2细胞;胰岛素抵抗;胰岛素受体底物1、c-Jun氨基端激酶;蛋白激酶C;分子对接
Effects of total flavonoids of Bidens pilosa on insulin resistance in HepG2 cells
PANG Xiaojun1,2,LU Linlin2,LI Dongwang1,2,ZHAO Yiyu3,LIU Guoyong4(1. Dept. of Pharmacy, the Second People’s Hospital of Qinzhou, Guangxi Qinzhou 535000, China; 2. College of Pharmacy, Guangxi Medical University, Nanning 530021, China; 3. Dept. of Rehabilitation,the Second People’s Hospital of Qinzhou, Guangxi Qinzhou 535000, China; 4. Dept. of Radiology, the Second People’s Hospital of Qinzhou, Guangxi Qinzhou 535000, China)
ABSTRACT OBJECTIVE To explore the effects of total flavonoids of Bidens polisa L. (TFB) on insulin resistance (IR) of HepG2 cells. METHODS B. polisa L. was refluxed and extracted with 80% ethanol to obtain TFB. Palmitic acid was used to induce IR mode of HepG2 cells in vitro. The effects of low-concentration, medium-concentration and high-concentration (20, 40, 80 mg/L) of TFB on the consumption of glucose were investigated. Using metformin as positive control, the effects of low-concentration, medium-concentration and high-concentration (20, 40, 80 mg/L) of TFB on the protein expression of insulin receptor substrate-1 (IRS-1), c-Jun N-terminal kinase (JNK) and protein kinase C (PKC) were investigated. Molecular docking technology was used to explore the interaction between eight main active components of TFB such as quercetin, quercitrin and IRS-1, JNK and PKC proteins. RESULTS The glucose consumption of TFB low-concentration, medium-concentration and high-concentration groups were increased significantly (P<0.05 or P<0.01). Compared with normal group, the expression of IRS-1 and JNK protein in the model group decreased significantly, and the expression of PKC protein increased significantly (P<0.01). Compared with model group, the protein expression of IRS-1 and JNK could up-regulated while the protein expression of PKC down-regulated in TFB low-concentration, medium-concentration and high-concentration groups and metformin positive control group (P<0.05 or P<0.01). The score of molecular docking energy between maritimetin in TFB and IRS-1 protein was -7.9 kcal/mol (1 kcal=4.816 kJ). The scores of molecular docking energy of maritimetin, rutin and JNK protein were -9.3 kcal/mol. The score of molecular docking energy between quercitrin and PKC protein was -4.9 kcal/mol. Interactions between components and proteins included forming hydrogen bonds, hydrophobic bonds and so on. CONCLUSIONS TFB can significantly improve IR of HepG2 cells, the mechanism of which may be related to the regulation of protein expression of IRS, JNK and PKC. Maritimetin, rutin and quercitrin may be potential active ingredients for improving IR.
KEYWORDS total flavones of Bidens polisa L.; human hepatoma HepG2 cells; insulin resistance; insulin receptor substrate-1; c-Jun N-terminal kinase; protein kinase C; molecular docking
胰岛素抵抗(insulin resistance,IR)是指机体对胰岛素生物反应性降低的一种现象,表现为胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性分泌过多胰岛素而产生高胰岛素血症[1]。IR是代谢综合征、2型糖尿病、高血压、心脑血管疾病等多种疾病的发病基础,严重威胁人类的健康[2]。IR的患病率正在增加,尤其是在发展中国家的年轻人口中,患病率达20%~40%[3]。中医药在改善IR方面具有效果显著、成本低、不良反应少等优势,探究中药对IR的作用是当前研究的热点之一[4]。据最新报道显示,近5年来发现的具有IR改善作用的中药活性成分有35种,其中黄酮类成分有11种,约占三分之一。鬼针草总黄酮(total flavonoids of Bidens polisa L.,以下简称“TFB”)是其中的主要代表成分[4]。TFB具有抗炎、抗氧化、抗肝纤维化等多种药理作用[5]。有研究指出,c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)信号通路在IR的发生发展中具有重要作用[6]。黄酮类化合物在改善IR方面具有明显的作用,且这种作用可能与调控JNK信号通路有关[7]。虽然已有报道指出,TFB可以通过调控磷脂酰肌醇3激酶/丝氨酸-苏氨酸蛋白激酶1/葡萄糖转运蛋白4(phosphoinositide 3-kinase/serine-threonine protein kinase 1/glucose transporter protein 4,PI3K/AKT1/GLUT4)信号通路中转录因子编码基因及蛋白的表达来改善HepG2細胞的IR状态[8],但有关TFB对IR及JNK相关信号通路的作用尚待进一步的探究。为此,本研究拟复制HepG2细胞IR模型并结合分子对接实验,探讨TFB改善IR的可能作用机制,为研发改善IR作用的潜在活性药物提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有SpectraMax Plus 384型酶标仪(香港分子仪器公司),ZF-2型三用紫外分析仪(上海市安亭电子仪器厂),Odyssey型红外荧光扫描成像系统(美国LI-COR公司),PowerPac Basic电泳系统(美国Bio-Rad公司),3111型二氧化碳(CO2)细胞培养箱(美国Thermo Fisher Scientific 公司),SHA-CA型恒温水浴锅(常州易晨仪器制造有限公司),1334型无菌操作台(长沙米淇仪器设备有限公司)等。
1.2 主要药品与试剂
鬼针草药材(批号20190604)购自钦州医药有限责任公司,经钦州市第二人民医院赵一宇副主任中医师鉴定为菊科鬼针草属植物鬼针草B. polisa L.的地上部分。
芦丁对照品(批号100080-201711,纯度≥98%)购自中国食品药品检定研究院;HPD-100大孔吸附树脂(粒度16~60目,批号20180424)购自天津市海光化工有限公司;棕榈酸(palmic acid,PA)对照品(批号P104234,纯度≥99%)购自阿拉丁试剂(上海)有限公司;DMEM高糖培养基、胎牛血清(批号分别为20181112、20181121)均购自美国Gibco公司;盐酸二甲双胍肠溶片(批号20181114,规格0.5 g)购自贵州圣济堂制药有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、0.25%胰蛋白酶-乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)消化液、青链霉素混合液、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、10×TBST缓冲液(批号分别为20181129、20181212、20181030、20181025、20181220、20181201)均购自北京索莱宝科技有限公司;BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、Western一抗稀释液、Western二抗稀释液(批号分别为20181127、20181124、P0256、P0258)均购自上海碧云天生物技术有限公司;葡萄糖测定试剂盒(批号20180205)购自上海荣盛生物药业股份有限公司;兔源JNK单克隆抗体、兔源胰岛素受体底物1(insulin receptor substrate-1,IRS-1)单克隆抗体(批号分别为9252、2382)均购自美国Cell Signaling Tchnology公司;兔源蛋白激酶C(protein kinase C,PKC)多克隆抗体(批号ab182126)购自英国Abcam公司;小鼠源β-肌动蛋白(β-actin)单克隆抗体(批号10021293)购自武汉三鹰生物技术有限公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(immunoglo- bulin G,IgG)二抗(批号BST16K26C16L54)购自武汉博士德生物工程有限公司;其余试剂均为分析纯,水为去离子水。
1.3 细胞株
人肝癌HepG2细胞购自中国科学院上海细胞生物研究所。
2 方法
2.1 TFB的制备及纯度测定
参考杜利月等[9]、瞿慧等[10]的研究方法并进行改良:取鬼针草药材适量,用10倍量的80%乙醇加热回流提取2次,每次2 h,合并提取液;将提取液过滤、合并、浓缩至无醇味,加适量热水,超声促溶,冷却后抽滤,得滤液。滤液经预处理好的HPD-100大孔吸附树脂吸附24 h后,先以2倍柱体积的水洗去杂质,再用3倍柱体积的70%乙醇进行洗脱并收集洗脱液,浓缩至无乙醇味,冷冻干燥后即得TFB样品(每1 kg鬼针草药材得TFB样品54 g),采用紫外分析仪于510 nm波长处测得其纯度为52.72%(以芦丁计)。
2.2 TFB和PA对HepG2细胞增殖影响的检测
将对数生长期的HepG2细胞,按5×104个/mL接种于96孔培养板中,每孔100 μL,设置实验组、对照组、空白组。实验组加入不同质量浓度的TFB[5、10、20、40、80、160 mg/L,以含10%胎牛血清和1%青链霉素混合液的完全培养基(后同)配制,浓度参考预实验结果设置],对照组加入含0.5%DMSO的完全培养基,空白组加入不含细胞、不含药物的完全培养基,每孔加入量均为100 μL,每组设置6个复孔。于37 ℃、5%CO2条件(后同)下培养24 h后,每孔加入5 mg/L的MTT溶液10 μL,继续培养2~4 h后,吸弃上层液,每孔加入DMSO 150 μL,振荡脱色10 min,用酶标仪在570 nm波长处测定各孔的光密度(optical density,OD)并计算各组细胞存活率:细胞存活率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。上述步骤均需避光操作。
取对数生长期的HepG2细胞,检测PA对HepG2细胞增殖的影响,PA浓度分别为50、75、100、125、150、175、200 μmol/L(以完全培养基为溶剂,浓度参考预实验结果设置),每组设置3个复孔,作用时间设为24 h和48 h,其余设置与操作同前。
2.3 HepG2细胞IR模型的建立
取对数生长期的HepG2细胞,按1×105个/mL接种于96孔培养板中,每孔100 μL,分为对照组和模型组,每组设置3个复孔。待细胞贴壁后,对照组加入完全培养基,模型组加入新配制的含PA 50、75、100、125、150、175、200 μmol/L的完全培养基(浓度参考预实验结果设置),培养24 h或48 h后,吸弃原有培养基,PBS清洗2次后,换上无酚红的DMEM高糖培养基,培养24 h后,以酶標仪检测培养基上清液中的葡萄糖含量并计算葡萄糖消耗量,选择最优的PA浓度和作用时间,以复制PA诱导的HepG2细胞IR模型。严格按照试剂盒说明书操作。
2.4 TFB对HepG2细胞IR模型葡萄糖消耗量影响的检测
实验设正常组,模型组,TFB低、中、高质量浓度组(20、40、80 mg/L,浓度参考“2.2”项下结果设置),每组设置3个复孔。培养24 h,除正常组外,其余各组参照“2.3”项下最优实验方法,使用PA诱导HepG2细胞复制IR模型。继续培养24 h后,以酶标仪检测葡萄糖含量并计算葡萄糖消耗量。严格按照试剂盒说明书操作。
2.5 TFB对HepG2细胞IR模型中IRS-1、PKC、JNK蛋白表达影响的检测
采用Western blot法检测。实验设正常组,模型组,TFB低、中、高质量浓度组(20、40、80 mg/L,浓度参考“2.2”项下结果设置)以及二甲双胍阳性对照组(1 mmol/L,浓度参考文献[8]设置),每组设置3个复孔。培养24 h后,除正常组外,其余各组参照“2.3”项下最优实验方法,使用PA诱导HepG2细胞复制IR模型。继续培养24 h,吸弃各组培养液,细胞用PBS清洗1次,加入RIPA裂解液150~250 μL,于冰上裂解20~30 min,于4 ℃下以12 000 r/min离心20 min,吸取上清液,用BCA蛋白浓度测定试剂盒进行蛋白含量测定。将各组样本的蛋白与上样缓冲液按体积比1 ∶ 3混合后,放入沸水中煮5 min使变性。取变性蛋白100 μg,上样到10%SDS-PAGE凝胶上进行电泳,电泳后转移至PVDF膜,用TBST缓冲液封闭,在4 ℃下与IRS-1、PKC、JNK、β-actin一抗(稀释比例均为1 ∶ 1 000)孵育过夜,用TBST缓冲液洗涤3次,滴加HRP标记的IgG二抗(稀释比例为1 ∶ 1 000)避光孵育1 h,再次用TBST缓冲液洗涤后,使用红外荧光扫描成像系统显影,通过Image J v1.8.0软件分析,以目标蛋白与内参蛋白(β-actin)灰度值的比值来表示其表达量。
2.6 分子对接实验
根据朱冬春等[11]的研究以及TCMSP数据库(https://tcmspw.com),检索到槲皮素(quercetin)、槲皮苷(quercitrin)、异槲皮苷(isoquercitrin)、金丝桃苷(hyperoside)、芦丁(rutin)、木犀草素(luteolin)、奥卡宁(okanin)、海生菊苷(maritimetin)共8个TFB的主要活性成分,利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载上述成分的三维结构,基于OpenBabel 2.4.1软件,在MMFF94力场下对成分结构进行优化。从RCSB Protein Data Bank数据库(http://www.rcsb.org/)下载IRS-1(PDB ID:1K3A)、JNK(PDB ID:3V6R)、PKC(PDB ID:2UZP)蛋白晶体的三维结构,使用AutoDockTools 1.5.6软件进行可旋转键的搜寻与定义,并对蛋白结构进行除去水分子、添加氢原子、添加电荷等处理,以PDBQT格式保存。利用AutoDock Vina 1.1.2分子对接软件,根据蛋白配体的位置,确定蛋白活性位点的坐标,其余参数均采用默认值,选取对接结合能量最低的构象用于分子对接结合模式分析,获取每个成分的分子对接能量打分值(其绝对值越高,表明对接结构越紧密且稳定)[12],并使用Discovery Studio 2016分子模拟软件的“可视化功能”对分子对接结构进行可视化展示。
2.7 统计学分析
采用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 TFB对HepG2细胞增殖的影响
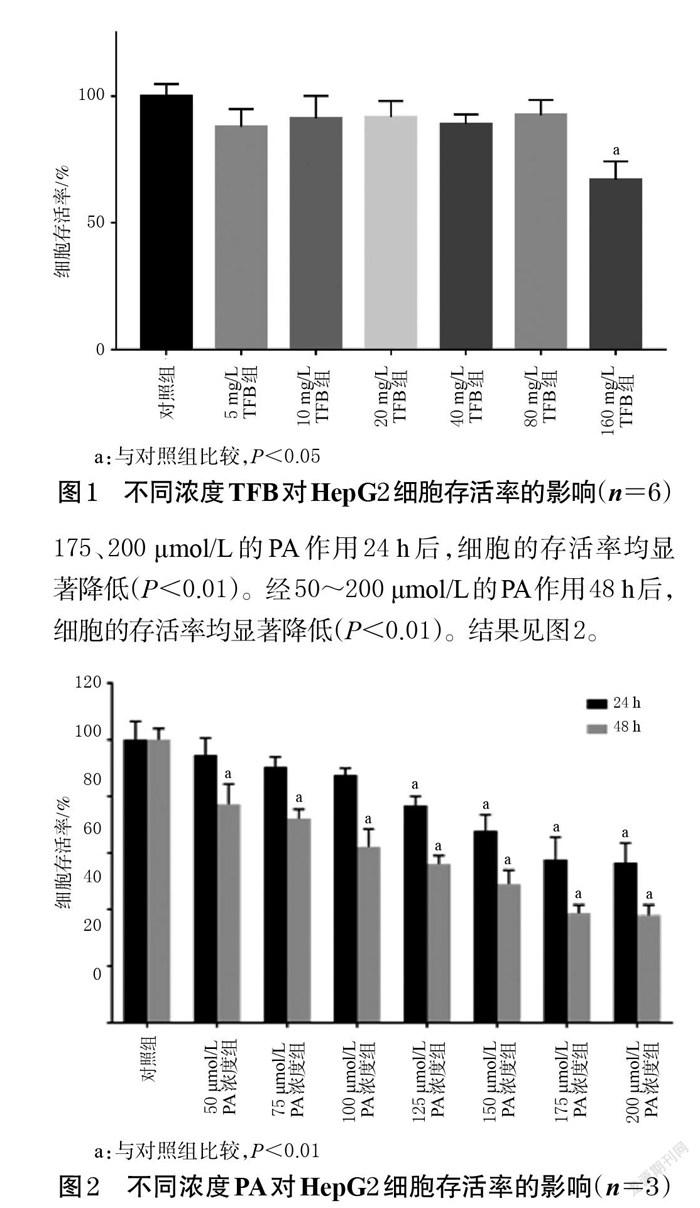
与对照组比较,5~80 mg/L的TFB对HepG2细胞的存活率没有显著影响(P>0.05),但160 mg/L的TFB可显著降低细胞的存活率(P<0.05),如图1所示。因此,以20、40、80 mg/L作为TFB的低、中、高质量浓度进行后续研究。
3.2 PA对HepG2细胞增殖的影响
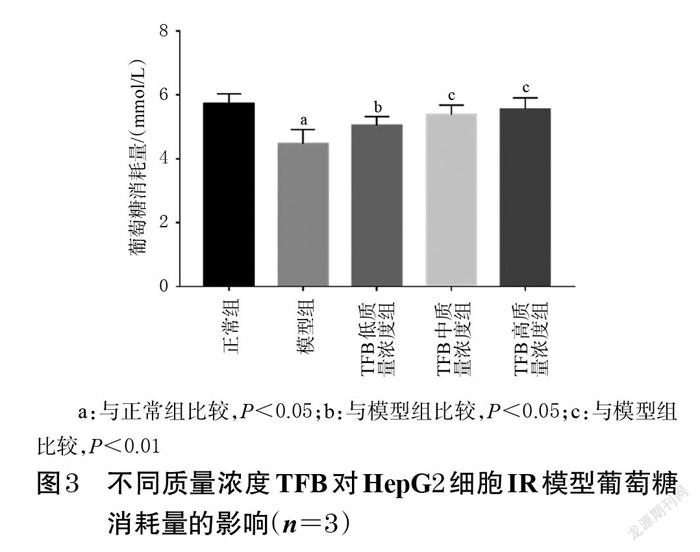
与对照组比较,经50、75、100 μmol/L的PA作用24 h后,细胞的存活率均无明显变化(P>0.05);经125、150、175、200 μmol/L的PA作用24 h后,细胞的存活率均显著降低(P<0.01)。经50~200 μmol/L的PA作用48 h后,细胞的存活率均显著降低(P<0.01)。结果见图2。
3.3 PA对HepG2细胞葡萄糖消耗量的影响
与对照组比较,经75~200 μmol/L的PA作用24 h后,细胞的葡萄糖消耗量均显著降低(P<0.05或P<0.01);经50~200 μmol/L的PA作用48 h后,细胞的葡萄糖消耗量均显著降低(P<0.01),结果见表1。结合“3.2”项下结果,以75 μmol/L的PA作用24 h诱导HepG2细胞建立IR模型。
3.4 TFB对HepG2细胞IR模型葡萄糖消耗量的影响
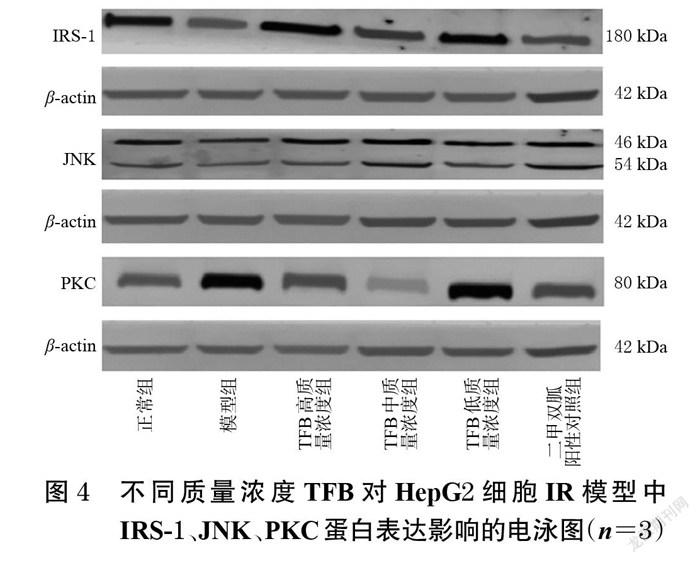
与正常组比较,经PA刺激后,模型组细胞的葡萄糖消耗量显著下降(P<0.05),提示造模成功;与模型组比较,经不同质量浓度的TFB处理后,各组细胞的葡萄糖消耗量均显著增加(P<0.05或P<0.01),说明TFB改善了IR。结果见图3。
3.5 TFB对HepG2细胞IR模型中IRS-1、JNK、PKC蛋白表达的影响
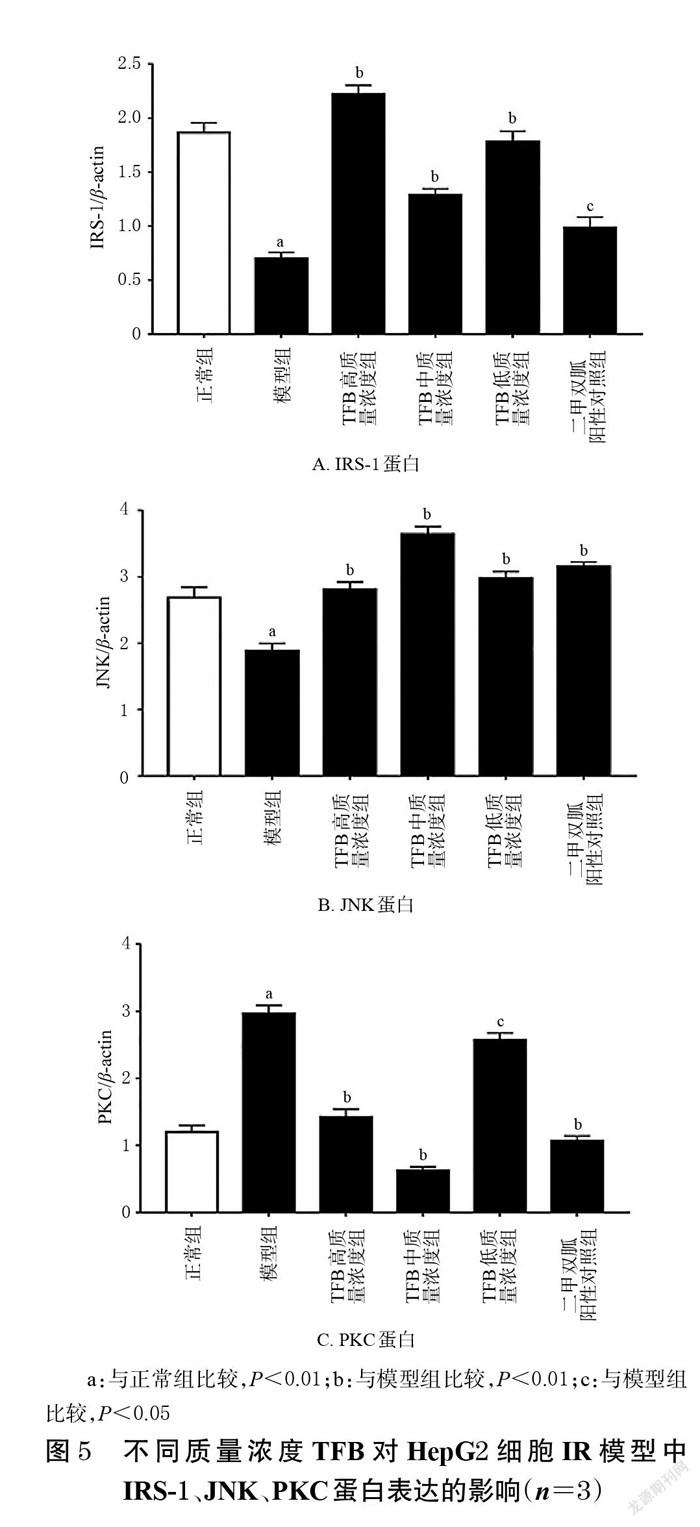
与正常组比较,模型组细胞中IRS-1、JNK蛋白的表达量均显著降低,PKC蛋白的表达量显著升高(P<0.01);与模型组比较,TFB低、中、高质量浓度组和二甲双胍阳性对照组细胞中IRS-1、JNK蛋白的表达量均显著升高,PKC蛋白的表达量均显著降低(P<0.05或P<0.01),结果见图4~图5。
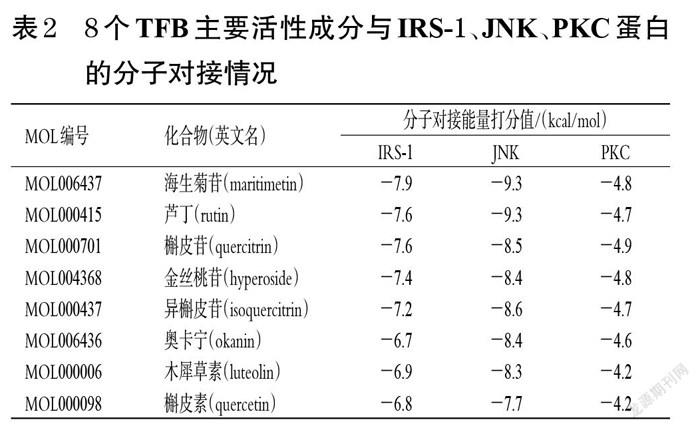
3.6 8个TFB主要活性成分与IRS-1、JNK、PKC蛋白的分子对接结果
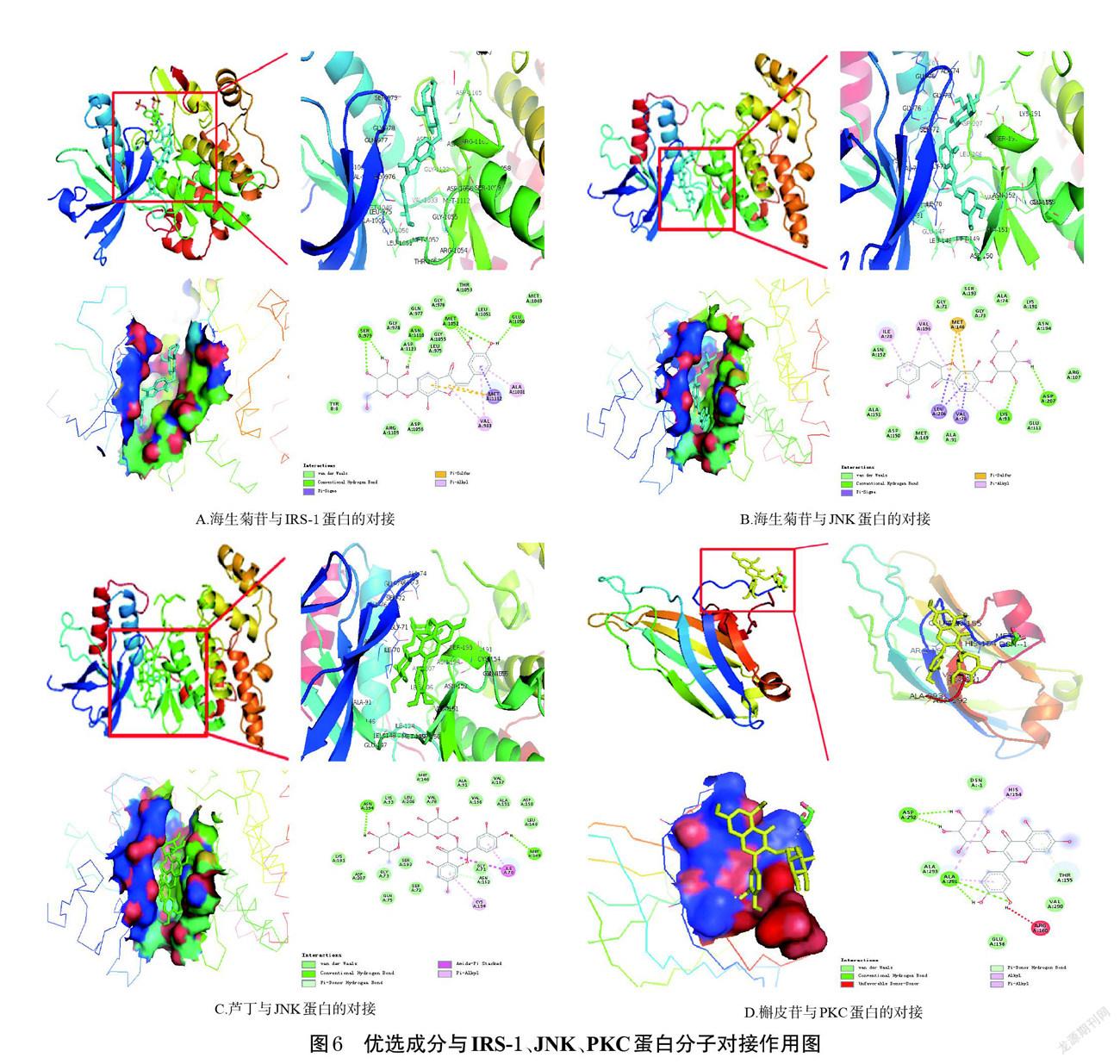
槲皮素、槲皮苷等8个TFB主要活性成分均作用于IRS-1、JNK、PKC蛋白的活性口袋位置,且对接良好,其分子对接能量打分值如表2所示。其中,与IRS-1蛋白分子对接能量打分值绝对值最高的成分为海生菊苷(分子对接能量打分值为-7.9 kcal/mol,1 kcal=4.186 kJ),该成分能够与IRS-1蛋白的SER979、ASN1110、MET1052、GLU1050氨基酸残基形成氢键,与MET1112、ALA1001、VAL983形成疏水键,与TYR8、ARG1109、ASP1056等具有范德华力,其苯环与MET1112间存在硫-π键作用(图6A)。与JNK蛋白分子对接能量打分值绝对值最高的成分为海生菊苷和芦丁(分子对接能量打分值均为-9.3 kcal/mol),海生菊苷能够与JNK蛋白的ASP207、LYS93氨基酸残基形成氢键,与ILE70、VAL196、LEU206、VAL78形成疏水键,与ASN152、ALA151、ASP150等具有范德华力,其苯环与MET146间存在硫-π键作用(图6B);芦丁能够与JNK蛋白的ASN194、MET149、ASN152氨基酸残基形成氢键,与ILE70、CYS154形成疏水键,与LYS93、LEU206、VAL78等具有范德华力(图6C)。与PKC蛋白分子对接能量打分值绝对值最高的成分为槲皮苷(分子对接能量打分值为-4.9 kcal/mol),该成分能够与PKC蛋白的ALA291、ASP292、THR155氨基酸残基形成氢键,与HIS154形成疏水键,与DSN-1、ALA293、GLU156等具有范德华力(图6D)。
4 讨论
IR是很多疾病的发病基础,并与肥胖症、高血壓、心血管及动脉粥样硬化等代谢性疾病的发生和发展有关[3]。肝脏作为胰岛素作用的主要靶器官,是IR发生的主要部位[13]。在相关研究中,因表面具有高亲和力的胰岛素受体,HepG2细胞常被用以诱导建立IR模型[14]。在模型诱导方面,高糖、高胰岛素、高脂(软脂酸)单独使用或联合使用是常用的诱导方法[14-15]。本研究采用PA诱导HepG2细胞复制IR模型,在实验过程中发现,50、75、100 μmol/L的PA对细胞增殖虽有一定的抑制作用,但这种作用在24 h内并不明显;同时,PA可显著降低细胞的葡萄糖消耗量,表明使用PA诱导HepG2细胞可成功复制IR模型。
JNK是丝裂原激活蛋白激酶家族成员,其编码基因有3种形式,即JNK1、JNK2和JNK3[16]。JNK蛋白是重要的信号分子,在IRS和PI3K信号通路中具有重要的作用,且上述通路及其相关蛋白在葡萄糖转运中有关键作用[17]。研究表明,很多激酶可使IRS的丝氨酸磷酸化,其中就包括JNK和PKC[18]。JNK的作用机制是通过提高IRS-1和IRS-2的水平来抑制JNK活性,从而改善胰岛素信号转导和胰岛素敏感性,进而发挥IR抑制作用[19]。本研究结果显示,与正常组比较,模型组细胞中IRS-1、JNK蛋白的表达量均显著降低;与模型组比较,TFB低、中、高质量浓度组以及二甲双胍阳性对照组细胞中IRS-1、JNK蛋白的表达量均显著升高。与正常组比较,模型组细胞中PKC蛋白的表达量显著升高;与模型组比较,TFB低、中、高质量浓度组以及二甲双胍阳性对照组细胞中PKC蛋白的表达量均显著降低。本研究发现,PA诱导HepG2细胞IR模型经不同浓度的TFB干预后,随TFB浓度的升高,其对细胞中IRS-1、JNK、PKC蛋白表达的调控作用并无明显的量效关系,笔者推测这可能与TFB对模型细胞作用的敏感性以及细胞的反馈调节有关。
分子对接是研究小分子配体与靶蛋白大分子之间相互结合作用及性能的手段之一,在药物研发中具有重要的价值[20]。为了进一步探究TFB的主要活性成分与IRS-1、JNK、PKC蛋白之间的相互作用,本研究利用了分子对接技术进行分析。结果显示,海生菊苷、芦丁和槲皮苷与上述蛋白的对接结合性能较好。组织氧化应激损伤和炎症反应是机体IR发生的重要机制之一,可通过调控氧化应激和炎症反应来改善IR[21]。有研究指出,海生菊苷作为黄酮类化合物,具有抗氧化活性和抗炎作用[22-23]。因此,海生菊苷在改善IR方面具有潜在价值。有研究表明,芦丁同样可增强肝脏组织中过氧化氢酶、谷胱甘肽过氧化物酶和超氧化物歧化酶的活性,降低丙二醛的含量,降低糖尿病模型小鼠血清中白细胞介素6、白细胞介素1和肿瘤坏死因子α的水平,减轻其抗氧化应激损伤和炎症反应,进而发挥降血糖和改善IR的作用[24]。槲皮苷具有一定的降血糖作用,据汤小平等[25]的报道,槲皮苷可促进糖尿病模型大鼠的胰岛素分泌,并改善其IR。
综上所述,TFB对HepG2细胞IR有显著的改善作用,其机制可能与调节IRS、JNK、PKC蛋白的表达有关;海生菊苷、芦丁和槲皮苷可能是改善IR的潜在活性成分。
参考文献
[ 1 ] MATULEWICZ N,KARCZEWSKA-KUPCZEWSKA M. Insulin resistance and chronic inflammation[J]. Postepy Hig Med Dosw(Online),2016,70(0):1245-1258.
[ 2 ] KŘÍŽKOVÁ K,CHRUDINOVÁ M,POVALOVÁ A,et al. Insulin-insulin-like growth factors hybrids as molecular probes of hormone:receptor binding specificity[J]. Biochemistry,2016,55(21):2903-2913.
[ 3 ] ARTUNC F,SCHLEICHER E,WEIGERT C,et al. The impact of insulin resistance on the kidney and vasculature[J]. Nat Rev Nephrol,2016,12(12):721-737.
[ 4 ] 郑书臣,赵启韬,桑晓宇,等.改善胰岛素抵抗的中药活性成分及作用机制研究进展[J].山东中医杂志,2021,40(1):94-99.
[ 5 ] 徐俊,潘开瑞,刘方洲.鬼针草总黄酮药效学研究进展[J].中医学报,2017,32(4):610-612.
[ 6 ] LIU P L,SHI L,CANG X M,et al. CtBP2 ameliorates palmitate-induced insulin resistance in HepG2 cells through ROS mediated JNK pathway[J]. Gen Comp Endocrinol,2017,247:66-73.
[ 7 ] 刘少彬.大叶紫薇总黄酮对脂肪细胞炎症反应与胰岛素抵抗的影响及作用机理[D].湛江:广东海洋大学,2013.
[ 8 ] 黄桂红,刘天旭,朱钊铭,等.鬼针草黄酮对HepG2胰岛素抵抗细胞PI3K/AKT1/GLUT4信号通路的调控作用[J].实用医学杂志,2016,32(24):3994-3998.
[ 9 ] 杜利月,郭留城.鬼针草总黄酮超声提取工艺优选[J].中国药业,2013,22(23):41-42.
[10] 瞿慧,曹园,方祝元,等.大孔吸附树脂纯化鬼针草总黄酮的工艺优选[J].中国医药指南,2013,11(34):67-69.
[11] 朱冬春,孙旭群.鬼针草中黄酮类化学成分的药代动力学研究进展[J].安徽医药,2015,19(1):14-17.
[12] 劉畅,孙磊,聂晶,等.基于网络药理学和分子对接法的化湿败毒方对抗新型冠状病毒肺炎(COVID-19)分子机制初步研究[J].辽宁中医药大学学报,2021,23(11):56-63.
[13] SHULMAN G I. Ectopic fat in insulin resistance,dyslipi- demia,and cardiometabolic disease[J]. N Engl J Med,2014,371(12):1131-1141.
[14] JIANG H W,MA Y J,YAN J Q,et al. Geniposide promotes autophagy to inhibit insulin resistance in HepG2 cells via P62/NF‑κB/GLUT‑4[J]. Mol Med Rep,2017,16(5):7237-7244.
[15] MAO Z J,LIN M,ZHANG X,et al. Combined use of Astragalus polysaccharide and berberine attenuates insulin resistance in IR-HepG2 cells via regulation of the gluconeogenesis signaling pathway[J]. Front Pharmacol,2019,10:1508.
[16] GUPTA S,BARRETT T,WHITMARSH A J,et al. Selective interaction of JNK protein kinase isoforms with transcription factors[J]. EMBO J,1996,15(11):2760-2770.
[17] ZHANG J,OU J,BASHMAKOV Y,et al. Insulin inhibits transcription of IRS-2 gene in rat liver through an insulin response element(IRE)that resembles IREs of other insulin-repressed genes[J]. Proc Natl Acad Sci USA,2001,98(7):3756-3761.
[18] ZEKE A,MISHEVA M,REMÉNYI A,et al. JNK signa- ling:regulation and functions based on complex protein-protein partnerships[J]. Microbiol Mol Biol Rev,2016,80(3):793-835.
[19] TANG Z Q,ZHANG W L,WAN C H,et al. TRAM1 protect HepG2 cells from palmitate induced insulin resistance through ER stress-JNK pathway[J]. Biochem Biophys Res Commun,2015,457(4):578-584.
[20] 劉景陶,刘映雪.分子对接在药物研发中的应用[J].科技创新与应用,2018(1):167-168.
[21] VEERAMANI C,ALSAIF M A,AL-NUMAIR K S. Lavatera critica controls systemic insulin resistance by ameliorating adipose tissue inflammation and oxidative stress using bioactive compounds identified by GC-MS[J]. Biomed Pharmacother,2018,106:183-191.
[22] 陈月红.金盏银盘化学成分与抗氧化活性的研究[D].济南:山东中医药大学,2008.
[23] 王晓宇.鬼针草总黄酮第Ⅲ部分化学成分分离、纯化、鉴定及其活性研究[D].合肥:安徽医科大学,2014.
[24] 潘敬芳,刘云涛,简磊.芦丁对糖尿病小鼠降血糖作用研究[J].解放军药学学报,2016,32(3):243-245,268.
[25] 汤小平,施宁川,丁志山,等.槲皮苷对原发性糖尿病大鼠血糖的作用研究[J].中国药师,2016,19(8):1449-1451,1454.
(收稿日期:2021-12-03 修回日期:2022-02-18)
(编辑:曾海蓉)

