乳源活性成分功能特性的研究进展
毛学英, 韩立华, 袁绮晨, 巩 涵
(中国农业大学 食品科学与营养工程学院/教育部功能乳品重点实验室, 北京 100083)
乳中含有大量的生物活性成分,为婴幼儿的生长发育提供足够的营养支持,并对其健康状况产生长远影响。乳蛋白包括酪蛋白和乳清蛋白,其含量和比例因乳源不同而异,不同乳的蛋白质组成不同。在牛乳蛋白中约80%是酪蛋白,20%是乳清蛋白。酪蛋白包括αs-酪蛋白、β-酪蛋白、κ-酪蛋白等,乳清蛋白包括免疫球蛋白、乳铁蛋白(lactoferrin,LF)、血清白蛋白、β-乳球蛋白、溶菌酶、α-乳白蛋白(α-lactalbumin,α-LA)等。乳中的活性成分主要包括乳蛋白和乳磷脂等,其中活性乳蛋白主要包括酪蛋白糖巨肽(casein glycomacropeptide,GMP)、α-乳白蛋白、乳铁蛋白、骨桥蛋白(osteopontin,OPN)和乳脂肪球膜(milk fat globule membrane,MFGM)蛋白等,它们以完整蛋白或酶解肽段的形式发挥生物学功能;乳磷脂则主要存在于乳脂肪球膜中。
随着食品科学研究的深入和分离技术的发展,乳源活性成分及其衍生物得到了广泛研究和开发,且应用于婴幼儿配方乳粉等配方产品中。本文针对酪蛋白糖巨肽、α-乳白蛋白、乳铁蛋白、骨桥蛋白和乳脂肪球膜的结构和功能特性进行概述,以期为乳源活性成分及功能性乳配料的开发和产业应用提供参考。
1 酪蛋白糖巨肽的结构和功能特性
1.1 酪蛋白糖巨肽的结构
酪蛋白糖巨肽(casein glycomacropeptide,GMP)的结构和氨基酸序列研究较为清晰,在牛乳中有11种异构体,最主要的是A型和B型两种。二者的主要区别在于A型异构体136位和148位的氨基酸分别为苏氨酸(Thr)和天冬氨酸(Asp);而B型异构体的136位和148位氨基酸分别为异亮氨酸(Ile)和丙氨酸(Ala),见图1[1]。与GMP所连接的糖配体主要包括唾液酸、N-乙酰氨基半乳糖和半乳糖组成的5种不同糖链,通过O-糖苷键分布在GMP的131、133、135和142位Thr以及141位Ser上[1]。此外,GMP几乎不含酪氨酸和苯丙氨酸等芳香族氨基酸,而含有较多的支链氨基酸(如缬氨酸和亮氨酸),此特性可为不能代谢芳香族氨基酸的苯丙酮酸尿症和肝脏疾病等患者提供膳食指导。

图1 牛乳酪蛋白糖巨肽的氨基酸组成Fig.1 Amino acid composition of bovince casein glycomacropeptide
1.2 酪蛋白糖巨肽的功能特性
1.2.1改善代谢综合征
GMP可以刺激胰腺及肠道,分泌较多参与形成饱腹感的激素,从而降低摄食量,减轻体重。与摄入普通氨基酸食物的苯丙酮酸尿患者相比,食用含有GMP食物的患者可以持续抑制胃饥饿素的产生,从而带来更大的饱腹感,延缓体重增加[2]。GMP可在体外抑制大鼠前脂肪细胞生长,减少脂质积累,而在体内可降低脂肪组织的脂肪细胞大小,促进高脂饮食大鼠脂质分解代谢,减少脂肪堆积,这表明GMP可以通过调节脂质代谢预防脂质堆积和肥胖[3-4]。将GMP进行酶解后得到的生物活性肽IPPKKNQDKTE可以通过调控AMPK和MAPK信号分子,激活胰岛素信号通路并抑制炎症信号通路,改善HepG2细胞的胰岛素抵抗[5-6]。此外,GMP及其酶解物还具有降血压的功能。膳食补充GMP可降低受试人群的收缩压和舒张压。当GMP经胰蛋白酶处理后具有显著的血管紧张素转化酶抑制活性,可以降低大鼠收缩压,并且在其中鉴定出发挥作用的多肽MAIPPKK[7]。
1.2.2免疫调节和抗炎活性
GMP的干预可以显著降低淋巴细胞移植小鼠肠系膜淋巴结中CD4+干扰素(interferon, IFN)-γ+细胞比例,调节肠黏膜免疫反应[8]。在卵清蛋白诱导的食物过敏模型中,GMP可以降低Th2型免疫反应,并抑制免疫球蛋白E和免疫球蛋白G1的表达来缓解食物过敏[9]。GMP可以发挥抗炎特性,这与其对免疫细胞的调控有关。GMP可以通过调控Th1/Th2、Th17/Treg平衡以及巨噬细胞活性,缓解肠道炎症[10]。此外,GMP还可以抑制结肠炎小鼠MAPK、NF- κB等与炎症相关信号通路,降低炎症因子IL- 1β和TNF- α表达,从而缓解肠道炎症[11]。GMP水解物可以抑制脂多糖(lipopolysaccharide, LPS)诱导巨噬细胞炎症反应中TLR4/MyD88/NF- κB信号通路的激活,并诱导核因子E2相关因子2的转录和血红素加氧酶- 1的表达,降低LPS诱导的一氧化氮生成以及炎症因子表达[12-13]。
2 α-乳白蛋白的结构和功能特性
2.1 α-乳白蛋白的结构
α-乳白蛋白(α-lactalbumin,α-LA)是乳中主要的一种乳清蛋白,占牛乳总蛋白的3.5%[14]。在一级结构中,牛乳α-LA由123个氨基酸组成,见图2[15],分子量约为14.2 kDa,包含大量必需氨基酸和较多的色氨酸、赖氨酸、半胱氨酸和支链氨基酸,其中色氨酸和半胱氨酸的含量显著高于人乳α-LA。色氨酸是合成神经介质5-羟色胺(5-hydroxytryptamine, 5-HT)的前体物质,具有改善睡眠质量、缓解焦虑,改善婴幼儿认知的功能;而半胱氨酸能提高机体免疫力,促进伤口愈合[15]。在二级结构中,牛乳α-LA含有1个大的α-螺旋结构域和1个小的β-折叠结构域,α-螺旋结构域包含2个短的310螺旋和3个主要的α-螺旋,β-结构域包含3个链状反向平行β-折叠。两个结构域通过残基73和91之间的半胱氨酸桥连接在一起,形成Ca2+结合环,见图3[16]。
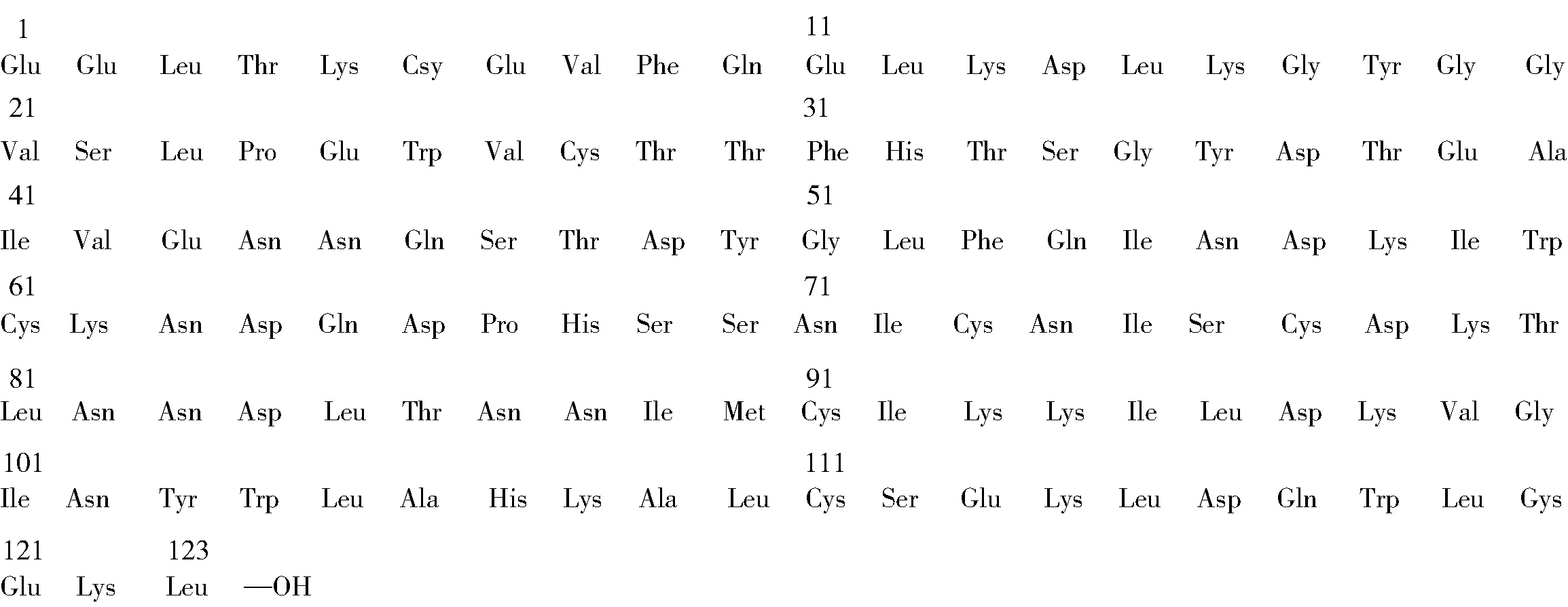
图2 牛乳α-乳白蛋白的氨基酸组成Fig.2 Amino acids composition of bovine α-lactalbumin
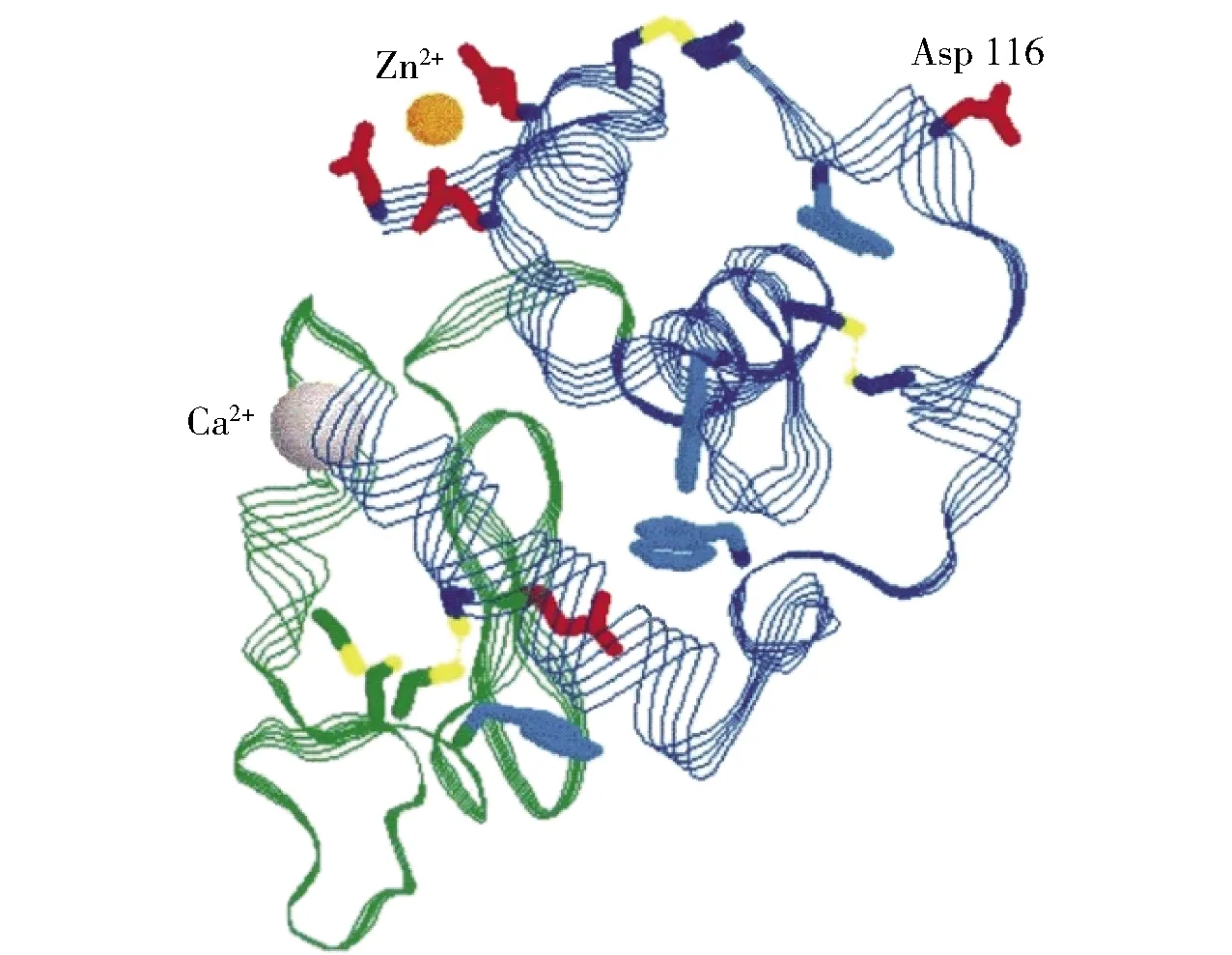
图3 牛乳α-乳白蛋白的立体结构Fig.3 3-Dimensional structure of bovine α-lactalbumin
2.2 α-乳白蛋白的功能特性
2.2.1缓解焦虑和改善睡眠质量
α-LA含有丰富的色氨酸,色氨酸是神经递质5-HT的合成前体,5-HT可以将信息传递到大脑的不同部位,发挥调节睡眠、缓解压力、改善食欲等功能。富含α-LA的饮食能够改善受试人群的抑郁情绪,减少婴幼儿哭闹和躁动的情绪[17]。睡眠障碍者入睡前摄入α-LA可以增加血浆色氨酸的含量,缩短入睡时间,次日可以降低瞌睡次数,提高注意力[18]。因此,α-LA对睡眠障碍患者具有较好的睡眠质量改善效果。
2.2.2改善糖脂代谢紊乱
α-LA可以降低高脂饮食诱导小鼠的体重增加、血清脂质水平上升以及肝脏脂质积累[19]。α-LA及其活性肽还可以通过上调肥胖小鼠肝脏中脂肪酸β-氧化和脂质分解相关基因表达水平,下调脂质合成相关基因表达水平,改善非酒精性脂肪肝[20-21]。以300 mg/kg的剂量对二型糖尿病大鼠干预α-LA,结果发现糖尿病大鼠葡萄糖清除能力显著提高,这与脂联素分泌水平呈正相关。而α-LA还可以提高骨骼肌和肝脏组织糖代谢水平,缓解机体的葡萄糖和胰岛素耐受性[19]。此外,利用碱性蛋白酶解α-乳白蛋白后,得到的酶解物可以激活小鼠脂肪组织IRS/Akt信号通路,改善小鼠的胰岛素抵抗。在体外实验中也发现这些乳蛋白肽具有较高的(dipeptidyl peptidase IV, DPP- IV)抑制活性[20],其作用机制是乳白蛋白肽可以与DPP- IV形成氢键、π-阳离子相互作用以及盐桥[22]。
2.2.3抗炎活性
给婴儿喂养富含α-LA的婴幼儿配方乳粉6个月后,特应性皮炎发生率较低,而在干预1~6个月间,对照组(即非富含α-LA的婴幼儿配方乳粉)粪便的分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)浓度显著下降,sIgA的下降程度与特应性皮炎呈显著正相关,与双歧杆菌的定殖水平呈负相关。α-LA可以通过抑制环氧合酶- 2和磷脂酶A2的活性,降低炎症因子IL- 6的表达,从而发挥抗炎特性[23]。α-LA酶解物在体内和体外都具有良好的抗炎特性,可以通过调节肠道菌群,降低血清炎症因子TNF- α、IL- 6和LPS水平,同时降低肠道TLR受体的表达,缓解机体的炎症状态[24-25]。
3 乳铁蛋白的结构和功能特性
3.1 乳铁蛋白的结构
乳铁蛋白(lactoferrin,LF)是一种由上皮细胞分泌的铁离子结合糖蛋白,存在于许多分泌物中,包括唾液、眼泪和乳汁。乳中LF的浓度因哺乳期和物种的不同而有很大的差异。人类初乳中LF的质量浓度大约为5 g/L,而成熟母乳中LF的质量浓度大约为2~3 g/L。牛初乳中LF质量浓度约为0.8 g/L,而成熟牛乳的LF质量浓度仅为0.03~0.49 g/L。LF分子质量约为78 kDa,人乳和牛乳中LF的氨基酸数分别为691和696,并且二者约有70%的氨基酸序列是一致的[26]。LF多肽链通过无规则卷曲和α-螺旋形成二级结构,在二级结构基础上折叠成包含两个球形的三级结构。这两个球形结构域分别是LF的N端和C端,每个结构域内均含有一个铁离子结合位点,见图4[26]。
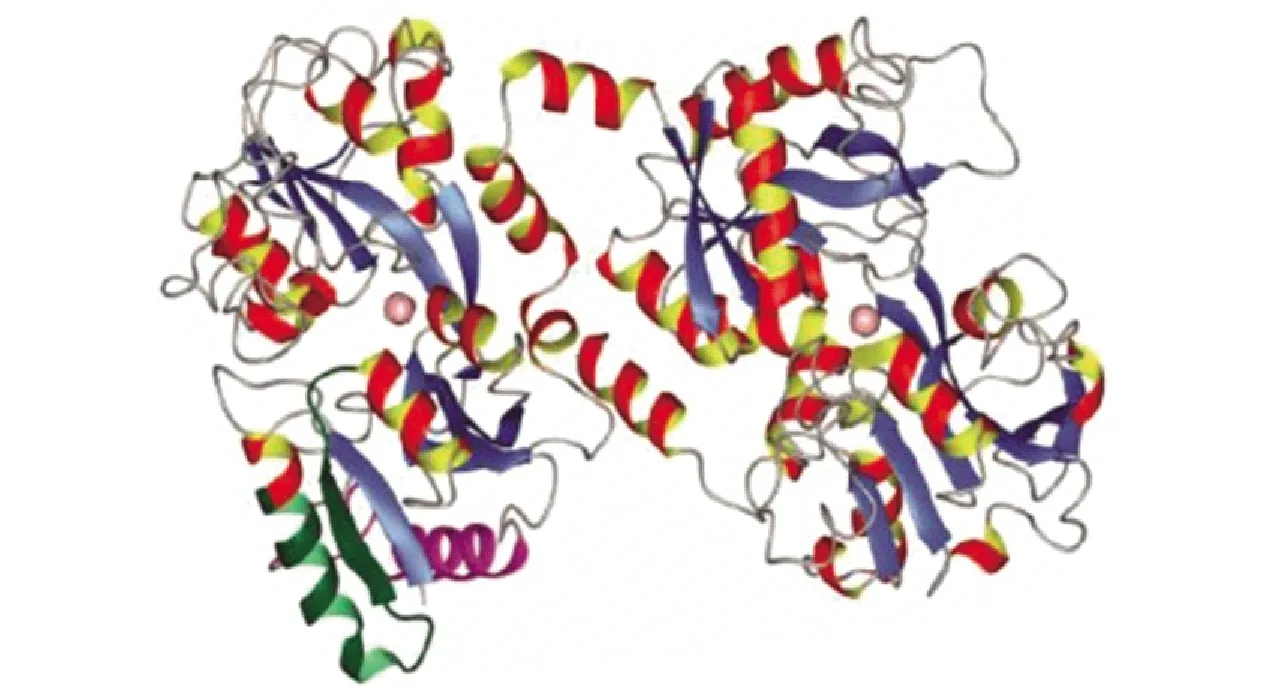
红黄色部分为α-螺旋结构,蓝色为β-折叠结构,两个粉色圆点为铁离子。图4 牛乳乳铁蛋白的三级结构Fig.4 Tertiary structure of bovine lactoferrin
3.2 乳铁蛋白的功能特性
3.2.1改善骨骼健康
LF能诱导成骨细胞的增殖和分化,抑制破骨细胞的形成,在骨代谢中发挥重要作用。LF可以促进MC3T3- E1前成骨细胞增殖,增强碱性磷酸酶活性,促进钙沉积,机制研究表明,LF及相关水解物可以与表皮生长因子受体的关键结构域发生相互作用,从而启动下游的信号通路[27]。动物实验表明,LF干预可以改善松质骨的质量,防止去卵巢大鼠的骨质减少,并增加骨密度,同时降低血清TNF- α和IL- 6的水平,增加血清降钙素含量[28]。以上结果表明,LF可以促进成骨细胞的分化进程,改善骨骼健康。
3.2.2抗菌和抗病毒活性
LF能够结合Fe3+,限制细菌对这类营养物质的利用,从而抑制细菌生长。此外,LF的N端阳离子区域可以与细菌表面受体产生静电相互作用,增加细菌细胞膜通透性,破坏细胞壁,起到杀菌的作用[29]。研究发现,LF对变形链球菌、表皮链球菌、大肠杆菌等多种病原菌的生长均有抑制作用。除抗菌活性外,许多研究表明LF能够阻断细胞受体或与病毒颗粒结合[30],对DNA和RNA病毒产生抗病毒活性。在感染过程的早期阶段,LF通过抑制病毒与宿主的相互作用发挥其抗病毒活性,包括疱疹病毒和乙型肝炎病毒等。LF还能直接对某些病毒的活性产生抑制作用,包括丙型肝炎病毒和艾滋病病毒等[31]。
3.2.3免疫调节功能
LF通过调节天然免疫(巨噬细胞、中性粒细胞、嗜酸性粒细胞、肥大细胞和NK细胞)和适应性免疫(树突状细胞、T细胞和B细胞)发挥其免疫调节功能。乳铁蛋白通过与CD14结合,激活TLR- 4介导的途径刺激免疫系统,从而降低促炎细胞因子TNF- α、IL- 1和IL- 6的水平。乳铁蛋白还能提高巨噬细胞的吞噬活性和自然杀伤细胞的杀伤活性[30]。此外,LF还可以诱导适应性免疫。LF通过活化抗原呈递细胞树突状细胞功能,在T细胞激活中发挥作用,进而调控T细胞分化[32]。
4 骨桥蛋白的结构和功能特性
4.1 骨桥蛋白的结构
骨桥蛋白(osteopontin,OPN)存在于多种组织和排泄物中,迄今为止发现乳汁中含量最高,是5种最丰富的母乳蛋白质之一。在早期哺乳阶段,人乳中OPN的含量约为138 mg/L,约占总蛋白的2.1%;在成熟乳中,OPN的含量约为57 mg/L,说明在不同的发育时期,婴儿对OPN的需求量是不同的[33]。
骨桥蛋白是一种翻译后被高度修饰的酸性糖蛋白,约含有300个氨基酸残基,富含天冬氨酸,并且存在O连接和N连接的寡糖。OPN包括RGD(Arg- Gly- Asp)和非RGD的整合素结合区域,以及CD44结合区;此外,OPN含有大量带负电荷的氨基酸以及磷酸化修饰位点,能够与乳汁中的钙离子结合形成水溶性复合物,与酪蛋白等一起抑制乳汁中磷酸钙的析出[34]。人乳OPN包括298个氨基酸残基,而牛乳OPN仅含有262个氨基酸残基,缺失人乳OPN氨基酸序列的188~209位氨基酸。但人乳和牛乳OPN氨基酸序列有182个相同的,相似度达61%,还有44个氨基酸残基结构是相似的,并且二者在同一区域均发生了O-糖基化[35],见图5[34]。因此,通过在婴幼儿配方乳粉中添加牛乳源的OPN能够在一定程度上减小婴幼儿配方乳粉和人乳在OPN含量上的差距。

图中黑色表示磷酸化位点,灰色表示糖基化位点;下划线表示整合素结合区域;方框表示蛋白酶水解区域。图5 人乳和牛乳骨桥蛋白的氨基酸组成差异Fig.5 Differences in OPN amino acid composition between human milk and cow milk
4.2 骨桥蛋白的功能特性
OPN存在于人的整个哺乳期,说明OPN在婴儿的发育过程中发挥着重要作用。目前,关于OPN的研究主要涉及肠道发育、免疫调节和脑发育等方面。
4.2.1促进肠道发育和改善肠道健康
乳源OPN可以在一定程度上抵抗婴幼儿胃肠道消化,完整的或部分消化的OPN可以被肠道上皮细胞内化,或直接和肠道上皮细胞上的整合素等受体结合,对肠道发育和肠道健康发挥调控作用。将野生型(wild-type, WT)乳鼠分为WT母鼠喂养组、OPN敲除母鼠喂养组和OPN敲除母鼠喂养并补充牛乳源OPN(bovine milk OPN, bmOPN)组,在出生后10 d,bmOPN补充组乳鼠的十二指肠绒毛高度和隐窝深度接近于WT母鼠喂养组乳鼠;在出生后30 d,bmOPN补充组乳鼠能够抵抗LPS诱导的炎症反应,说明外源补充bmOPN可以在一定程度上发挥母乳OPN相似的功能[36]。在对幼年恒河猴的研究中发现,普通配方乳粉喂养组恒河猴和母乳喂养的恒河猴小肠中有1 017个基因表达不同,但在配方乳粉中添加bmOPN可减少217个基因的差异,表明在配方乳粉中添加bmOPN,可使幼年恒河猴肠道基因表达情况更加接近于母乳喂养组[37]。除此之外,bmOPN还可以抑制促炎细胞因子分泌,降低肠炎评分,缓解DSS诱导的肠道炎症[38]。
4.2.2免疫调节活性
OPN是一种非常重要的巨噬细胞和T细胞的诱导剂,在调节正常的机体免疫反应过程中发挥了重要作用。临床实验研究表明,添加bmOPN的婴幼儿配方乳粉喂养的婴儿,血清促炎细胞因子TNF- α的水平显著降低,IL- 2的水平显著升高[39],升高的IL- 2 通过调节CD8+T细胞功能、促进胸腺中Treg细胞发育,调节机体的免疫反应[40];并且与普通婴配粉喂养组相比,OPN添加组婴儿外周循环中的T细胞比例明显增加[41],免疫细胞的形态更接近于母乳喂养组,婴儿发热的天数也更少[38]。动物实验研究表明,bmOPN补充能够显著增加早产乳猪小肠绒毛与隐窝深度的比值,增加血液中单核细胞和淋巴细胞数目,减少早产乳猪由LPS引起的腹泻发生率[42];用添加OPN的配方乳粉喂养乳鼠,其淋巴结中CD3+T细胞的比例显著高于普通配方乳粉喂养组,且CD3+和CD4+T细胞的比例更加接近于母乳喂养组,说明外源补充OPN能够促进CD3+T细胞的分化,改善乳鼠T细胞依赖的体液免疫反应[43]。
4.2.3促进脑发育
在生命初期,脑发育非常迅速并且可塑性强,对外界的环境因素以及营养水平都较为敏感。在生命早期补充bmOPN可以增加乳猪胼胝体、侧脑室等脑区域的体积,提高对新物体的识别能力,说明bmOPN能够在一定程度上促进生命早期神经发育[44]。此外,乳源OPN能够通过乳鼠的血脑屏障,不仅上调髓鞘碱性蛋白和髓鞘相关蛋白的表达,促进髓鞘的形成,并且还可以促进大脑中内源性OPN的合成[45]。而在小鼠的髓鞘再生进程中,脑星形胶质细胞的OPN表达升高,提示内源性OPN的合成可能与神经退行性疾病中的髓鞘再生有关[46]。
5 乳脂肪球膜的结构和功能特性
5.1 乳脂肪球膜的结构
乳脂在乳中以脂滴的形式存在,核心为甘油三酯,表面被一种由脂质双分子层和蛋白质组成的复杂三层膜结构包裹着,厚度约为10~50 nm,该膜结构即为乳脂肪球膜。与其他生物膜类似,乳脂肪球膜(milk fat globule membrane,MFGM)含有特异性膜蛋白、极性脂质和胆固醇等,其中膜蛋白占MFGM质量的25%~70%[47],通过蛋白组学发现其种类可达上千种[48]。MFGM的主要蛋白为嗜乳脂蛋白,约占MFGM蛋白的40%,其次是黄嘌呤脱氢酶/氧化酶,约占12%~13%,此外还存在少量的黏蛋白1、CD36、乳凝集素等[49]。MFGM脂质主要由中性脂质和极性脂质组成。中性脂质主要包括甘油三酯、甘油二酯、单甘油酯和胆固醇;极性脂质可分为甘油磷脂和鞘脂两类,其中,甘油磷脂包含磷脂酰胆碱(phosphatidylcholine, PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)、磷脂酰肌醇(phosphatidylinositol, PI)和磷脂酰丝氨酸(phosphatidylserine, PS)等,含量分别为19.2%~37.3%、19.8%~42%、0.6%~13.6%和1.9%~16%;鞘脂包含了鞘磷脂(sphingomyelin, SM,约占18%~34.1%)以及微量的葡萄糖神经酰胺、乳糖神经酰胺和神经节苷脂等[50]。
5.2 乳脂肪球膜的功能特性
5.2.1促进神经发育
动物实验和临床实验表明MFGM能够促进神经发育。2月龄婴儿分别喂养添加或不添加MFGM的标准配方粉至12月龄,发现MFGM能够提高配方粉喂养婴儿的认知评分,缩小母乳喂养和配方粉喂养婴儿之间的认知发展差距[51]。乳鼠出生后补充MFGM,通过提高其脑磷脂及代谢产物的含量,上调脑源性神经营养因子的表达,促进神经反射行为的成熟,并改善其成年后的认知能力[52-53]。此外,肥胖母鼠在孕期和哺乳期干预富含磷脂的MFGM能够改善其子代的神经发育,并对长期认知功能具有积极影响[54]。
5.2.2调节免疫和肠道健康
婴幼儿补充MFGM可降低急性中耳炎和腹泻的发生风险,减少配方粉喂养婴儿使用退烧药的概率,并对肺炎球菌疫苗的体液反应具有免疫调节作用[55-56]。后续通过代谢组发现补充MFGM能够增加婴儿血液循环中的氨基酸水平,降低微生物代谢产物氧化三甲胺以及促炎细胞因子IL- 2的水平[57],表明补充MFGM有助于调节婴儿代谢,增强免疫。MFGM还具有促进肠道发育的作用,MFGM可以调节乳鼠肠道菌群,促进配方粉喂养乳鼠的肠道增殖和分化,增加紧密连接蛋白表达,从而促进肠道黏膜屏障成熟[58]。基于MFGM对婴幼儿生长发育的改善作用,目前已作为一种功能性配料应用于婴幼儿配方乳粉的生产。
5.2.3调节糖脂代谢
饮食中添加富含MFGM的乳成分能够降低超重和肥胖人群的餐后胆固醇、炎症标志物和胰岛素反应,减轻高饱和脂肪酸膳食的负面影响[59]。在II型糖尿病小鼠模型中,MFGM干预通过激活肝脏和骨骼肌磷脂酰肌醇3-激酶/蛋白激酶B通路,促进糖原合成,改善糖代谢紊乱[60]。此外,MFGM可通过抑制脂肪生成并促进白色脂肪棕色化来预防高脂饮食诱导的肥胖[61],进一步在体外实验中探究机制发现,MFGM及其组分PC通过调控过氧化物酶体增殖剂激活受体α促进脂肪细胞棕色化[62]。
6 功能性乳源配料研发的建议
乳铁蛋白、α-乳白蛋白、骨桥蛋白、乳脂肪球膜蛋白等属于热敏性蛋白质,因此在其提取和加工应用过程中须注意保持其结构稳定性,以便于更好地发挥其生物学功能。乳源活性成分的绿色提取、活性保持和添加技术是功能性乳配料产业发展亟须解决的关键问题。目前,我国在功能乳配料的生产技术与活性保持技术还有待于进一步完善,亟须建立分离纯化核心技术,进行规模化生产,并进行临床营养评价,实现配方乳品核心配料国产化、精准营养。
7 结 论
乳中含有多种生物活性成分,是天然功能性因子的优质来源,利用乳源活性成分特有的生物学功能可以更好地开发婴幼儿配方乳粉,缩小婴幼儿配方乳粉与母乳之间的差距,也可以针对中老年人和慢性疾病患者等特殊群体开发功能性食品,提高其生活质量,促进健康老龄化。但是,目前有些活性成分的功能评价仍停留在动物模型阶段,因此,未来需要更多的临床和人群实验为其功能特性和安全性提供更加有力的证据。此外,乳源活性成分易受分离提取和加工方式的影响,因此,如何建立更加科学有效的分离技术和加工工艺,以最大限度地保持其原有的结构和生物学活性,仍是实现其产业化生产的主攻方向。

