超高效液相色谱指纹图谱结合化学计量学优选掌叶大黄饮片炮制工艺
张正,施文婷,莫秋怡,曹嵌,邓桂海,田清清,梁志毅
(广东一方制药有限公司,广东省中药配方颗粒企业重点实验室,广东佛山 528244)
大黄为蓼科大黄属植物,始载于《神农本草经》,至今已有1 000 多年的药用历史[1]。2020 年版《中国药典》以掌叶大黄﹑药用大黄﹑唐古特大黄的干燥根及根茎入药[2]。大黄味苦性寒,归脾﹑胃﹑大肝﹑心包经,有泻下攻积,清热泻火,凉血解毒,逐淤通经,利湿退黄的功效[3]。大黄中含有丰富的蒽醌类﹑蒽酮类﹑鞣质类﹑有机酸类﹑挥发油和多糖类成分[4–5],其中以蒽醌类成分研究最为广泛,游离型蒽醌主要有大黄酸﹑大黄素﹑大黄酚﹑芦荟大黄素﹑大黄素甲醚等,结合型蒽醌衍生物为游离蒽醌类的葡萄糖苷或双蒽酮苷,双蒽酮苷类包括番泻苷A﹑B﹑C﹑D﹑E﹑F 等[6]。现代药理研究表明,大黄具有调节胃肠道功能﹑保护心脑血管﹑保肝利胆﹑免疫调节﹑抗炎﹑抗病毒﹑抗肿瘤等作用[7–8]。
2020 年版《中国药典》一部大黄饮片项下炮制方法为“除去杂质,洗净,润透,切厚片或块,晾干”[2],缺乏具体的工艺参数,不利于大黄饮片的质量控制。关于掌叶大黄饮片炮制工艺的研究多以2020 年版《中国药典》一部大黄项下的质量控制指标为评价标准,较为单一,鲜见指纹图谱结合化学计量学研究掌叶大黄饮片炮制工艺的报道[9]。笔者通过建立UPLC(高效液相色谱)指纹图谱并结合相似度评价﹑聚类分析﹑主成分分析和方差分析,对不同润制时间﹑干燥方式﹑烘干温度及时间的掌叶大黄饮片进行质量评价,以期为掌叶大黄饮片具体炮制工艺参数的确定和质量控制提供依据。
1 实验部分
1.1 主要仪器与试剂
超高效液相色谱仪:Waters Arc 型,美国Waters公司。
电子天平:(1)XP26 型,感量为0.001 mg;(2)ME204E 型,感量为0.1 mg,瑞士METTLER TOLEDO 公司。
超纯水系统:Milli–Q Direct 型,德国Merck 公司。
高速中药粉碎机:111B 型,浙江瑞安市永历制药机械有限公司。
数控超声波清洗器:KQ–500DE 型,昆山市超声仪器有限公司。
电热恒温鼓风干燥箱:DHG–9146A 型,上海精宏实验设备有限公司。
没食子酸[批号:110831–201605,纯度(质量分数)为90.8%]﹑儿茶素[批号:110877–201604,纯度(质量分数)为99.2%]﹑番泻苷A[批号:110824–201702,纯度(质量分数)为95.2%]﹑番泻苷B[批号:110825–201603,纯度(质量分数)为95%]﹑芦荟大黄素[批号:110795–201710,纯度(质量分数)为98.3%]﹑大黄酸[批号:110757–201607,纯度(质量分数)为99.3%]﹑大黄素[批号:110756–201913,纯度(质量分数)为96%]﹑大黄酚[批号:110796–201922,纯度(质量分数)为99.4%]﹑大黄素甲醚[批号:110758–201817,纯度(质量分数)为99.2%]对照品:中国食品药品检定研究院。
大黄酚-8-O- 葡萄糖苷对照品:批号为CFS201801,纯度(质量分数)98%,武汉天植生物技术有限公司。
大黄素8-O-β-D-葡萄糖苷对照品:批号为18080601,纯度(质量分数)98%,成都普菲德生物技术有限公司。
甲醇:色谱纯,德国Merck 公司。
磷酸:色谱纯,天津市科密欧化学试剂有限公司。
实验所用其余试剂均为分析纯。
实验用水为超纯水。
大黄药材:批号为YG1906003,产地为甘肃,经广东一方制药有限公司魏梅主任药师鉴定为蓼科植物掌叶大黄的干燥根和根茎。
1.2 色谱条件
色谱柱:Waters CORTECS T3 色谱柱(150 mm×2.1mm,1.6μm,美国Waters 公司);流动相:乙腈(A)–0.1%磷酸溶液(B);梯度洗脱程序:0~5 min,3%~21%A;5~20min,21%~40%A;20~27 min,40%~50%A;27~40min,50%~58%A;40~50 min,58%~95%A;50~53min,95%~3%A;流量:0.25mL/min;柱温:30 ℃;检测波长:260nm;进样体积:1 μL[10–11]。
1.3 溶液配制
(1)混合对照品溶液的制备。精密称取没食子酸﹑儿茶素﹑番泻苷A﹑番泻苷B﹑大黄酚-8-O-葡萄糖苷﹑大黄素-8-O-β-D-葡萄糖苷﹑芦荟大黄素﹑大黄酸﹑大黄素﹑大黄酚﹑大黄素甲醚对照品适量,加入甲醇,配制成质量浓度均分别为6.603﹑5.321﹑8.950﹑
7.602﹑7.969﹑12.654﹑12.162﹑12.595﹑15.297﹑9.235﹑13.132 μg/mL 的混合对照品溶液。
(2)供试品溶液的制备。取掌叶大黄饮片粉末(过四号筛)约0.2g,精密称定,置于25mL 具塞锥形瓶中,精密加入甲醇10mL,超声处理(功率300 W,频率50 kHz)30min,取出,放冷,补重,滤过,取续滤液,即得。
2 结果与讨论
2.1 专属性试验
分别精密吸取空白溶剂﹑混合对照品溶液及供试品溶液,按1.2 项下色谱条件进样测定,色谱图如图1 所示,供试品溶液色谱在与对照品溶液色谱相应的保留时间处有相同的色谱峰,且空白溶剂无干扰,表明该方法专属性良好。
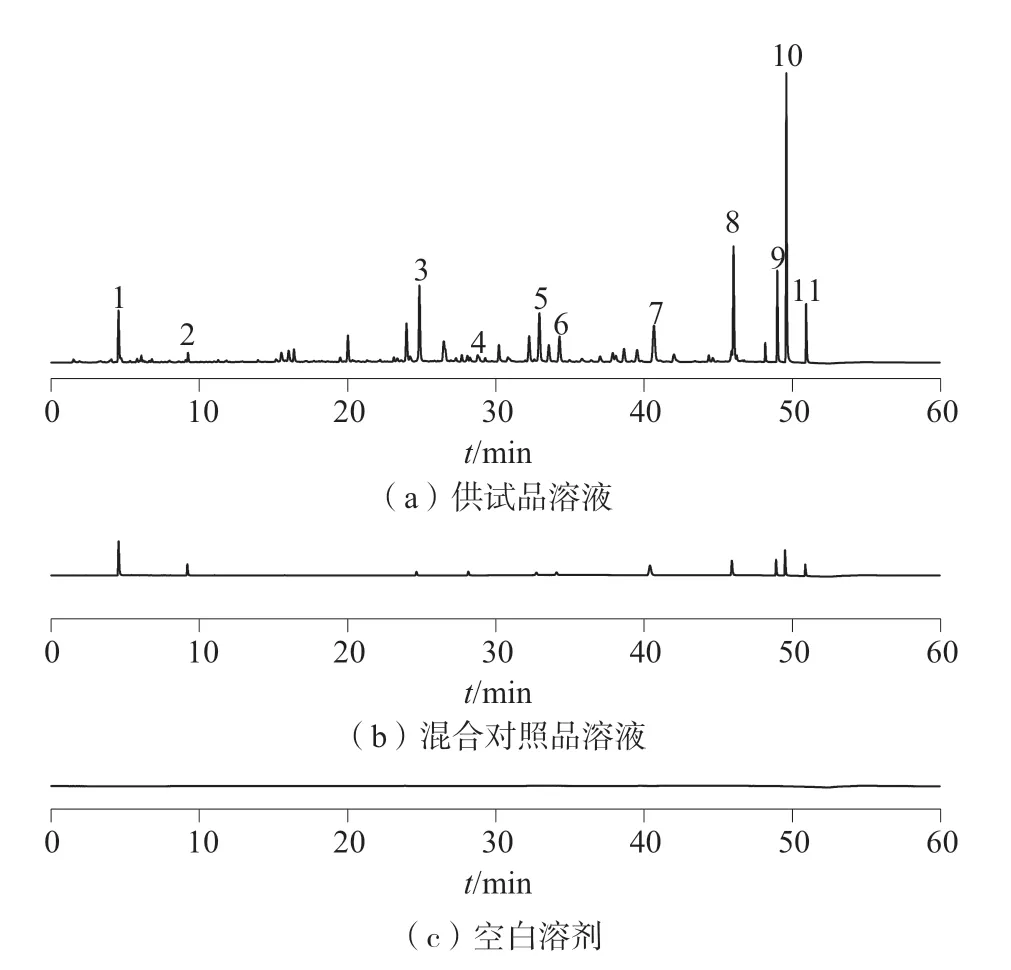
图1 专属性试验UPLC 色谱图
2.2 精密度试验
精密吸取按1.3 中混合对照品溶液,在1.2 色谱条件下连续进样6 次,以图1 中7 号色谱峰芦荟大黄素为参照峰,计算各特征峰的相对保留时间和相对峰面积RSD 均小于2.0%,表明仪器精密度良好。
2.3 重复性试验
取同一批供试品粉末,平行称定6 份,按1.3 中方法制备供试品溶液,在1.2 色谱条件下进样测定,以7 号色谱峰芦荟大黄素为参照峰,计算各特征峰的相对保留时间和相对色谱峰面积的相对标准偏差,结果均小于3.0%,表明该方法重复性良好。
2.4 稳定性试验
精密吸取1.3 中供试品溶液,按1.2 色谱条件分别在第0﹑2﹑4﹑6﹑8﹑12﹑24h 进样测定,以7 号峰芦荟大黄素为参照峰,计算各特征峰的相对保留时间和相对峰面积的相对标准偏差,结果均小于3.0%,表明供试品溶液在24h 内稳定性良好。
2.5 润制时间考察
2.5.1 指纹图谱的建立
取同一批掌叶大黄药材进行润制,分别于润制0﹑2﹑4﹑8﹑12﹑24﹑36﹑48h 取样(编号为S0~S7),切厚片,低温干燥,见表1。按1.3 方法制备供试品溶液,在1.2 色谱条件下进样测定。样品数据依次采用“中药色谱指纹图谱相似度评价系统”(2012)进行评价。
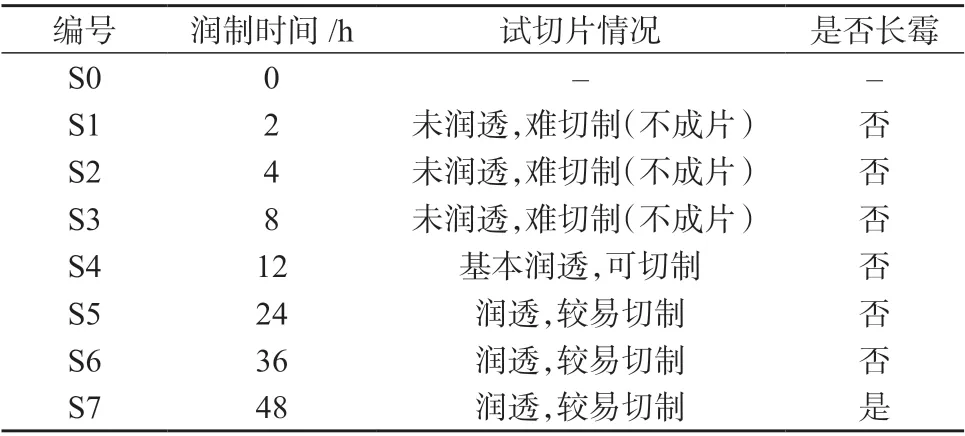
表1 掌叶大黄饮片不同润制时间考察
2.5.2 特征峰比较
计算不同润制时间掌叶大黄饮片UPLC 指纹图谱各共有峰的色谱峰面积–取样量比值(mV·s·mg–1),结果见表2。
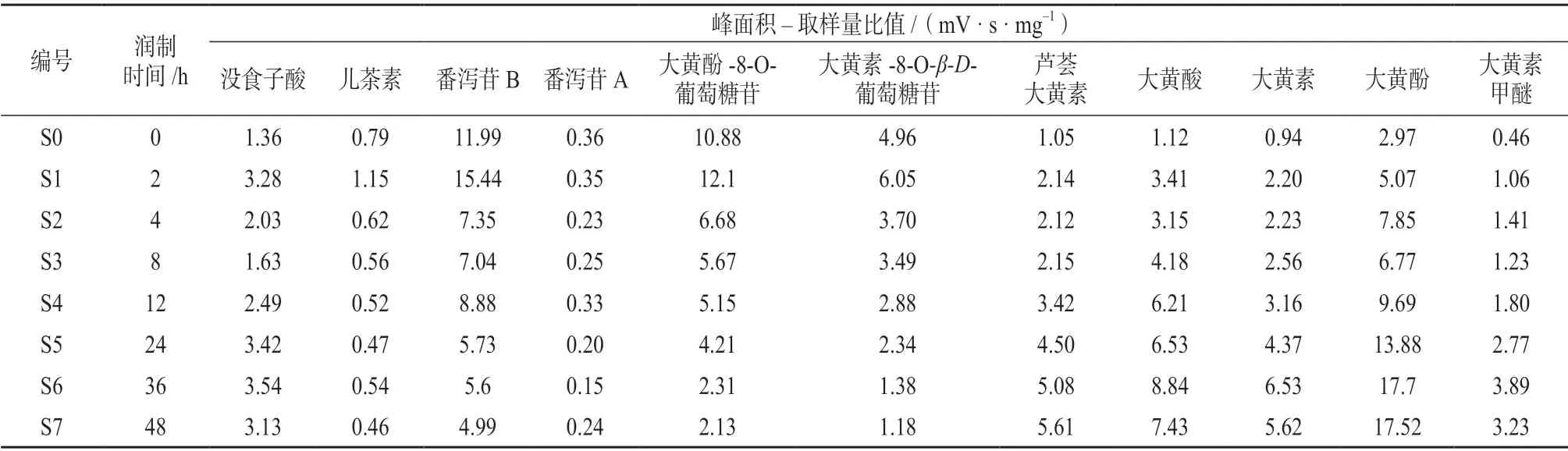
表2 不同润制时间掌叶大黄饮片的峰面积–取样量比值
由表2 可知,随着润制时间的延长,结合型蒽醌水解转变成游离蒽醌,导致芦荟大黄素﹑大黄酸﹑大黄素﹑大黄酚﹑大黄素甲醚的提取率呈上升趋势;掌叶大黄饮片中儿茶素﹑番泻苷A﹑番泻苷B﹑大黄酚-8-O-葡萄糖苷﹑大黄素-8-O-β-D-葡萄糖苷的提取率均呈下降趋势。表明润制时间对掌叶大黄饮片各指标成分的影响显著。
2.5.3 相似度评价
计算样品S1~S7 的指纹图谱与掌叶大黄药材(S0)指纹图谱的相似度,结果见表3。由表3 可知,润制2h 以内的掌叶大黄饮片与其药材的相似度大于0.95,而润制4h 以上掌叶大黄饮片与其药材的相似度均小于0.90。表明随着润制时间的延长,掌叶大黄饮片各指标成分的含量较药材的差异逐渐变大。
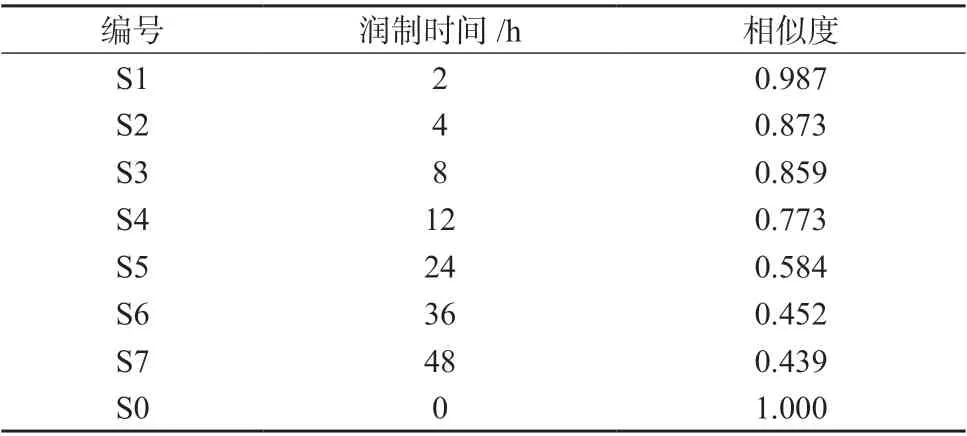
表3 不同润制时间考察掌叶大黄饮片指纹图谱相似度结果
2.5.4 聚类分析
采用SPSS 20.0 软件对各特征峰的峰面积–取样量比值进行聚类分析,建立不同润制时间掌叶大黄饮片的聚类分析树状图,结果如图2 所示。通过分析可将不同润制时间的掌叶大黄饮片聚为2 类,润制2﹑4﹑8﹑12h 与掌叶大黄药材聚为I 类,润制24﹑36﹑48h 聚为II 类。表明润制时间对掌叶大黄饮片指标成分含量的影响较显著。
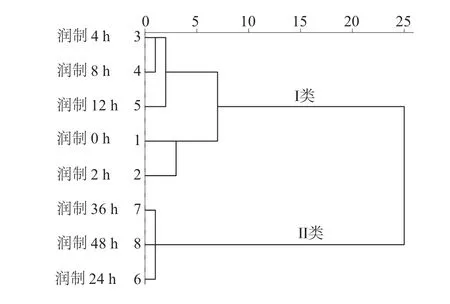
图2 不同润制时间时掌叶大黄饮片聚类分析(CA)树状图
2.5.5 主成分分析
采用SPSS 20.0 软件对掌叶大黄饮片11 个共有峰的峰面积–取样量比值进行因子分析,结果见表4﹑表5,成分因子分析图见图3。根据主成分的提取原则,取特征值大于1 对应的成分作为提取主成分[12],因子载荷值反映大黄各指标成分对主成分载荷的相对大小和影响的方向,数值反映原变量对因子影响的大小,正负代表方向的差别[13]。
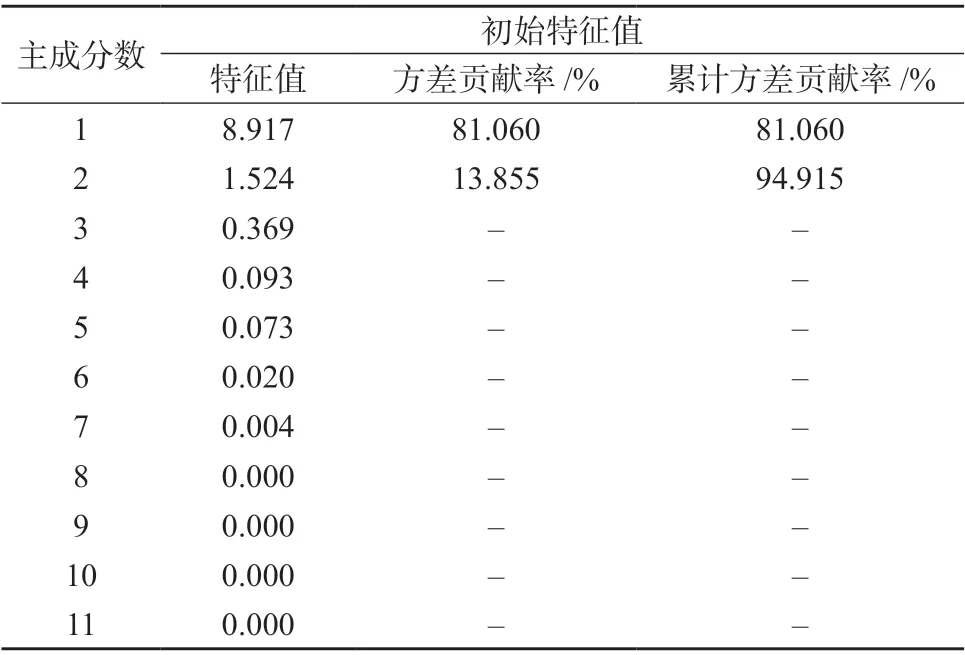
表4 主成分分析结果
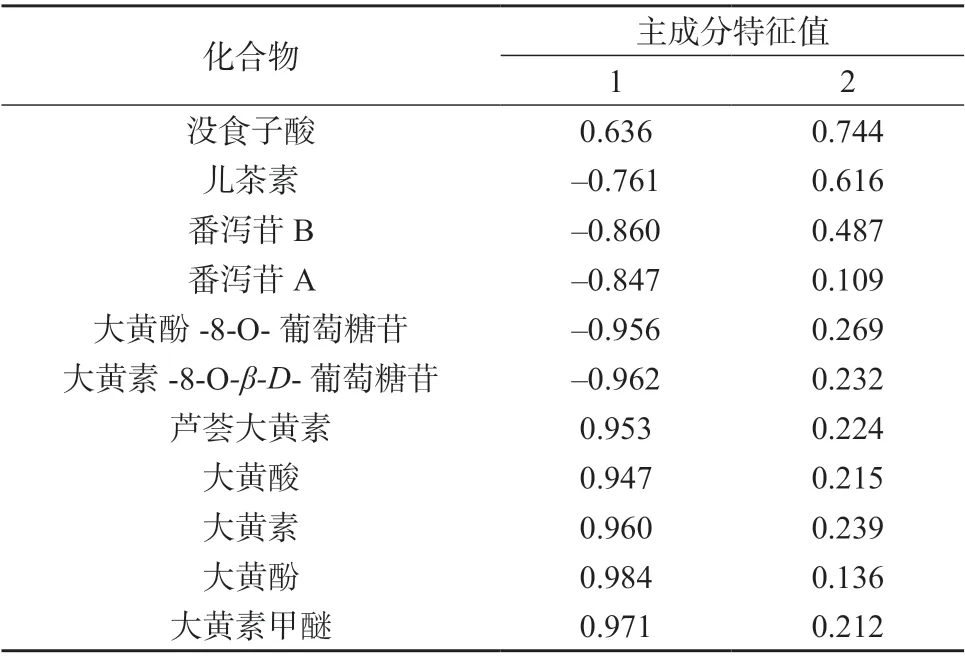
表5 主成分因子载荷矩阵
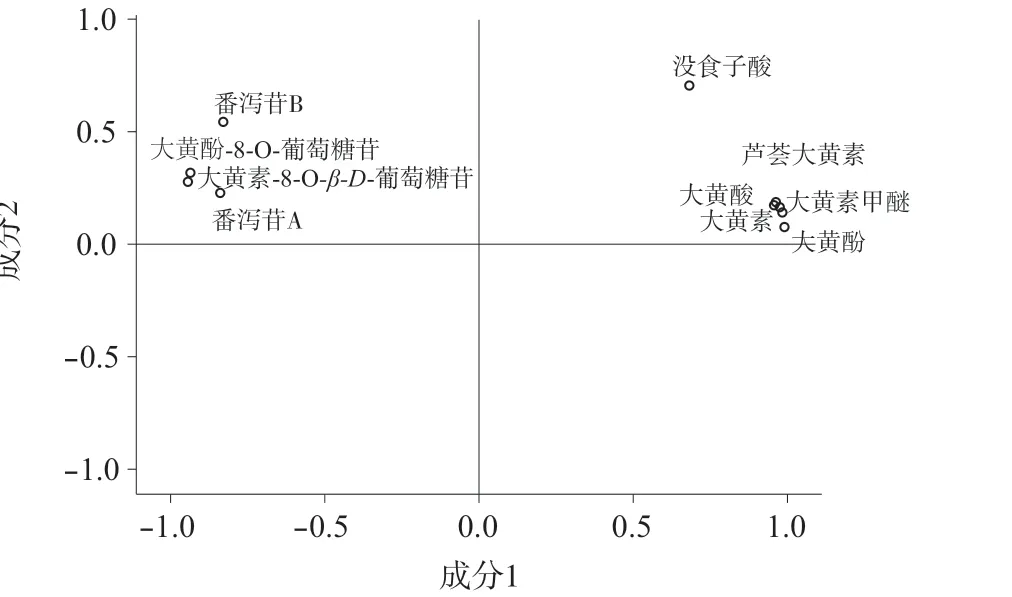
图3 主成分因子分析图
由表4﹑表5 及图3 可知,前两个主成分累积贡献率为94.915%,表明提取的2 个主成分基本能反映全部指标信息。主成分1 的特征值为8.917,方差贡献率为81.060%,儿茶素﹑番泻苷B﹑番泻苷A﹑大黄酚-8-O-葡萄糖苷﹑大黄素-8-O-β-D-葡萄糖苷为负相关,芦荟大黄素﹑大黄酸﹑大黄素﹑大黄酚和大黄素甲醚的载荷较高且均为正相关,表明其主要反映主成分1 的信息;主成分2 的特征值为1.524,方差贡献率为13.855%,没食子酸载荷较高且呈正相关,表明其主要反映主成分2 的信息。上述对掌叶大黄饮片指纹图谱差异贡献较大的成分,可能是掌叶大黄饮片炮制过程中含量变化的关键成分。
2.5.6 综合评分
综合评分由公式Fi=a1X1+a2X2+…….+ajXm(a为特征值,由成分矩阵中的第j列载荷除以对应成分特征值的算术平方根所得,X为原始指标)计算[13–14],计算得到F1﹑F2两个主成分的表达式。将原始指标进行标准化处理,从而得到综合评分函数(F=0.810 60F1+0.138 55F2,其中F1和F2为2 个主成分的得分,系数为各成分的方差贡献率),即综合评分,结果见表6。由表6 可知,当掌叶大黄饮片润制36h 后,其综合评分最高,表明掌叶大黄饮片的最佳润制时间为36h。

表6 不同润制时间考察掌叶大黄饮片综合评分结果
2.6 干燥方式考察
2.6.1 指纹图谱的建立
取同一批掌叶大黄药材润制36h 后,切厚片,分成三份,分别采用晾干﹑晒干﹑烘干(60 ℃)三种干燥方式进行干燥(编号分别为S8~S10),按1.3 方法制备供试品溶液,在1.2 色谱条件下进样测定。不同干燥方式的掌叶大黄饮片的样品数据依次采用“中药色谱指纹图谱相似度评价系统”(2012)进行评价。
2.6.2 相似度评价
计算样品S8–S10 的指纹图谱与掌叶大黄饮片润制36h(S6)指纹图谱的相似度,结果见表7。由表7 可见,各样品相似度均大于0.95。

表7 不同干燥方式的掌叶大黄饮片指纹图谱相似度结果
2.6.3t检验分析
3 份掌叶大黄饮片各特征峰的峰面积–取样量比值结果见表8,采用SPSS 20.0 软件对其进行独立样本–t检验分析。结果表明,不同干燥方式对掌叶大黄饮片的各成分含量无显著性差异(P>0.05)。结合生产实际考虑,确定掌叶大黄饮片的最佳干燥方式为烘干。
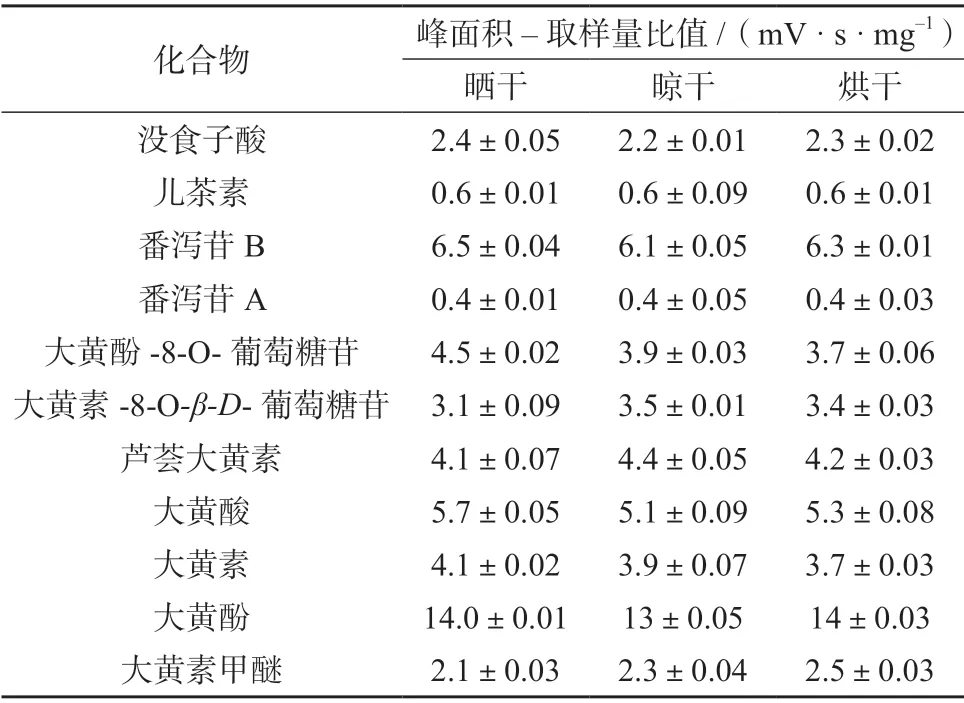
表8 不同干燥方式的掌叶大黄饮片色谱峰结果(n=2)
2.7 不同烘干温度和烘干时间考察
2.7.1 指纹图谱的建立
取同一批掌叶大黄药材润制36h 后,分别置于40﹑55﹑70 ℃鼓风烘箱内烘干,于干燥4﹑8﹑12﹑24h时取样(编号分别为S11~S22,见表9),按1.3 方法制备供试品溶液,按1.2 色谱条件进样测定。不同烘干温度和烘干时间的掌叶大黄饮片样品数据依次采用“中药色谱指纹图谱相似度评价系统”(2012)进行评价。
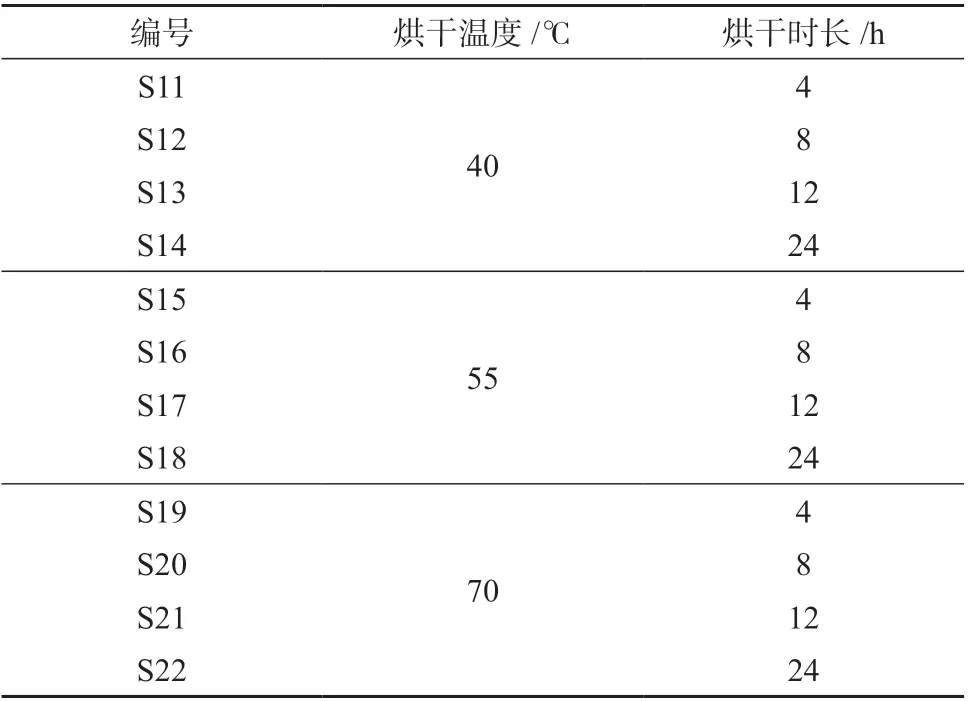
表9 掌叶大黄饮片不同烘干温度及时间考察
2.7.2 相似度评价
计算样品S11~S22 的指纹图谱与掌叶大黄饮片润制36h(S6)指纹图谱的相似度,结果见表10。由表10 可见,各样品相似度均大于0.95。
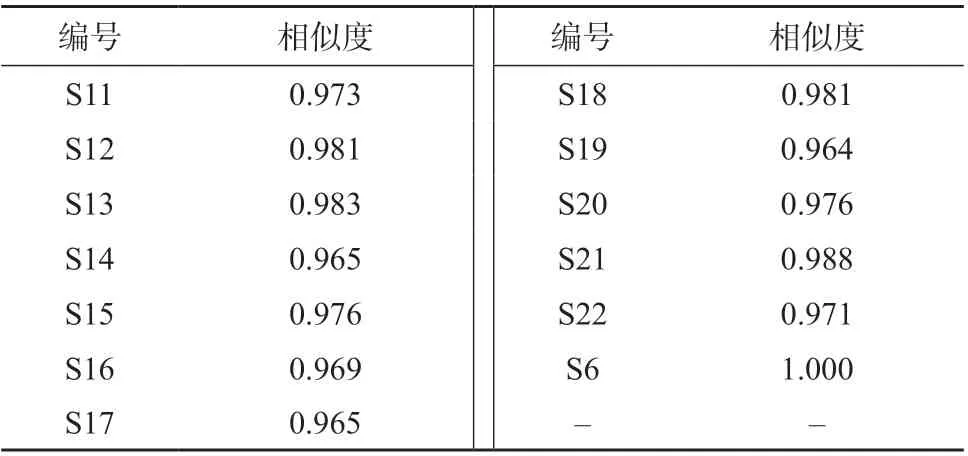
表10 不同烘干温度及时间的掌叶大黄饮片指纹图谱相似度结果
2.7.3t检验分析
12 份掌叶大黄饮片各特征峰的峰面积–取样量比值结果见表11,采用SPSS 20.0 软件对其进行t检验分析。结果表明,不同干燥方式对掌叶大黄饮片的各成分含量无显著性差异(P>0.05)。结合各实验组饮片的水分结果,为提高生产效率,降低生产成本,确定掌叶大黄饮片烘干工艺参数为50~70 ℃干燥8~12h。
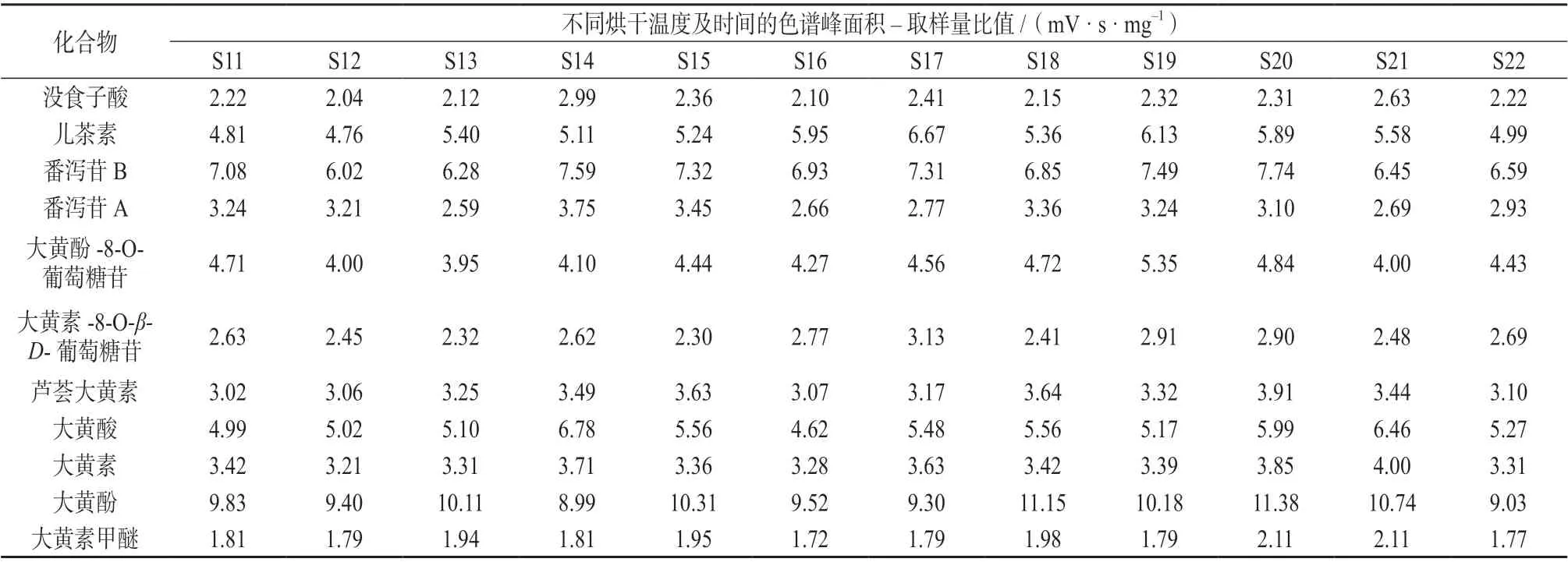
表11 不同烘干温度及时间的掌叶大黄饮片色谱峰面积–取样量比值(n=2)
2.8 掌叶大黄饮片炮制工艺验证试验
根据优选的掌叶大黄饮片炮制工艺参数,称取三份掌叶大黄药材,每份约200g,进行三份平行验证试验,分别润制36h 后,切厚片,于70 ℃下烘10 h,将测得的数据代入数据组中进行分析,结果见表12。三份验证的各特征峰峰面积–取样量比值的RSD 值均小于3%,其综合评分分别为35.94﹑36.23﹑36.07,表明优选的掌叶大黄饮片炮制工艺稳定可行。
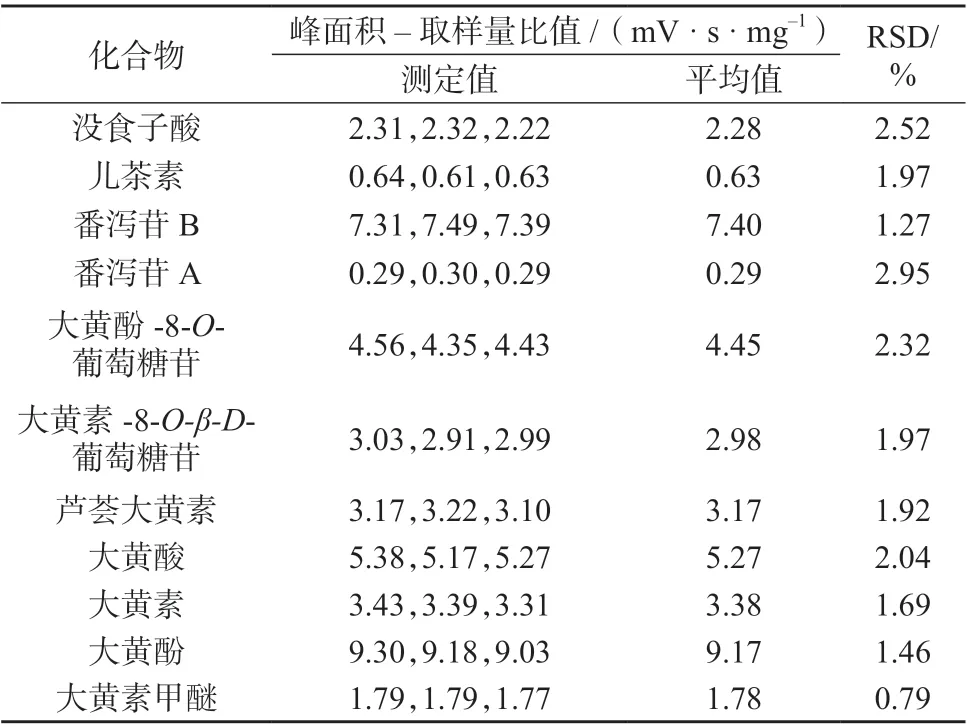
表12 验证试验结果(n=2)
3 结语
优选的掌叶大黄饮片最佳炮制工艺:润制36h,切厚片,50~70 ℃干燥8~12h。研究表明润制时间对掌叶大黄饮片的各指标成分含量影响显著,相关文献表明,大黄中的游离型蒽醌类成分与其“清热解毒”功效呈正相关[15–16],结合型蒽醌类成分则与其“泻下攻积”功效呈正相关[17–18],故临床应用可根据证候结合药理作用,调整掌叶大黄饮片炮制过程中的工艺参数,提高治疗的针对性。此外,不同干燥方式﹑不同的烘干温度及时间对掌叶大黄饮片各指标成分的含量影响并不明显。2020 年版《中国药典》中规定掌叶大黄饮片的干燥方式为“晾干”,但晾干耗时长,物料长时间暴露在空气中,易发生氧化降解和霉变,而烘干不受外界因素影响,且能缩短干燥时间,降低劳动强度,提高生产效率,更适用于掌叶大黄饮片的工业生产[19]。
中药有效成分在炮制过程中充分的保留是保证中药临床疗效发挥的重要前提,影响掌叶大黄饮片炮制工艺的因素众多,本研究参照2020 年版《中国药典》一部﹑各种炮制规范及相关文献,对掌叶大黄饮片的炮制工艺参数进行研究,优选出科学﹑合理﹑稳定﹑可行的掌叶大黄饮片炮制工艺参数,为工业化生产质量一致的掌叶大黄饮片提供参考。同时也为唐古特大黄饮片和药用大黄饮片的炮制工艺研究奠定了基础。

