猪肉冻干粉中克伦特罗标准物质的制备
董喆,曹进,胡越,孙磊,罗娇依,李梦怡
(中国食品药品检定研究院,北京 100050)
标准物质(RM)是一种已经确定了具有一个或多个足够均匀的特性值的物质或材料,作为分析测量行业中的“量具”,在校准测量仪器和装置﹑评价测量分析方法﹑测量物质或材料特性值和考核分析人员的操作技术水平等领域有着不可或缺的作用[1–4]。
克伦特罗俗称“瘦肉精”,它既不是兽药,也不是饲料添加剂,但因其对牲畜有明显的促进生长﹑减少脂肪沉积﹑提高瘦肉率的作用,近年来作为“瘦肉精”被非法添加到动物饲料中。但研究表明,人吃了含有克伦特罗的畜产品会造成食物中毒,严重危害身体健康[5–6]。2010 年,全国食品安全整治办公室发布《食品中可能违法添加的非食用物质和易滥用的食品添加剂名单(第四批)》的通知(整顿办函〔2010〕50 号)中将其列入食品中可能违法添加的非食用物质名单(第四批),然而在经济利益驱动下,“瘦肉精”事件依然时有发生。
为监控实验室克伦特罗的检测能力,保证检测结果有效可靠,且具有溯源性﹑可比性和准确性,笔者研制了猪肉冻干粉中克伦特罗成分分析标准物质。该标准物质可用于相关检测实验进行克伦特罗分析方法的确认和过程质量控制,并保证测试分析量值溯源链的有效性和不间断性,同时为研制食品基质标准物质提供了可操作的流程实例[7–8]。
1 实验部分
1.1 主要仪器与试剂
液相色谱串联质谱仪:TQ–S 型,美国Waters 公司。
电子天平:AL204 型,感量为0.1 mg,瑞士METTLER 公司。离心机:HC–3018R 型,中佳科学仪器有限公司。pH 计:SevenEasy 型,瑞士METTLER 公司。盐酸克伦特罗标准物质:质量分数为99.3%,德国Dr.E 公司。
盐酸克伦特罗–D9 标准物质:质量分数为99.9%,德国Dr.E 公司。
甲醇﹑甲酸:质谱级,美国Thermo Fisher 公司。
乙酸钠﹑氯化钠﹑氢氧化钠﹑高氯酸﹑氨水﹑异丙醇﹑乙酸乙酯:均为分析纯,国药集团化学试剂有限公司。
实验用水为GB/T 6682 规定的一级水。
1.2 样品制备
活猪(体重约100 kg)饲喂至稳定状态后,采用大腿肌肉注射法给药,每天注射浓度为10 mg/mL的盐酸克伦特罗溶液1 mL,持续注射17 天,分别在第3﹑5﹑7﹑10﹑15﹑17 天检测猪血清中克伦特罗含量,猪血清中克伦特罗含量体内变化如图1 所示,17 天后猪血清中克伦特罗含量基本稳定。

图1 猪血清中克伦特罗含量体内变化图
宰杀活猪,将猪各部分器官(如心﹑肝﹑脾﹑肺﹑肾)分离后取猪肉部分,匀浆,冻干,粉碎研磨,过250 μm 筛网数遍,混匀后进行均匀性初检,制备的阳性猪肉冻干粉中克伦特罗含量为87 μg/kg。
将上述制成的阳性克伦特罗猪肉冻干粉,按照1∶7 的比例与阴性猪肉冻干粉混合均匀,制备成中间浓度猪肉冻干粉;再将中间浓度猪肉冻干粉,按照1∶8 的比例与阴性猪肉冻干粉混合均匀,制备成猪肉冻干粉中含克伦特罗基质标准物质(含量约为1.0 μg/kg),经过均匀性初筛后,分包装为2 g/瓶样品,以塑料瓶密闭冷冻保存。
1.3 实验方法
参考GB/T 22286—2008 《动物源性食品中多种β-受体激动剂残留量的测定》[9],同时查阅相关检测方法文献[10–11],对猪肉中克伦特罗的含量测定方法进行提取和净化步骤的优化,最终确定本研究的检测方法。
1.3.1 标准溶液的制备
精密称取盐酸克伦特罗11.3 mg(精确至0.01 mg),用甲醇溶解并定容至10 mL,配制成浓度约为1 000 μg/mL 的标准储备液。取标准储备液,逐级稀释成含克伦特罗0.1﹑0.5﹑1﹑2﹑5﹑10 μg/L 以及盐酸克伦特罗–D9 内标10 μg/L 六个浓度梯度。
1.3.2 样品处理
样品复原:称取约0.4 g 样品于50 mL 离心管中,精密加入4 倍质量的水复溶至肉糜状,相当于约2 g 肉糜样品,振摇使其充分混匀,待测。
提取与净化:向上述复原肉糜样品中加入8 mL乙酸钠缓冲液,充分混匀加盖置于水平振荡器振荡15 min,离心10 min(5 000 r/min)。取离心上清液4 mL,添加100 μL (100 ng/mL)盐酸克伦特罗–D9内标工作液,充分振荡,加入0.1 mol/L 高氯酸溶液5 mL,混合均匀,用高氯酸调节至pH 1。离心10 min 后,将全部上清液转移到新离心管中,用10 mol/L 的氢氧化钠溶液调节至pH 11。加入10 mL 饱和氯化钠溶液和10 mL 异丙醇–乙酸乙酯(体积比为6∶4)混合溶液,充分提取,再离心,转移全部有机相,在40 ℃水浴下用氮气将其吹干。加入5 mL乙酸钠缓冲液,超声混匀,使残渣充分溶解后,上阳离子交换柱。将小柱连接到真空装置上,依次用2 mL 水,2 mL 2%甲酸水溶液和2 mL 甲醇洗涤柱子并彻底抽干,最后用2 mL 的5%氨水甲醇溶液洗脱柱子上的待测成分。流量控制在0.5 mL/min,洗脱液在40 ℃水浴下用氮气吹干。准确加入1.0 mL 0.1%甲酸溶液–甲醇(体积比为95∶5),超声混匀。将溶液转移到1.5 mL 离心管里,以15 000 r/min离心10 min。上清液过0.22 μm 膜后,供液相色谱串联质谱测定。
1.3.3 仪器工作条件
(1)色谱条件。
色谱柱:Waters HSS T3柱(50 mm×2.1 mm,1.8 μm,美国Waters 公司);流动相:A(0.1%甲酸溶液)和B(含0.1%甲酸的乙腈溶液)组成;洗脱梯度:0~1 min(95% A),1~3 min(95%~5% A),3~4.5 min(5%A),4.5~5 min(5%~95% A),5~7 min(95% A);流量:0.3 mL/min;柱温:35 ℃;进样体积:5 μL。
(2)质谱条件。
离子源:电喷雾ESI 正离子模式;扫描模式:多反应监测(MRM);离子源温度:230 ℃;毛细管电压:3.5 kV;去溶剂气流量:800 L/h;去溶剂气温度:400℃;克伦特罗测定离子:m/z277,203(定量离子),m/z277,259(定性离子);克伦特罗–D9 内标测定离子:m/z286,204(定量离子)。
1.3.4 结果计算
以克伦特罗与内标物的色谱峰面积比值为纵坐标,以克伦特罗与内标浓度的比值为横坐标进行线性回归,建立标准曲线,测定样品中目标物的含量。
1.4 样品均匀性和稳定性考察
参照CNAS GL03—2018《能力验证样品均匀性和稳定性评价指南》﹑CNAS GL 29—2010 《标准物质/标准样品定值的一般原则和统计方法》[12–13]中关于均匀性﹑稳定性检验的要求进行统计。
均匀性检验:当实验总样本数小于500 个时,随机抽取15 个样品进行均匀性测定,每个样品平行测定2 次。采用单因素方差分析评定样品的均匀性。
稳定性检验:按照先密后疏的原则设置不同的采样时间点,采用同步稳定性评估方法进行稳定性分析。以均匀性检测结果为长期稳定性0 点,按推荐方式储存样品。分别在第1﹑2﹑4﹑6 月取样,每次取4 份样品,每份样品检测2 次。采用回归分析评定样品的稳定性。
1.5 计量溯源
计量溯源性是确保标准物质定值结果能够在不同时间与空间保持可比的关键。有证标准物质(CRM)具有一种或多种足够均匀和很好地确定了的特性,用以校准测量装置﹑评价测量方法或给材料赋值的一种材料或物质[14]。此次定值采用英国政府化学家实验室研制的标准物质进行标准曲线的绘制,确保量值的可溯源性。
1.6 定值方法
参考JJF 1343—2012 《标准物质定值的通用原则及统计学原理》﹑ISO GUIDE 35: 2017 《Reference materials—Guidance for characterization and assessment of homogeneity and stability》[15–16],采用一种方法多家实验室联合定值的方式,稳健的统计方法定值。
选择其它7 家行业领域经验丰富且经国家认证的检测实验室或检测中心。分别向每个定值实验室提供猪肉冻干粉空白样品和阳性样品各不少于4 份,每个样品分别平行测定2 组数据。各定值机构提供不少于8 组测量数据。同时,定值过程中,标准物质研制单位制定了明确的定值方案,并要求进行随行质量控制,以确保各实验室定值结果可靠﹑稳定。
回收定值检测结果后,对每一组独立测量结果采用格拉布斯(Grubbs)检验进行离群值检验,采用狄克森(Dixon)检验对组间数据进行离群值检验。剔除离群值后,采用Kolmogorov-Smirnor(KS)检验对所有数据进行正态分布检验。在符合正态分布的情况下,计算出各实验室检测结果中位值的中位值,该总体中位值即样品的定值结果。
1.7 不确定度的评定
对于标准物质来说,其定值结果的不确定度由3 部分组成:标准物质的均匀性引起的不确定度,标准物质的稳定性引起的不确定度以及标准物质的定值过程带来的不确定度。将上述3 部分不确定度按照相对不确定进行合成,记为uCRM。该合成标准不确定度乘以包含因子k(置信水平为95%,k=2)得出标准物质的扩展不确定度,记为U。
1.7.1 指定值的不确定度计算
计算各协作单位结果的中位值与标准物质指定值的绝对差值,记为Qi,Q1,Q2…Qn的中位值记为QM。则协作定值的不确定度按式(1)计算。
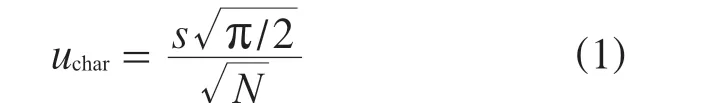
其中:uchar——协作定值引入的不确定度;
N——协作标定的实验室个数;
s——正态分布的标准偏差,s=QM/0.674。

2 结果与讨论
2.1 均匀性检验结果
按1.4 进行均匀性检测,采用单因素方差分析方法对样品测定结果进行数据统计。克伦特罗含量测定结果如表1 所示,F检验分析结果如表2 所示。样品的F计算值小于F临界值,表明样品均匀性良好。

表1 猪肉冻干粉样品中克伦特罗含量测定结果 μg/kg

表2 猪肉冻干粉样品中克伦特罗含量测定方差分析结果
2.2 稳定性检验结果
按1.4 进行稳定性考察,结果见表3。对表3 检测结果以时间–浓度做线性拟合,并做回归方差分析,结果见表4。由表4 可知,在95%的置信水平下,斜率的P>0.05,说明样品在考察期限内稳定性良好。

表3 猪肉冻干粉样品中克伦特罗稳定性检测结果

表4 猪肉冻干粉样品中克伦特罗稳定性检验回归方差分析
2.3 协作定值结果及离群值检验
按照“1.3.2 定值方法”发放协作定值样品,回收各协作单位定值检测结果,见表5。其中,单位A~F 返回8 个检测数据,单位G 返回了10 个检测数据。采用格拉布斯法进行组内可疑值检验,νi/S均小于λ(α,n)查表值,未观测到组内离群值;采用狄克森检验对组间数据进行离群值检验,r值均小于f(α,n)查表值,未观测到组间离群值,可保留所有数据;采用KS 检验对所有数据进行正态分布检验,P值为0.101,符合正态分布。协作定值结果直方分布图见图2.

表5 协作定值结果 μg/kg

图2 协作定值结果直方分布图
2.4 定值不确定度的计算
按“1.7 不确定度的评定”所述方法进行定值不确定度计算。定值过程﹑均匀性﹑稳定性引入的不确定度及相对合成不确定度计算结果见表6﹑表7。按95%的置信区间,取k=2,按公式(6)计算标准物质的扩展不确定度,结果为0.075 μg/kg。

表6 协作定值结果计算 μg/kg

表7 相对不确定度计算结果
2.5 猪肉冻干粉中克伦特罗标准物质的定值结果
经过均匀性检验,6 个月内的4 个月次的稳定性检验和8 家实验室协作定值,最终确定猪肉冻干粉中克伦特罗基质标准物质的定值结果为(0.927±0.075) μg/kg(k=2,以复原后的肉糜计)。
2.6 标准物质研制方法探讨
2.6.1 样品制备方法选择
猪肉中克伦特罗基质标物的制备一般采用阴性猪肉加入一定浓度的克伦特罗溶液完成,但该过程与实际的饲料喂养差别较大。因此本研究采用活体注射给药的办法,使药物能够参与到体内的代谢过程,与实际的市售阳性猪肉更为相似,同时也可以缩短喂养方式制备基质标物的时间,是基质标物制备技术的一种新的探索。同时,考虑到猪肉含水率很高,为保证在储存过程中基质不变质和目标物含量的稳定,最终采用冷冻干燥方式制备成冻干粉使用。
2.6.2 方法准确度检测
在标准物质定值过程中,测定方法的准确性是标准物质定值的基本要求。笔者参考GB/T 22286—2008 《动物源性食品中多种β–受体激动剂残留量的测定》对克伦特罗含量进行测定,通过阴性样品和标准品色谱图比对确定样品基质对待测组分无干扰,用加标回收率考察样品的提取和净化过程,通过同位素内标消除基质效应。方法学结果表明,克伦特罗在0.04~10 ng/mL 范围内线性关系良好,相关系数大于0.998,加标回收率范围为98%~109%,精密度偏差小于3%,表明该方法准确可靠,可用于猪肉冻干粉中克伦特罗的定值研究。
2.6.3 定值方法选择
在以往的标准物质定值研究中,通常计算多家实验室结果的总体平均值及其标准偏差,采用总体平均值作为定值结果,采用标准偏差计算指定值的A 类不确定度。笔者采用了一种稳健的统计定值方式,即使用总体的中位值作为定值结果,可以减少个别极端值对整体定值结果的影响,是标准物质定值的一种新的尝试。
3 结语
采用活体注射给药法制备了猪肉冻干粉中克伦特罗基质标准物质,通过对其溯源性﹑准确性﹑均匀性﹑稳定性和不确定性研究,最终确定该样品中克伦特罗含量结果为(0.927±0.075) μg/kg(k=2,以复溶后肉糜计)。本标准物质满足猪肉冻干粉中克伦特罗检测基体参考物质的使用条件,可用于相关检测实验进行克伦特罗分析方法的确认和过程质量控制,并保证测试分析量值溯源的有效性和不间断性。

