长江源区高寒沼泽草甸植物对增温的生理响应及适应性评价
冯 月, 白 炜, 张景然, 房佳辰, 曾红丽
(兰州交通大学环境与市政工程学院, 甘肃 兰州 730070)
全球变暖正在改变陆地生态系统的结构和功能,造成的负面和潜在影响已受到世界各国政府和科学家的重点关注。IPCC报告表明,近百年来全球平均地表温度升高了0.85℃,并预测到2100年将升高0.3~4.8℃,高纬度或高海拔地区的增幅更明显[1-2]。青藏高原平均海拔超过4 000 m,自然条件严酷,生态系统极为脆弱,极易受到气候变暖和人类活动的影响。青藏高原因自身独特的自然环境特征被称为全球气候变化的触发器,其隆起和抬升形成了独特的高原季风系统,并对周边地区乃至全球的气候具有强烈影响[3-4]。温度作为高寒植物生长的主要限制性因子[5],其变化会对多年冻土、活动层土壤水分状态等造成强烈影响,使得地气间雪盖层和植被的水热平衡发生变化,引起植物生理特性的改变[6],进而影响植物生长,推动植物群落和物种组成发生变化[7],影响高寒生态系统的稳定性[8-9]。沼泽化草甸是一个非常独特的生态系统,以莎草科等植物为优势种,涵盖湿地和草原所具有的结构和功能,是青藏高原分布较为广泛的草地生态系统[10]。但随着气候变暖程度加重,青藏高原草地生态系统的空间分布格局也随之变化,表现为高寒草原分布面积增加,而高寒沼泽草甸显著退化[11],因此研究高寒沼泽生态系统对气温升高响应特征及其内在机制具有重要的独特性和前瞻性。
目前,针对本研究关注的沼泽草甸生态系统,相关研究多集中在温度变化对沼泽草甸植物群落组成[12-13]、物种多样性[14-15]和生物量[16-18]等方面的影响,而对沼泽草甸植物生理响应关注较少。仅对群落结构和功能等宏观方面进行研究,很难全面地揭示高寒沼泽草甸适应增温环境的策略,有必要对增温条件下高寒沼泽草甸植物生理响应进行研究,以便更好地理解高寒沼泽草甸适应增温的机制和策略。如石福孙等[19]的研究,认为可通过生理指标定量分析判断升温是否对高寒植物生长造成负面影响;付刚等[6]发现高寒植物生理变化决定该区域植被群落结构和生产力演变的方向和程度;乔晓英等[20]认为叶绿素、丙二醛等生理指标含量的高低可指示寸草苔(Carexduriuscula)对环境变化适应能力的强弱。光合色素、渗透调节物质、丙二醛的含量及抗氧化酶活性往往会随着增温程度的变化而相应变化,因而成为研究增温条件下植物生理响应的重要指标[17]。
植物对增温适应能力的强弱是受多因子影响的综合表现,简单的使用单项生理指标难以全面准确地反映各物种的适应能力[21-22]。现常用多元统计分析方法对植物的增温适应性进行评价,主要采用主成分分析法结合其他数据统计方法,如Logistic回归分析法、隶属函数分析法及聚类分析法等。该评价方法目前已经广泛应用于芍药属(Paeonia)等多种植物的对增温适应性评价,且多元建模分析技术的评价结果与实际热害观察结果一致[23]。因此,本研究采用OTCs系统模拟增温的方式,分析青藏高原高寒沼泽草甸植物矮嵩草(Kobresiahumilis)、藏嵩草(Kobresiatibetica)和青藏苔草(Carexmoorcroftii)光合色素含量、渗透调节物质、丙二醛含量和抗氧化酶活性对短期增温的响应特征,并运用主成分分析法及隶属函数法评价3种植物适应性,揭示3种植物对气温升高的响应模式及差异,为预测未来气候变化对高寒沼泽草甸植物以及整个陆地生态系统产生的影响奠定理论基础。
1 材料与方法
1.1 研究区概况
研究区域位于青藏高原腹地风火山地区,海拔为4 680~5 360 m,属于典型多年冻土区,该区年均降水量270 mm,年均蒸发量1 478 mm,且降水主要发生在植物生长季(5—9月)[6]。该区域面积约30%为高寒沼泽草甸,主要分布在海拔3 200~4 800 m的河畔、湖滨、排水不畅的平缓滩地[16],本研究中高寒沼泽草甸样地位于河畔,坐标为 34°43′57.5″ N,92°53′22.5″ E,海拔4759 m,群落覆盖度大、物种组成丰富。主要植物种有矮嵩草、藏嵩草、青藏苔草、针茅(Stipaaliena)、羊茅(Festucasp.)等高寒植物,植被盖度达85%[24]。
1.2 研究方法
2015年7月,分别选取植被盖度、植物类型以及地势基本一致的试验样地进行试验布置,建立100 m×100 m样地,并于样地内随机建立5个试验小区,试验小区间隔不小于6 m。在小区内随机布设对照样方(1.5 m×1.5 m)、低幅度增温样方(T1,增温1.5~2.5℃)和高幅度增温样方(T2,增温3~5℃)各1个,对照和增温样方相隔2~3 m,共计15个的样方。
模拟增温的方式采用国际冻原计划中的开顶式生长室(open-top chambers,OTCs)[25]。增温室采用透明有机玻璃加工成正六边形圆台状,透光率95%,低幅度增温和高幅度增温小室高度分别为0.4 m(T1)和0.8 m(T2),底面积分别约为1 m2和2 m2,圆台斜边均与地面呈60°角,并保证圆台开口为0.6 m(图1)。同时,采用EC-TM温湿度传感仪(Decagon Decices Inc.,Pullman,WA)记录空气温度与湿度。对2019年进行全年气温监测得出,OTCs内的平均气温分别相比CK提高了2.1℃(T1)和4.4℃(T2),其中7月月平均气温为全年最大值(图1)。
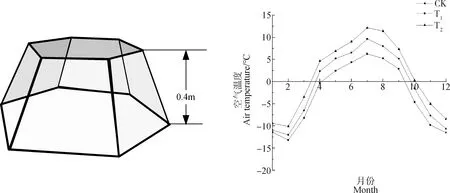
图1 OTCs示意图(低幅度增温)及2019年月平均气温
1.3 样品采集
在模拟增温4年后采样,即2019年8月22日,在每个样方内,按对角线法选取矮嵩草、藏嵩草及青藏苔草各约5 g新鲜植株,齐地面剪下各物种植株,然后将重复样方所采集的矮嵩草、藏嵩草及青藏苔草分别均匀混合,3种处理得到矮嵩草、藏嵩草及青藏苔草新鲜植株各25 g,冷藏于取样箱迅速带回实验室,保存在液氮中待测,每个指标测定3次重复[26]。
1.4 测定指标
1.4.1植物光合色素含量的测定 叶绿素a、叶绿素b及类胡萝卜素含量的测定根据Lichtenthaler等[27]的乙醇浸提比色法方法,利用可见光分光光度计分别在663,649和470 nm下测定光吸收值,再根据3种色素在该波长下的吸收系数即可求出其含量(mg·g-1)。
1.4.2植物渗透调节物质的测定 脯氨酸含量采用水浴浸提法脯氨酸含量的测定根据Bates等[28]的方法,用 3%的磺基水杨酸溶液研磨提前游离脯氨酸后,测得其含量(μg·g-1FW)。可溶性糖含量的测定根据Dhindsa等[29]的方法,利用450 nm下的光吸收值求出可溶性糖含量(mmol·L-1)。可溶性蛋白含量的测定根据Bradford等[30]的考马斯亮蓝染色法,根据在595 nm下的光吸收值,对照标准蛋白标准曲线求出可溶性蛋白含量(mg·g-1)。
1.4.3植物丙二醛含量的测定 丙二醛含量的测定根据Dhindsa等[29]的方法,利用532 nm下的光吸收值减去600 nm下最小吸收值求出丙二醛含量(μmol·g-1)。
1.4.4植物抗氧化酶活性的测定 过氧化物酶活性的测定根据Ekmekci等[31]的方法,利用470 nm下光吸收值在3 min内每15 s的变化表示过氧化物酶活性(U·min-1·g-1FW)。超氧化物歧化酶活性的测定根据Becana等[32]的方法,以每毫克蛋白抑制氮蓝四唑光化还原的50%作为一个酶活性单位。
1.5 数据处理
使用Microsoft Excel 2010进行数据处理,运用SPSS 20.0软件进行数据分析。不同处理间各植物生理指标差异采用单因素方差分析(One-way ANOVA)与Duncan’s多重比较法进行显著性检验,利用Origin2018软件进行绘图,图表中数据为平均数±标准差。将主成分分析和隶属函数结合使用评价植物对增温的适应性[33]。利用SPSS 20.0对9项生理指标进行主成分分析,合理设置特征值的限定值,保证主成分累积贡献率超过85%,获得特征值、贡献率、累积贡献率等。计算各综合指标主成分得分并将其隶属函数化,结合各综合指标权重排序,具体公式如下:
主成分得分(Zi)计算公式为:
(1)
(i=1,2,3,…,n)
式中:Zi为各物种第i个主成分得分;ai为第i个主成分的标准化特征向量值;Xi为各单项生理指标的标准化值。
隶属函数值公式为:
(2)
(i=1,2,3,…,n)
式中:μ(Zi)为各主成分得分的隶属函数值;Zi max和Zi min分别为各物种第i个主成分得分内的最大值和最小值。
各主成分的权重计算公式为:
(3)
(i=1,2,3,…,n)
式中:wi为各物种第i个主成分权重;Pi为各物种第i个主成分的贡献率。
各物种适应性评价值(D)计算公式为:
(4)
(i=1,2,3,…,n)
2 结果与分析
2.1 增温对3种植物光合色素的影响
矮嵩草和青藏苔草叶绿素a含量在低幅度增温(T1)处理下显著增加(P<0.05),在高幅度增温(T2)处理下则显著减少,相比对照(CK),T1处理下矮嵩草和青藏苔草叶绿素a含量分别增加22.49%和9.55%,T2处理下则分别下降了34.69%和36.26%;藏嵩草在T1和T2处理下叶绿素a含量均显著高于CK,分别增加29.03%和25.27%(图2)。
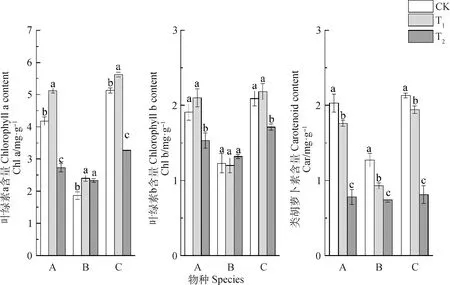
图2 增温对3种植物光合色素的影响
矮嵩草和青藏苔草叶绿素b含量在T1处理下无显著变化(P>0.05),在T2处理下则显著减少,相比CK,T2处理下矮嵩草和青藏苔草叶绿素b含量分别下降了19.90%和18.18%;藏嵩草在T1和T2处理下叶绿素b含量均无显著变化。
T1和T2处理下矮嵩草和藏嵩草类胡萝卜素含量均显著低于CK,相比CK,T1处理下矮嵩草和藏嵩草类胡萝卜素含量分别下降了13.30%和26.77%,T2处理下分别下降61.58%和41.73%;青藏苔草类胡萝卜素含量在T1处理下无显著变化,T2处理下显著低于CK,下降了61.97%。
2.2 增温对3种植物渗透调节物质的影响
矮嵩草和青藏苔草脯氨酸含量在T1处理下均无显著变化,T2处理下显著增加,相比CK,矮嵩草和青藏苔草脯氨酸含量分别增加369.84%和181.86%;T1和T2处理下藏嵩草游离脯氨酸含量均显著高于CK,分别增加27.03%和114.10%(图3)。
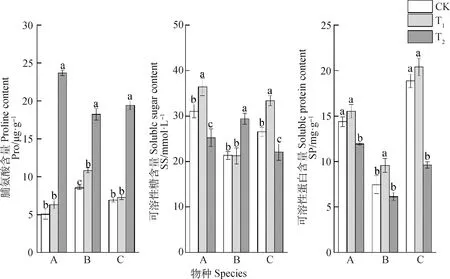
图3 增温对3种植物渗透调节物质含量的影响
矮嵩草和青藏苔草可溶性糖含量在T1处理下显著增加,T2处理下显著减少,相比CK,T1处理下矮嵩草和青藏苔草可溶性糖含量分别增加了17.26%和25.92%,T2处理下则分别下降了18.84%和16.88%;T1处理下藏嵩草可溶性糖含量无显著变化,T2处理下则显著高于CK,增加了37.88%。
矮嵩草和青藏苔草可溶性蛋白含量在T1处理下均无显著变化,T2处理下则显著低于CK,分别减少了17.04%和48.99%;藏嵩草在T1处理下可溶性蛋白含量显著高于CK,增加了28.49%,T2处理下则无显著变化。
2.3 增温对3种植物丙二醛含量及抗氧化酶活性影响
矮嵩草在T1和T2处理下丙二醛含量显著低于CK,分别下降了28.43%和58.61%;藏嵩草在T1处理下丙二醛含量无显著变化,T2处理下则均显著低于CK,相比CK,降低了24.05%;青藏苔草在T1处理下丙二醛含量显著低于CK,相比CK,下降了22.88%,T2处理下则无显著变化(图4)。

图4 增温对3种植物丙二醛及抗氧化酶活性的影响
矮嵩草在T1和T2处理下过氧化物酶活性均显著高于CK,分别增加了371.20%和176.48%;藏嵩草则在T1和T2处理下均显著低于CK,分别减少了46.27%和24.27%;青藏苔草则在T1处理下显著高于CK,相比CK,增加了105.77%,T2处理下则显著低于CK,减少了35.26%。
矮嵩草在T1处理下超氧化物歧化酶含量显著低于CK,减相比CK,下降了6.37%,T2处理下则无显著变化;藏嵩草在T1处理下显著高于CK,相比CK,增加了11.74%,T2处理下则显著减少,下降了6.19%;青藏苔草在T1和T2处理下超氧化物歧化酶含量均显著高于CK,增加了27.12%和15.46%。
2.4 3种植物增温适应性评价分析
由表1可知,增温处理后植物各生理指标之间存在大小不同、显著性不同的相关性,导致它们所代表的信息存在相互重叠的问题,各单项指标的重要程度也不同。3种植物对增温的适应性是一个复杂的综合性状,从单项指标不能清楚准确地进行适应性评价[34],需要在此基础上对各指标进行其他多元统计分析。
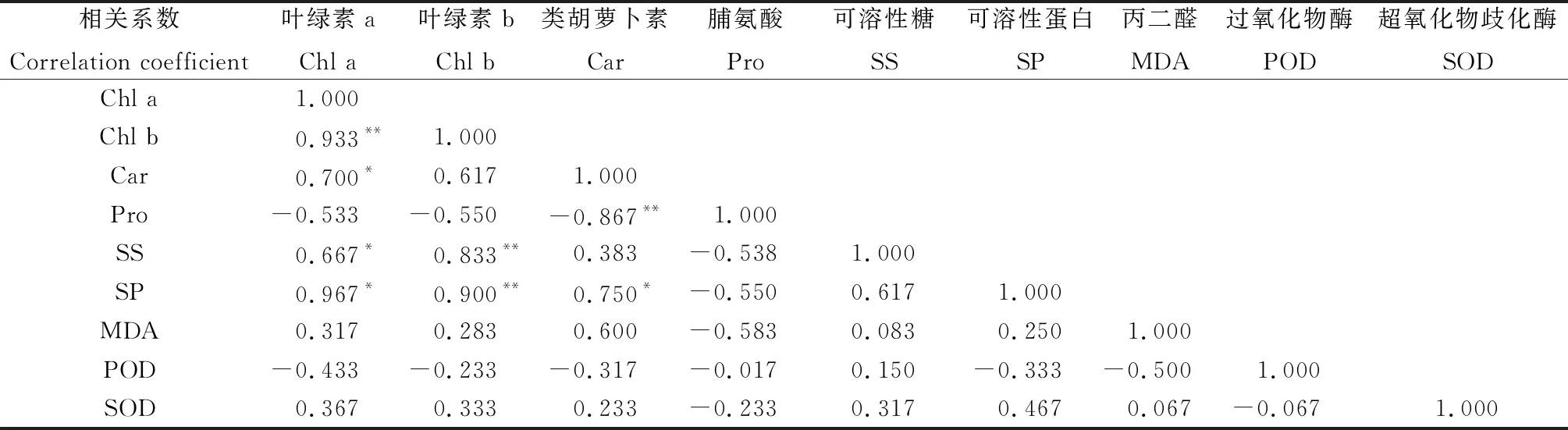
表1 植物生理指标的相关系数矩阵
由表2可以看出,对9个生理指标进行主成分分析,根据累计贡献率>85%的原则取前4个主成分进行分析,它们的累计贡献率为93.6%,表明前4个主成分能代表所有生理指标进行不同物种间对不同增温幅度的适应性评价。

表2 植物生理指标主成分分析
第1主成分主要有叶绿素a、叶绿素b、类胡萝卜素、脯氨酸和可溶性蛋白,其特征值为5.04,贡献率为56.0%;第2主成分主要有可溶性糖、丙二醛和过氧化物酶,其特征值为1.50,贡献率为16.7%;第3主成分主要有脯氨酸和超氧化物歧化酶,其特征值为1.15,贡献率为12.7%;第4主成分主要有超氧化物歧化酶,其特征值为0.74,贡献率为8.2%。可见,3种高寒沼泽草甸植物对增温的适应性受多因子影响,根据各指标在不同因子上的载荷,相关分析确定,叶绿素a、叶绿素b、类胡萝卜素、可溶性糖、过氧化物酶和超氧化物歧化酶这6个生理指标为增温处理下反应敏感的生理指标。
以主成分贡献率的大小,计算各主成分的权重。如表3所示,4个主成分的权重值不等,分别为0.598,0.178,0.136和0.088。利用隶属函数计算公式将指标值进行转化,结合权重计算得到适应性评价值D。根据D值评价3种高寒沼泽草甸植物对不同增温幅度的适应性,依次为:自然条件下,矮嵩草>青藏苔草>藏嵩草;低幅度增温下,青藏苔草>矮嵩草>藏嵩草;高幅度增温下,青藏苔草>矮嵩草>藏嵩草。
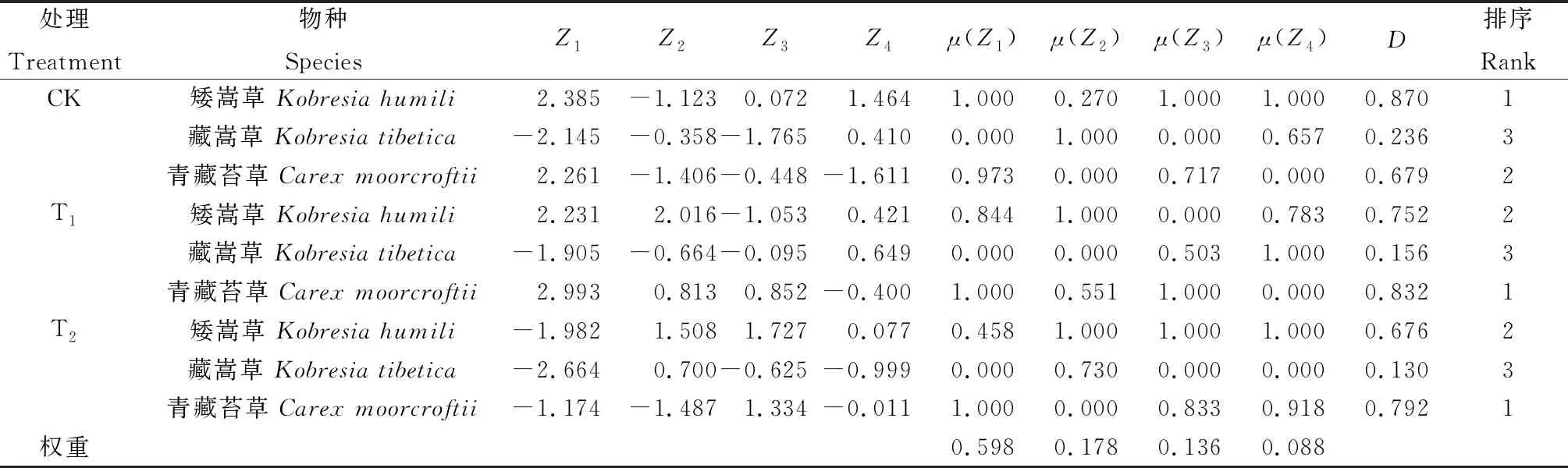
表3 植物的主成分得分(Zi)、权重、隶属函数值、D值及适应性排序
3 讨论
3.1 增温对高寒沼泽草甸植物光合色素的影响
叶片中的叶绿素是植物进行光合作用的物质基础,其含量能表征植物光合能力的强弱[35]。本研究中,3种植物叶绿素对增温的响应存在显著的互作效应,低幅度增温下3种植物叶绿素含量均显著增加,这可能是因为适度增温使得叶片细胞内叶绿素合成相关酶活性升高,促进了3种植物叶绿素合成和积累,这与陈翔等[8]和王琼等[36]研究结论一致。而高幅度增温下矮嵩草和青藏苔草叶绿素含量的降低,与张丽霞等[37]研究类似,分析其原因一方面可能与较高的温度造成温室内水热状况改变有关,不适于叶绿素的形成,使其分解大于合成,另一方面高温引起植物体内活性氧产生量的上升导致的氧化破坏,也可能使得叶绿素降解速度加快[38]。
类胡萝卜素既可参与植物的光合作用,还可吸收细胞内剩余的能量,淬灭活性氧,从而降低膜脂过氧化程度[39-40]。袁嫚嫚等[41]研究表明,温度升高显著增加了水稻(Oryzasativa)生育后期的类胡萝卜素含量。而本实验结果表明,增温处理下3种植物类胡萝卜素与对照相比均显著下降,与王义婧等[42]研究结果类似,分析类胡萝卜素含量下降的原因可能是因为温度在促进光合作用的同时,作为光合和呼吸作用副产物的活性氧也增加,类胡萝卜素需参与活性氧猝灭,防止膜被氧化。
3.2 增温对高寒沼泽草甸植物渗透调节物质的影响
植物会通过调节渗透物质来避免或减轻环境因子变化对其可能造成的伤害[43],在增温处理下,植物细胞内渗透调节物质代谢的水平和途径发生一系列适应性和抵抗性变化[44]。脯氨酸被认为是植物体内理想的有机溶质渗透调节物,多数植物受到胁迫后均能大量积累,适应环境变化所造成的影响[45]。董瑜等[46]研究结果表明,不同湿地植物叶片脯氨酸含量对气温升高的响应存在差异性。本研究中,相比对照,3种植物脯氨酸含量在高幅度增温处理下大幅度增长,表明脯氨酸对高幅度增温做出积极响应,以迅速积累的方式调节增温对细胞渗透压的影响,进而减少细胞受到的伤害,与杨春勐等[47]模拟增温对滇杨(Populusyunnanensis)和川杨(Populusszechuanica)叶片脯氨酸的研究结果一致。
受到胁迫植物体内的可溶性糖含量也会积累,维持细胞正常渗透压,且可溶性糖含量越高,缓解逆境所带来伤害的能力越强。张秋芳等[48]研究表明,杉木(Cunninghamialanceolata)在外界环境影响下产生自我保护,可在短时间内通过调控可溶性糖等维持细胞正常功能。本研究中,低幅度增温下矮嵩草和青藏苔草可溶性糖含量相比对照显著增加,适当增温可促进植物光合产物可溶性糖增加;而高幅度增温下相比对照显著下降,其原因可能在于增温导致矮嵩草和青藏苔草光合作用失调,正常生理代谢和维持细胞渗透势均需要大量可溶性糖[40]。藏嵩草相比矮嵩草和青藏苔草对增温更为敏感,在低幅度增温时已通过可溶性糖累积调节叶片细胞渗透势,防止蒸腾失水,维持水分代谢平衡,进而提高自身对环境的适应力,与张玥等[49]研究结果一致。
与脯氨酸和可溶性糖一样,可溶性蛋白也是一种重要的渗透调节物质,具有较强的亲水能力,能够显著增加细胞亲水能力,参与植物的渗透调节过程[45,50]。本研究中,3种植物可溶性蛋白在低幅度增温下相比对照无显著变化,且在高幅度增温下显著降低,这与曾贞等[51]得出增温导致桑树(Morusalba)叶片可溶性蛋白含量显著增加的结论不一致。原因可能是,低幅度增温使得植物光合速率增加,植物体需要更多的光合酶参与光合作用,从而使得可溶性蛋白含量降低[52],但光合产物可溶性糖含量增加,为合成蛋白质提供足够碳源,保证蛋白质供需平衡。而高幅度增温一方面引起的叶温增幅较大,使蛋白水解酶活性增加,体内碳水化合物的供应受阻造成可溶性糖和可溶性蛋白含量减少[53];另一方面,增温导致植物体细胞中活性氧自由基的积累,加速了蛋白质的分解。
3.3 增温对高寒沼泽草甸植物丙二醛及抗氧化物酶活性的影响
生长在青藏高原高寒环境中的植物,抗氧化能力的高低是决定植物能否在高原复杂环境生存的重要因素[54]。丙二醛是细胞膜脂过氧化产物之一,其含量越多表明叶片受毒害作用越强,可间接反映植物组织的抗氧化能力[48]。本研究中,增温处理下3种植物丙二醛含量整体维持于正常水平,并未出现大幅度增加,这与Martinez等[53]和吴久赟等[55]研究结果类似。分析其原因可能是低幅度增温下植物光合速率较高会导致细胞中活性氧自由基积累增多,膜脂过氧化加剧使丙二醛增高,并激活了抗氧化系统,但3种植物叶片中积累的氧自由基并没有超过细胞的控制力引发氧自由基代谢失衡,抗氧化酶协同作用清除过剩氧化性物质、抑制丙二醛生成或维持正常水平以减轻膜结构的损伤程度[56]。高幅度增温下藏嵩草抗氧化酶尽管受到抑制,但并未发生氧自由基代谢失衡,矮嵩草和青藏苔草则受温度影响,相比低幅度增温产生大量氧自由基积累,同时升温造成保护酶类的可溶性糖减少,进一步造成了丙二醛的增加。
超氧化物歧化酶作为防御的第一条线,它能特异性地将超氧阴离子(O2-)歧化为H2O2和O2,再由过氧化物酶,过氧化氢酶等将H2O2进一步催化分解成H2O和O2[57]。而本研究中,3种植物过氧化物酶和超氧化物歧化酶活性变化不一,且并未与活性氧含量表现一致,这与查倩等[58]研究结果一致。分析其原因可能是增温破坏了抗氧化酶系统的平衡,使得细胞膜脂类成分发生过氧化作用,植物体内积累丙二醛,但温度对酶类的影响又会促进抗氧化酶的生成,一定程度清除体内的活性氧,导致丙二醛含量有所下降[19],进一步印证了植物具有自我调节能力。3种植物抗氧化系统的差异可能是因为研究区域植物自身活性氧的产生与清除机制的差异,但3种植物均表现出在增温处理下抗氧化酶需要一定程度的增强以抑制体内的活性氧的毒害。
3.4 高寒沼泽草甸3种植物增温适应性评价
环境变化时,植物体内会发生一系列的生理生化反应,涉及渗透胁迫、活性氧积累等,是一个复杂的反应过程,其适应能力的大小是受多因子影响的表现[21-22]。本研究运用主成分分析法及隶属函数法评价了3种植物对增温的适应性,分析得出,3种高寒沼泽草甸植物对增温的适应性,青藏苔草增温适应性随着温度增加,优势显现,排序优于矮嵩草。3种植物对增温的适应性排序发生变化,主要是因为不同物种对温度的敏感性不同,因此增温后表现出不同于自然条件下的适应模式。一方面,矮嵩草属于耐寒旱中生植物,具有耐寒、耐旱等特点,能够适应增温导致的土壤含水量的减少;藏嵩草和青藏苔草均对水分变化极为敏感,但已有研究表明,青藏苔草既存在一般植物常有的适应生境升温的机制,又因其生理整合现象,即营养物质和水分可以通过地下根茎进行分株间的运输和转移,实现整个无性系的资源共享,从而提高青藏苔草对高温环境的适应性[59-61];另一方面,适度增温有利于莎草科植物的生长发育的同时,促使植物发育速率加快,进而导致部分高寒植物的成熟过程提早,缩短实际生长期,生物量的减少,丧失优势地位。李英年等[62]通多对比20年间植被结构数据,认为在气候变暖的情况下,高寒湿地植物群落组成会发生变异,原生适应寒冷、潮湿生境的藏嵩草为主的草甸植被类型可能会被寒冷湿中生为主的典型草甸类型替代,部分结论与本次评价一致。此外,杨凯等[63]从形态学与化学计量学角度出发,分析得出增温促进冻土融化提供一定营养供给,促进藏嵩草沼泽化草甸生物量的积累,提高其资源掠夺能力,加强自身生态地位,可见仅从植物生理层面评价植物对温度的适应性,对于全面准确的预测增温背景下沼泽草甸植物群落结构和功能的演变方向仍有所欠缺,后续需结合植物形态特征与生物量生产等方面内容进一步探究高寒沼泽生态系统对气候变暖的响应机制。
4 结论
综上所述,短期模拟增温对3种高寒沼泽草甸植物生理方面造成了影响,3种植物在一定程度上通过自身调节来抵御增温环境所带来的影响,具体表现为低幅度增温促进植物光合作用,通过渗透调节物质和抗氧化系统协同作用维持植物正常生长;高幅度增温下,植物光合作用受到抑制,通过渗透调节物质增多和抗氧化酶活性增加,使得活性氧的破坏作用减轻,维持植物正常生理活动。同时,不同增温幅度下,3种植物对增温的适应性相对自然条件发生改变,适应性从强到弱依次为青藏苔草>矮嵩草>藏嵩草。3种植物生理响应及对其增温适应性评价表明,高寒沼泽草甸不同增温幅度下植物能通过自身生理特性的改变,对增温环境做出有利于自身生长的反馈调节,增温适应能力最强的物种出现分异,物种竞争能力可能会因此发生改变。

