野生香菇黔香筛5号菌丝的生物学特性及抗氧化活性
曾 茜,陈 旭,杨 雨,杨仁德,王晓敏
(1.贵州中医药大学基础医学院,贵阳 550025;2.贵州省农业科学院农业资源与环境研究所,贵阳 550006)
【研究意义】香菇(Lentinulaedodes)又名香蕈、椎茸、花菇,隶属于担子菌门(Basidiomycota)蘑菇纲(Agaricomycetes)蘑菇目(Agaricales)类脐菇科(Omphalotaceae)微香菇属(Lentinula),人工栽培起源于我国,是世界第二大生产菇类[1]。香菇种植为劳动密集型农业,因与农户利益联结紧密,促进了生产规模的不断壮大,然而优良种质资源储备匮乏和适栽菌材日益紧缺已成为制约产业发展的关键因素[2-4]。【前人研究进展】据统计,2018年我国出产香菇1000余万t,占食用菌总产量1/4以上,远超于其他种类食用菌[5]。香菇作为家常传统美食不仅味道鲜美,营养丰富,还兼具保健功能,是一种普遍认可的食药同源真菌,其药用价值自古以来就有著述及报道[6-8]。特别是香菇多糖(Lentinan, LNT)已受到世界各国学者的广泛关注,相继开展了许多药理与临床研究[9],具有抗肿瘤[10]、抗氧化[11]、免疫调节[12]等多种生物活性。我国拥有极其丰富的地域野生香菇种质资源,多样性特征显著,但缺乏用于地方适栽品种的创新创制研究[13]。如何开发并利用好野生资源,挖掘优质性状基因,驯化或选育出更多生长适应性强、高产稳定、种性优良的香菇品种,是推动产业健康及创新发展的重要途经[14]。【本研究切入点】通过前期在贵州铜仁梵净山国家自然保护区采集筛选获得的一株野生香菇作为试验菌株,经驯化已在印江、播州及义龙等地开展栽培小试,均表现出副产物基质适料性强、生产周期短、商品性状优良等特点,具备较好的发展应用前景。【拟解决的关键问题】采用固体和液体培养方式,以菌落直径和菌丝体干重作为主要考察指标,从营养条件和环境因素方面研究该香菇菌株菌丝(体)的生物学特性,并基于不同添加物(皇竹草和中药渣浸煮汁)进一步测定经液体发酵后其香菇多糖的抗氧化活性,以期为高活力菌种的制备及功能性产品开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 采集分离自贵州省铜仁市梵净山国家自然保护区,菌株编号为黔香筛5号,现保存于贵州省农科院农业资源与环境研究所微生物研究室。
1.1.2 试剂 沙氏培养基、马铃薯葡萄糖培养基、蔗糖、乳糖、甘露醇、麦芽糖、葡萄糖、(NH4)2SO4、酵母浸膏、硝态氮、NH4Cl、蛋白胨、皇竹草浸煮汁、中药渣浸煮汁、无水乙醇、正丁醇、三氯甲烷、过硫酸钾、1,1-二苯基-2-苦基肼(DPPH)、2,2-联氮基双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、Vc。
1.2 试验方法
1.2.1 不同因子对香菇黔香筛5号营养生长的影响 ①碳源。以改良沙氏培养基为基础培养基,分别添加20 g/L的蔗糖、乳糖、甘露醇、麦芽糖、葡萄糖作为碳源制成相应的平板培养基(培养皿直径90 mm),以不添加碳源的基础培养基作对照(CK)。参照文献[15]的方法利用打孔器取直径为5 mm的单个活化菌饼接种于各培养基中,置于24 ℃恒温培养箱中避光培养8 d,观察不同处理菌落的生长情况,并采用十字交叉法分别测量菌落直径。每个处理5次重复(下同)。②氮源。在改良沙氏培养基中分别加入10 g/L (NH4)2SO4、酵母浸膏、硝态氮、NH4Cl、蛋白胨作为氮源,并以不添加氮源的基础培养基作对照(CK)。③初始pH。在无菌条件下,利用浓度为0.1%的HCl和NaOH溶液调节基础培养基初始pH分别至2.0、4.0、6.0、8.0、10.0进行试验。④温度。将接种菌饼的基础培养基平板分别置于10、15、20、25、30和35 ℃条件下培养。
1.2.2 不同因子对香菇黔香筛5号菌丝体生物量的影响 ①碳源。以改良沙氏培养液为基础培养液,分别添加20 g/L的蔗糖、乳糖、甘露醇、麦芽糖、葡萄糖作为碳源,以不加碳源培养液为对照(CK),装液量为200 mL/500 mL,再分别以3%(V/V)接种量将种子液接入不同培养液,pH自然,置于24 ℃条件下,150 r/min恒温摇瓶培养12 d。之后用已烘干称重的滤纸过滤,并一起置于60 ℃干燥箱中烘干至恒重称量,减除干滤纸重量即为菌丝体生物量。每个处理5次重复[16-17](下同)。②氮源。参照1.2.1的氮源设置制备培养液,即以改良沙氏培养液为基础培养液,分别加入10 g/L (NH4)2SO4、酵母浸膏、硝态氮、NH4Cl、蛋白胨作氮源,以基础培养液作对照(CK)。③初始pH。参照1.2.1的培养液初始pH设置制备培养液。④温度。参照1.2.1的温度设置进行培养。⑤接种量。以改良沙氏培养液为基础培养液,分别设置1%、2%、3%、4%、5%和6%(V/V)的接种量。
1.2.3 不同添加物对香菇黔香筛5号抗氧化活性的影响 ①菌丝体发酵培养。以改良沙氏培养液为基础培养液,分别添加10%(V/V)的皇竹草浸煮汁、中药渣浸煮汁及马铃薯葡萄糖培养液,装液量为200 mL/500 mL,按3%(V/V)接种香菇种子液,置于24 ℃条件下,150 r/min恒温摇瓶培养20 d,用滤纸收集菌丝体低温干燥备用。②胞内多糖制备。参照MA等[18]改良后的水提醇沉法。将菌丝体研磨至粉末状,加25倍蒸馏水,90 ℃水浴煮提2次混合滤液,旋蒸浓缩至1/4体积,用3倍体积95%乙醇,于4 ℃醇沉24 h,4500 r/min离心5 min,烘干至恒重。利用Sevag法脱蛋白,按等量加入香菇多糖溶液振荡2次,每次1 h,静置分层并分离上层溶液,选择3500 Da透析袋流水透析24 h,经冷冻干燥后获得皇竹草香菇多糖HLNT、中药渣香菇多糖ZLNT、PD香菇多糖PLNT。③抗氧化性测定。将上述多糖样品分别配制为浓度0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0、5.0 mg/mL的水溶液,以Vc为对照(CK),测定DPPH、ABTS、羟基自由基的清除率,每个处理3次重复。参照赵诗雨等[11,19]的方法进行测定。
1.3 数据统计与分析
利用SPSS 17.0和Excel 2010对数据进行统计分析。
2 结果与分析
2.1 不同因子处理香菇黔香筛5号菌落的生长
从图1看出,香菇黔香筛5号在不同碳源、氮源、温度及初始pH等因子影响下其菌落生长存在差异。
2.1.1 碳源 各处理的菌落直径为0.2~7.7 cm,表现为葡萄糖>蔗糖>麦芽糖>乳糖>无碳(CK)>甘露醇。当甘露醇作为碳源时,菌丝几乎不能生长,而在其他碳源平板培养基上均能生长,但对不同碳源的利用能力存在显著差异。其中,含葡萄糖培养基上的菌丝生长速度最快,菌落长势良好,菌丝粗壮浓密,培养10 d后其菌落直径达7.7 cm,分别为CK和劣势组乳糖的1.97和1.45倍,显著高于除蔗糖外的其余处理。其次是含蔗糖培养基上的菌丝,生长旺盛,较洁白浓密,菌落直径为7.1 cm,显著高于除麦芽糖外的其余处理。蔗糖、麦芽糖和乳糖差异显著,均优于CK;乳糖培养基中的菌丝较稀疏,且有少量气生菌丝产生。结果表明,葡萄糖为最佳碳源,蔗糖次之。
2.1.2 氮源 各处理的菌落直径为0.5~8.6 cm,表现为(NH4)2SO4>蛋白胨>NH4Cl>酵母浸膏>无氮(CK)>硝态氮。菌株在硝态氮培养基上无法生长,而其他氮源培养基的菌落生长速度均优于CK。其中,硫酸铵和蛋白胨能显著促进菌丝生长,菌落直径分别为8.6和7.6 cm,生长速率分别达1.08和0.95 cm/d,菌丝洁白浓密,长势较好,且以硫酸铵处理菌丝生长的综合性状最优,其菌落直径显著高于其余处理;其次为氯化铵和酵母浸膏处理,菌丝生长相对缓慢,稀疏不整齐,略发黄。
2.1.3 温度 香菇黔香筛5号菌株在温度14~38 ℃时菌丝均可生长,各处理的菌落直径为2.0~6.7 cm,表现为30 ℃>25 ℃>20 ℃>35 ℃>15 ℃>10 ℃,即随着培养温度升高,菌落直径呈先升后降趋势。其中,当温度为30 ℃时菌落直径达最大;最适温度为25~30 ℃,对高温表现出较好的耐受性,培养8 d菌落直径达6.5~6.7 cm,差异不显著,但均显著高于其他温度条件下的菌落直径;当温度<15 ℃或>30 ℃时,菌落长势缓慢,菌丝较稀疏细弱。
2.1.4 初始pH 各处理的菌落直径为0.4~5.9 cm,表现为pH 4.0>pH 6.0>pH 8.0>pH 2.0>pH 10.0,即随着初始酸碱度升高,菌落直径呈先升后降趋势。菌株在初始pH为2.0~8.0的培养基上均能生长,pH最适范围在4.0~6.0,培养8 d后菌落直径可达5.6~5.9 cm,且菌丝健壮,较浓密。其中,pH 4.0时菌落直径最大,pH 6.0时其次(5.6 cm),二者菌落直径差异不显著,但均显著高于其余处理;当pH达10.0其长势急剧减弱,甚至无法生长。
2.2 不同因子处理香菇黔香筛5号菌丝体的生物量
从图2看出,不同碳源、氮源、温度及初始pH等因子影响下香菇黔香筛5号菌株菌丝体的生物量(干重)存在差异。
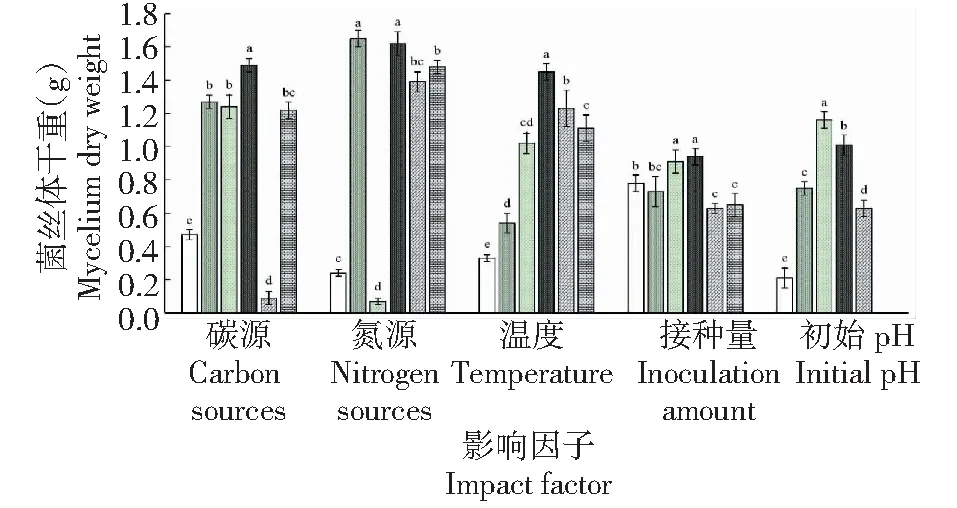
从左到右接种量依次为1%、2%、3%、4%、5%、6%(V/V)Inoculum sizes were designed by 1, 2, 3, 4, 5 and 6 percent, in order图2 不同因子处理香菇黔香筛5号菌丝体的生物量(干质量)Fig.2 Biomass(dry weight) of Lentinula edodes treated with different factors
2.2.1 碳源 各处理的菌丝体干重为0.09~1.49 g,表现为蔗糖>葡萄糖>乳糖>麦芽糖>无碳(CK)>甘露醇。香菇黔香筛5号仍无法利用液体培养基中的甘露醇,与CK相比,其余碳源处理均能显著提高该菌株菌丝体生物量的积累。其中,以蔗糖处理黔香筛5号菌株的菌丝体生长情况最佳,碳源利用率高,产量较好,其菌丝体干重为CK的3.17倍,显著高于其余处理,且在此碳源条件下的菌丝球数量相对较多、均匀致密、大小适宜,培养液较澄清。葡萄糖、乳糖和麦芽糖处理次之,菌丝体产量为CK的2.60~2.70倍,均匀度略差,三者间差异不显著,葡萄糖和乳糖处理的菌丝体干重显著高于除麦芽糖外的其余处理,麦芽糖处理的菌丝体干重显著高于无碳和甘露醇处理。
2.2.2 氮源 各处理的菌丝体干重为0.07~1.65 g,表现为(NH4)2SO4>蛋白胨>酵母浸膏>NH4Cl>无氮(CK)>硝态氮。硝态氮处理的液体培养基无法被黔香筛5号菌株吸收,其他处理的菌丝体干重均显著高于CK。其中,添加硫酸铵和蛋白胨的培养基效果较好,菌丝体干重分别为1.65和1.62 g,二者差异不显著,但均显著高于其余处理;且两者的菌丝球在数量、大小、均匀度和悬浮性等性状上差异不明显,硫酸铵处理菌丝球轮廓更清晰,相互分明。酵母浸膏和氯化铵处理其次,培养液澄清,菌丝体干重分别为1.48和1.39 g,二者差异不显著,但均显著高于无氮(CK)和硝态氮。
2.2.3 温度 各处理的菌丝体干重为0.33~1.45 g,表现为25 ℃>30 ℃>35 ℃>20 ℃>15 ℃>10 ℃,即随着培养温度升高,菌丝体生物量呈先升后降趋势。不同培养温度处理黔香筛5号菌株的菌丝体生长情况和生物量积累存在显著性差异。当温度为25 ℃时,菌丝体干重达最大,为1.45 g,该条件下菌丝球性状均优于其他处理,且培养液较澄清。随着温度的升高或下降,菌丝体干重均逐渐降低,而当温度高于35 ℃或低于20 ℃时,菌丝球生长缓慢并受到抑制,少部分相互粘连,培养液较浑浊。
2.2.4 接种量 各处理的菌丝体干重为0.63~0.94 g,表现为4%>3%>1%>2%>6%>5%,不同接种量处理黔香筛5号菌株的菌丝球性状及干重存在一定差异。其中,接种量3%(V/V)和4%菌丝体生物量积累均较好,干重分别达0.91和0.94 g,二者差异不显著,但前者菌丝球的均匀度、悬浮性及大小形态均优于后者。接种量1%和2%处理其次,而当接种量为1%时,菌丝球性状表现为数量少、形态大,且相互粘连,难以分生扩增。接种量6%和5%处理的菌丝体生物量最低,二者差异不显著,但均显著低于除2%处理外的其余处理。
2.2.5 初始pH 各处理的菌丝体干重为0.21~1.16 g,表现为pH 6.0>pH 8.0>pH 4.0>pH 10.0>pH 2.0,即随着培养温度升高,菌丝体干重呈先升后降趋势,各处理间差异显著。液体培养条件下黔香筛5号菌丝体在pH 4.0~10.0均能较好生长,菌丝体干重达0.6 g以上。其中,当初始pH为6.0时,菌丝体生物量积累最多,达1.16 g,显著高于其余处理,菌丝球相对密集均匀,悬浮性较好,互相分明。pH 8.0处理其次,干重为1.01 g;当pH为2.0时,菌丝体生长受到明显抑制。
2.3 不同添加物处理香菇黔香筛5号的抗氧化活性
从图3看出,不同添加物处理黔香筛5号产香菇多糖的抗氧化活性存在差异。

图3 不同发酵处理产香菇多糖对DPPH自由基、羟基自由基及ABTS自由基的清除率Fig.3 Scavenging rate of lentinan polysaccharide produced by different liquid fermentation to DPPH radical,hydroxyl radical and ABTS radical
2.3.1 清除DPPH自由基 皇竹草(HLNT)、中药渣(ZLNT)浸煮汁及马铃薯葡萄糖(PLNT)3种添加物处理的香菇多糖对DPPH自由基清除能力与浓度呈正相关,浓度为0.2~1.0 mg/mL清除率增长较快,而浓度超过1.0 mg/mL后HLNT和PLNT处理的清除能力逐渐趋于平缓,而ZLNT处理多糖浓度大于3.0 mg/mL时,其活性较其他处理呈现出较好的增强趋势。在浓度达5.0 mg/mL时,ZLNT、HLNT和PLNT处理对DPPH自由基的清除率分别为86.7%、78.1%和66.0%,均低于Vc(CK)。与HLNT和PLNT相比,ZLNT对DPPH自由基具有更强的清除作用,且最大值为Vc(CK)的0.89倍。
2.3.2 清除羟基自由基 不同处理香菇多糖随着浓度增加,其清除羟基自由基能力也逐渐增强。当香菇多糖浓度为5.0 mg/mL时,ZLNT、PLNT和HLNT处理对羟基自由基的清除率分别为73.5%、63.7%和59.8%,但均低于Vc(CK)。其中,ZLNT对羟基自由基的清除作用明显强于PLNT和HLNT处理,而PLNT和HLNT处理间差异不明显。
2.3.3 清除ABTS自由基 多糖浓度直接影响3个处理对于ABTS自由基的清除能力,相较Vc(CK),ZLNT和PLNT处理清除率随浓度增长缓慢,且差异不明显。当香菇多糖浓度达5.0 mg/mL时,HLNT、ZLNT和PLNT处理对ABTS自由基的清除率依次为75.5%、57.8%及52.1%,均低于Vc(CK),但HLNT清除ABTS自由基的效果明显高于ZLNT和PLNT处理。
3 讨 论
随着香菇产业的快速发展,种植规模不断壮大,产销竞争日益激烈,菌种作为食用菌生产上的重要基础资料,市场需求已逐渐由价格转变为优质、稳定及适应性强等品种特性。而目前国内香菇主栽品种为野生资源谱系中的较小分支,遗传背景狭窄,缺乏对优良种质资源的挖掘与利用,导致香菇新品种选育及良种繁育工作相对滞后[20]。研究发现,我国是世界上野生香菇种质资源最丰富、遗传多样性最高的地区,地理环境和气候生态多变促使各谱系间差异频繁,且西南和西北区域为香菇多样性分布中心,这些都为优势品种创制提供了有利条件[21-23]。因此,野生香菇资源的收集评价及开发应用具有深远的现实意义。
驯化或选育出的优良食用菌品种在应用于生产前,必须全面掌握其生物学信息及种性特点等要素,尽可能预防和减少不必要损失[24]。本研究已初步筛选出适宜于香菇黔香筛5号菌丝生长的营养需求及培养条件,可为后续进一步探明各因素对其生长发育、遗传规律及基因互作影响提供参考。钱可晴等[25]通过对野生皱木耳开展生物学特性研究及本地驯化栽培,获得出菇性状稳定的木耳属新品种鹿肚耳菌株,为工厂化栽培提供了适宜种质资源,也充分说明野生资源是食用菌品种开发与创新利用的重要来源。并且,随着菌林矛盾的日益凸显,决定了利用农林副产物替代阔叶树木屑作为香菇栽培原料将成为主要发展趋势,如何开发适宜特殊营养源和特定地理区域的优势品种,或挖掘出更多功能基因是重要的育种方向,也是产业发展的根本动力。另外,研究发现不同栽培基质条件下获得的食用菌代谢产物也会存在一定差异,部分表现为可诱导或抑制某些特定代谢产物产生[26]。香菇黔香筛5号菌株具有较好的副产物适料性,添加其浸煮汁可有效促进发酵物的抗氧化活性,与朱伶俐、吴鸿雪等[27-28]利用不同基质栽培猴头菇和灵芝,改善代谢产物体外免疫及抗肿瘤活性结果相似,表明筛选并改良基质配方亦可作为食药用菌活性产物富集及产品研发的新途径[29]。
4 结 论
研究结果表明,不同碳氮源、培养温度及pH等因素对香菇黔香筛5号菌株的菌丝生长存在显著影响。其中,母种培养基的最佳碳氮源分别为葡萄糖和硫酸铵,最适培养温度25~30 ℃,初始pH在偏酸性的4.0~6.0为宜。液体培养基中以蔗糖作为碳源、硫酸铵或蛋白胨作为氮源时更有利于菌丝体生物量的积累,且培养温度25 ℃、接种量3%(V/V)及pH 6.0为适宜条件。值得注意的是,在2种菌丝培养方式下,供试菌株均无法利用甘露醇和硝态氮作为营养物质。并且,香菇黔香筛5号液体发酵添加皇竹草(HLNT)和中药渣(ZLNT)浸煮汁均能提高多糖的抗氧化活性,ZLNT对DPPH及羟基自由基具有显著清除作用,当浓度为5 mg/mL时,清除率分别达86.7%和73.5%;HLNT则是对ABTS自由基清除效果较好,相同浓度下清除率为75.5%。

