高考化学有关滴定类计算试题的分布特点与解题策略
金敖然
(广西壮族自治区南宁市第三中学)
滴定实验是高中化学中重要的定量实验,也是高考试题中考查学生计算能力、分析解题能力的重要载体.本文着重归纳有关滴定计算的各种类型,探讨二轮专题复习中滴定计算试题的解题策略.
1 近几年高考中有关滴定问题的分布及特点

表1
滴定计算是考查学生计算能力的重要形式,近几年来滴定的计算题型深受命题人的青睐,尤其在全国Ⅰ、Ⅱ卷中频繁出现,多与真实情境相结合,如葡萄酒中焦亚硫酸钠的测定、食品防腐剂苯甲酸的测定、废水中含氧量的测定、工业试剂三草酸合铁酸钾、硫代硫酸钠含量的测定等.新课标中重点强调的滴定实验也反映了这一命题导向.那么我们如何突破滴定计算这类题型呢? 学生可以尝试通过归纳滴定类型,构建解决问题的思维模式,突破认知障碍,突出解题思路,最后通过精准的训练达到思维、方法内化的目的.
2 常见滴定问题中的滴定类型
2.1 直接滴定
如果标准溶液与待测物质可以直接反应,通过测量标准液的用量来计算出待测物质的量,这种滴定叫作直接滴定.直接滴定法是滴定分析中最常用和最基本的方法,是一种方便、快捷的滴定方法.思维模型如图1所示.

图1
例1(2018年全国Ⅱ卷,节选)测定三草酸合铁酸钾中铁的含量.
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点.
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中.加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.该晶体中铁的质量分数的表达式为________.
解析
根据题意,该实验分成两步进行,第一步将mg样品溶于水,加入稀硫酸酸化抑制三草酸合铁酸钾的水解,再用cmol·L-1KMnO4溶液滴定至终点,目的是氧化草酸根,避免干扰Fe2+的测定.第二步向反应后的溶液中加入过量锌粉充分反应,目的是将Fe3+全部还原成Fe2+,过滤、洗涤,向洗液中加入稀H2SO4酸化,抑制Fe2+的水解,再用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.由于KMnO4与Fe2+直接发生氧化还原反应,属于“直接滴定”.建立以下思维模型:
1)根据氧化还原规则,建立KMnO4与Fe2+的比例关系KMnO4~5Fe2+.
2)代入已知标准液KMnO4的物质的量,求出未知.

例2(2018年全国Ⅰ卷,节选)Na2S2O5可用作食品的抗氧化剂.在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL 葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL.该样品中Na2S2O5的残留量为______g·L-1(以SO2计).
解析
根据题意可知碘标准液的物质的量,标准液I2与待求物质Na2S2O5可以直接反应,这样的滴定属于“直接滴定”,建立思维模型:
1)依据电子转移守恒建立I2和Na2S2O5的关系式,每个参与反应的I2得到2 个电子,而每个Na2S2O5反应中可以失去4个电子,进而得到关系式2I2~Na2S2O5.
2)代入已知标准液I2的物质的量,求出未知.
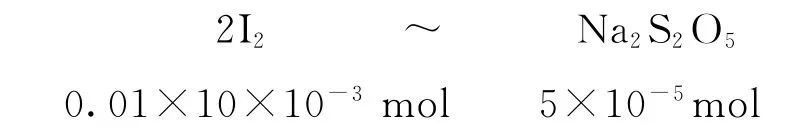
3)计算求值:由于以SO2计样品中Na2S2O5的残留量,故需换算成SO2的量.样品中Na2S2O5的残留量为=0.128g·L-1.
2.2 间接滴定
间接滴定指的是某些待测物质不能与标准液直接反应,但是可以通过别的化学反应,间接测定待测物质的物质的量.例如利用KMnO4测定Ca2+就属于间接滴定法,Ca2+不能通过氧化还原反应或者中和反应直接滴定,但可以先让Ca2+结合C2O2-4形成CaC2O4沉淀,过滤分离后用H2SO4酸化沉淀,再用KMnO4标准溶液滴定H2C2O4,从而间接测定钙的量.思维模型如图2所示.
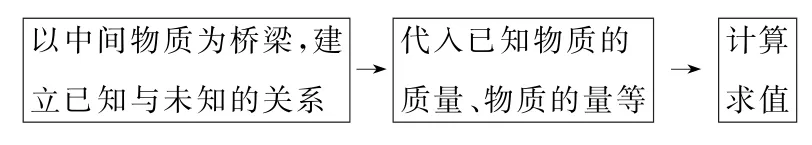
图2
例3(2020年全国Ⅱ卷,节选)苯甲酸可用作食品防腐剂.实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
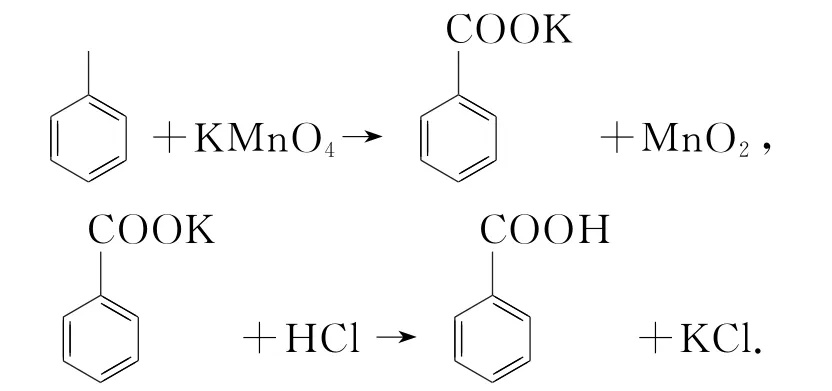
纯度测定:称取0.122g粗产品(苯甲酸粗品),配成乙醇溶液,于100 mL 容量瓶中定容.每次移取25.00mL溶液,用0.01000mol·L-1的KOH 标准溶液滴定,三次滴定平均消耗21.50 mL 的KOH 标准溶液.
本实验制备的苯甲酸的纯度为_________.
解析
建立思维模型:
1)首先找到已知条件,即某种物质的质量或者物质的量.这里就是 KOH 的物质的量.以C6H5COOK 为桥梁建立已知与未知的关系,根据方程式写出关系式

2)代入已知KOH 的物质的量,求出未知.

3)计算求值:利用关系式求出苯甲酸的物质的量,就可以求出苯甲酸的纯度.此时注意需要“恢复原态”,因为本实验配制100 mL 溶液,但每次测量值为25mL,即为总量的,所以计算纯度时,C6H5COOH的质量还要扩大4倍“恢复原态”,得出本实验制备的苯甲酸的纯度为

例4(2018年全国Ⅱ卷,节选)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1)可用作定影剂、还原剂.利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度.测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100mL溶液.
②滴定:取0.00950mol·L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:+6I-+14H+=3I2+2Cr3++7H2O.然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+.平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为________%(保留1位小数).
解析
K2Cr2O7标准溶液的量为已知条件,但是K2Cr2O7并没有和待测物质Na2S2O3直接发生反应,而是通过过量的KI溶液进行测定,这属于“间接滴定”.建立思维模型:

2.3 返滴定
返滴定又称剩余量滴定,俗称回滴.其原理是如果待测物质与标准液反应比较慢,则需要加入过量标准液以加快反应的速率,此时过量的标准液无法计算待测物质的量,则待反应完全后用另一种标准液滴定过量的标准液,这种滴定方式称为返滴定法.例如,用EDTA 标准液测定铝盐,由于Al3+与EDTA 发生配合反应较慢,需要加入过量较高浓度的EDTA 以加快反应,再用Zn2+标准液返滴定剩余的EDTA,进而测定出铝的量.思维模型如图3所示.
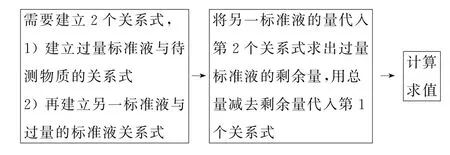
图3
例5(2019年全国Ⅱ卷,节选)成品中S2-的含量可以用“碘量法”测得.称取mg样品,置于碘量瓶中,移取25.00mL0.1000mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出.以淀粉为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为.测定时消耗Na2S2O3溶液体积VmL.样品中S2-的含量为________(写出表达式).
解析
利用“碘量法”进行S2-含量的测定,选用了过量的I2-KI 标准液滴定样品,再用Na2S2O3标准液滴定剩余的I2,进而测定样品中S2-的含量,这种滴定方法属于“返滴定”.建立思维模型:

3 有关滴定计算问题的备考及解题建议
“证据推理与模型认知”是中学化学学科核心素养之一,培养学生建立认知模型,并应用模型来解决化学现象、化学问题.思维模型的建立使学生的思维过程具体化、模式化,能突出重点,有化繁为简的作用.本文归纳了滴定计算的3种类型,总结了解决此类问题的思维模型和解题思路及方法.对于这类高考中的高频考点的稳定题型,学生如果能建构解题思维模型,有助于找到有效信息,快速精准地入题、破题、解题.同时也提升了学生筛选信息、整合信息的能力以及分析问题、解决问题的能力.
无论是理科综合考试还是新高考,学生都会面对题量大、信息多、时间紧张这些问题.很多学生遇到计算题就“退避三舍”.因此,对于计算类试题如何果断破题、快速解题显得尤为必要.学生可以通过上文归纳的滴定类型入手,学习建立解题模型,构建规范系统的计算过程,这无疑可以消除学生对计算的恐惧,增加信心,提升得分率,在高考中占据上风.
(完)

