lncRNA UCA1对口腔鳞状细胞癌细胞增殖、凋亡的影响及其机制研究
王怡,陈袁伟
[1.南京大学医学院附属口腔医院(南京市口腔医院),江苏南京210008;2.同济大学附属口腔医院口腔颌面外科,上海200072]
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最常见的头颈部肿瘤之一,是全球第六大最常见的癌症[1-2],发病率高,易发生淋巴结转移且易复发[3-4]。虽然目前OSCC的临床诊断和治疗方法有所进步,但是患者的5年生存率并没有明显的改善[5]。在过去的几年中,越来越多的研究证实长链非编码RNA(lncRNAs)参与了癌症的进展,有一部分研究还建议将其作为癌症标志物[6]。lncRNAs是一类>200个碱基且不具有蛋白编码能力的RNA分子[7],在细胞中具有多种功能,可以充当分子信号通过表观遗传,转录或转录后调节[8-9]。越来越多的证据表明lncRNAs在癌症细胞增殖、分化、凋亡和癌细胞转移过程中发挥了重要作用[10]。长链非编码RNA 尿路上皮癌相关基因1(lncRNA UCA1)在膀胱癌、乳腺癌和结直肠癌中异常表达,在多种肿瘤中发挥致癌作用,包括胶质母细胞瘤、膀胱癌、胃癌和前列腺癌等[11-14]。最近的研究也表明lncRNA UCA1参与了OSCC 的进展[15],然而其在OSCC 中的相关分子机制研究还很少。本研究旨在探讨lncRNA UCA1靶向miR-206 调控YAP1基因对OSCC 细胞增殖和细胞凋亡的影响,初步阐明其相关分子机制。
1 材料与方法
1.1 主要材料及试剂
HOK、TSCCA、SCCl5、HN13、CAL27、HSC3和SCC9 细胞均购自中国科学院上海细胞库。细胞培养相关试剂均购自美国Gibco 公司,Lipofectamine 3000 和实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)相关试剂盒均购自美国Thermo Fisher Scientific 公司,CCK-8 试剂盒购自上海碧云天生物技术有限公司,YAP1 一抗、二抗购自美国Cell Signaling Technology 公司,RNA 引物由北京擎科生物科技有限公司合成,UCA1、miR-206、YAP1、miR-206 mimics、miR-206 inhibitor 均由上海吉玛制药技术有限公司设计合成,流式细胞分析仪购自美国贝克曼库尔特有限公司。
1.2 细胞培养
将HOK、TSCCA、SCCl5、HN13、CAL27、HSC3 和SCC9细胞接种于含10%胎牛血清、青霉素(100 u/mL)、链霉素(100 μg/mL)的DMEM 培养基中,在5%二氧化碳、饱和湿度、37℃培养箱中培养,每2~3天传代1次。
1.3 采用Lipofectamine 3000进行细胞转染
将2×105个/mL密度的HN13细胞接种于6孔板中并生长浓度至60%,换用无血清培养基培养。取浓度为100 nmol/L的siUCA1(阴性对照为siNC)或50 nmol/L miR-206 mimics(阴性对照为mimics NC)或50 nmol/L miR-206 inhibitor(阴性对照为inhibitor NC)分别加入200 μL 无血清培基稀释,充分混匀,制成RNA 稀释液。在2 μL 的Lipofectamine 3000 中加入198 μL 无血清培养基稀释液体,充分混匀,制成Lipofectamine 3000 稀释液,室温静置5 min。将2 种稀释液充分混合,室温静置15 min,制备成转染复合物。将100 μL转染复合物滴加到含有1 mL无血清培养基的细胞上,前后移动培养皿,混合均匀。在5%二氧化碳、37℃培养箱内孵育6 h,换用正常培养基培养24 h 用于后续实验。控制组不做任何处理,对照组使用随机siRNA序列转染,实验组使用siUCA1转染。
1.4 qRT-PCR检测
采用TRIzol一步法提取细胞RNA,40 μL无核酸酶水溶解,置入-80℃冷冻保存。取0.5 μg 总RNA,用逆转录试剂盒合成cDNA,再行PCR 扩增目标基因。预先设计合成引物,将所得cDNA 加至PCR 反应体系中扩增目标片段。在待测样品中加入1 μL 模板、1 μL 正向引物、1 μL 反向引物、5 μL SYBR 探针和3 μL DEPC水避光混匀后,上机检测相关分子的表达。反应条件:95℃预变性15 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共40个循环。GAPDH和U6作为内参,根据2-∆∆Ct法计算基因相对表达量。引物序列见表1。

表1 引物序列
1.5 CCK-8法检测细胞增殖
以2×103个/mL 细胞密度接种于96 孔板中,设置24 h、48 h、72 h 和96 h 4 个时间点,每组设5 个复孔,培养过夜使细胞贴壁。待每组细胞处理并在相应时间点,每孔加入10 μL CCK-8试剂,继续培养2 h。最后在酶标仪450 nm 处测定吸光度(OD)值,重复3次,并绘制生长曲线。
1.6 流式细胞术检测细胞凋亡
将各组细胞培养至正常生长阶段,转染48 h 后胰酶消化,用磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤,1 000 r/min离心5 min,收集细胞;用预冷PBS重悬细胞1次,1 000 r/min离心5 min,洗涤细胞;加入300 μL Binding Buffer 重悬细胞;再加入5 μL Annexin V-FITC混匀,避光,室温孵育15 min;加入5 μL PI 染色5 min,补加200 μL Binding Buffer。用FlowJo 10分析细胞凋亡比率。
1.7 双荧光素酶报告基因结合位点
使用starBase(http://starbase.sysu.edu.cn/)预测miR-206 与UCA1、YAP1的靶向结合位点。将含UCA1 序列连接至双荧光素酶载体pGL3,得到pGL3-UCA1-WT 载体。同时,通过定点突变将结合位点突变(MUT),构建突变质粒pGL3-UCA1-MUT。同理,构建pGL3-YAP1-WT 和pGL3-YAP1-MUT 质粒载体。将HN13 细胞接种于96 孔板中24 h,当细胞融合到50%~70%时,分别将UCA1-WT 或UCA1-MUT 质粒(YAP1-WT 或YAP1-MUT)与mimics NC 或miR-206 mimics 同时转染HN13 细胞。用双荧光素酶报告基因检测系统测定48 h 荧光素酶相对活性。分别验证UCA1、YAP1的结合位点。
1.8 Western blotting检测
将各组细胞培养至对数生长期并转染24 h,胰酶消化并收集细胞,1 000 r/min 离心5 min,PBS 洗涤,用RIPA 裂解液分离提取细胞样本中的全蛋白,BCA 试剂盒检测蛋白浓度。蛋白行SDS-聚丙烯酰胺凝胶电泳后转至PVDF 膜上,浸入含5%脱脂奶粉的TBST(封闭液)中,室温下摇床封闭2 h。加入YAP1一抗(1∶1 000),4℃共同孵育8 h。PBS洗涤3次,加入相应二抗(1∶5 000),震荡孵育2 h。洗膜后,加入化学发光试剂显色、胶片曝光。使用凝胶成像分析系统拍照,通过Image J软件计算YAP1蛋白灰度值。
1.9 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞lncRNA UCA1、miR-206 mRNA 相对表达量比较
qRT-PCR 结果显示,HOK 细胞lncRNA UCA1 mRNA 相对表达量为(1.10±0.12)、TSCCA 细胞为(1.98±0.23)、SCCl5 细胞为(1.85±0.19)、HN13 细胞为(3.02±0.18)、CAL27 细胞为(2.32±0.15)、HSC3 细胞为(1.97±0.18)、SCC9 细胞为(2.59±0.15),经单因素方差分析,差异有统计学意义(F=37.580,P=0.000),TSCCA、SCCl5、HN13、CAL27、HSC3 和SCC9细胞均较HOK细胞升高(P<0.05)。
HOK 细胞miR-206 mRNA 相对表达量为(1.06±0.10)、TSCCA 细胞为(0.31±0.09)、SCCl5 细胞为(0.42±0.07)、HN13 细胞为(0.26±0.05)、CAL27 细胞为(0.38±0.08)、HSC3 细胞为(0.41±0.04)、SCC9 细胞为(0.40±0.13),经单因素方差分析,差异有统计学意义(F=32.070,P=0.000),TSCCA、SCCl5、HN13、CAL27、HSC3 和SCC9 细胞均较HOK 细胞降低(P<0.05)。其中HN13细胞miR-206 mRNA表达差异更显著,故选择该细胞株进行后续实验。
2.2 lncRNA UCA1促进OSCC细胞凋亡
qRT-PCR 结果显示,对照组lncRNA UCA1相对表达量为(1.05±0.08)、控制组为(1.05±0.10)、实验组为(0.21±0.07),经单因素方差分析,差异有统计学意义(F=99.991,P=0.000)。对照组与控制组比较,差异无统计学意义(P>0.05);对照组与实验组比较,差异有统计学意义(P<0.05),说明转染成功。
各组24 h、48 h、72 h 和96 h 的OD 值比较,经重复测量设计的方差分析,结果:①不同时间点的OD值有差异(F=191.904,P=0.000);②各组OD值有差异(F=27.801,P=0.000),实验组低于对照组;③各组的OD 值变化趋势有差异(F=9.042,P=0.000)。表明敲除lncRNA UCA1使细胞活力明显降低。见表2。
表2 各组不同时间点OD值比较(n=3,±s)

表2 各组不同时间点OD值比较(n=3,±s)
组别控制组对照组实验组24 h 0.19±0.05 0.21±0.03 0.21±0.05 48 h 0.32±0.04 0.31±0.03 0.25±0.03 72 h 0.50±0.04 0.51±0.03 0.35±0.03 96 h 0.88±0.10 0.99±0.13 0.56±0.06
流式细胞术结果显示,控制组凋亡率为(4.14±0.94)%、对照组为(4.04±1.46)%、实验组为(14.96±1.59)%,经单因素方差分析,差异有统计学意义(F=64.221,P=0.000)。对照组与控制组差异无统计学意义(P>0.05),实验组凋亡率较对照组升高(P<0.05),敲除lncRNA UCA1诱导细胞凋亡。见图1。

图1 3组NH13细胞凋亡率比较
2.3 lncRNA UCA1能够靶向miR-206
通过starBase 数据库预测lncRNA UCA1 与miR-206 存在结合位点,并构建了突变序列(见图2)。UCA1-WT 转染miR-206 mimics 荧光素相对活性为(0.48±0.08)、UCA1-MUT miR-206 mimics NC 为(1.04±0.09),经t检验,差异有统计学意义(t=7.849,P=0.001),UCA1-MUT 转染miR-206 mimics荧光素相对活性为(1.02±0.11),UCA1-MUT 转染mimics NC 为(1.01±0.19),经t检验,差异无统计学意义(t=0.395,P=0.713),UCA1-WT 荧光素酶相对活性被显著抑制(P<0.05),而UCA1-MUT 荧光素酶相对活性无显著变化(P>0.05),证实两者间的靶向结合关系。

图2 lncRNA UCA1与miR-206的结合位点
将对照组均分为对照组1 和对照组2,并分别转染siNC 和过表达空载体;将实验组均分为实验组1和实验组2,实验组1 和实验组2 分别转染siUCA1 和UCA1 过表达载体。qRT-PCR 结果显示,对照组1 miR-206 相对表达量为(1.02±0.07)、实验组1 为(2.34±0.23)、对照组2 为(1.06±0.09)、实验组2 为(0.22±0.08),经方差分析,差异有统计学意义(F=131.527,P =0.000),实验组1 较对照组1 升高(P<0.05),实验组2较对照组2降低(P<0.05)。
2.4 YAP1是miR-206的靶基因
通过starBase 预测miR-206 与YAP1 存在结合位点,并构建了突变序列(见图3)。YAP1-WT 转染miR-206 mimics 荧光素相对活性为(0.42±0.07)、YAP1-MUT miR-206 mimics NC 为(1.03±0.10),经t检验,差异有统计学意义(t=8.398,P=0.001),YAP1-MUT 转染miR-206 mimics 荧光素相对活性为(1.03±0.10),YAP1-MUT 转染mimics NC 为(1.04±0.15),经t检验,差异无统计学意义(t=0.365,P=0.733),YAP1-WT mimics荧光素酶活性被抑制(P<0.05),而YAP1-MUT mimics 荧光素酶活性无显著变化(P>0.05),证实两者的靶向结合关系。

图3 miR-206与YAP1的结合位点
控制组不做任何处理,对照组1和对照组2分别转染mimics NC 和inhibitor NC,实验组1 和实验组2分别转染miR-206 mimics 和inhibitor。qRT-PCR 结果显示,对照组1 的miR-206 mRNA 相对表达量为(1.01±0.18)、对照组2 为(1.04±0.21)、实验组1 为(2.56±0.19)、实验组2 为(0.22±0.08)、控制组为(1.05±0.10),经方差分析,差异有统计学意义(F=84.583,P=0.000)。对照组1、对照组2与控制组比较,差异无统计学意义(P>0.05),实验组1 miR-206 mRNA 相对表达量较对照组1 显著升高(P<0.05),实验组2 较对照组2 显著降低(P<0.05),提示miR-206 mimics 和inhibitor 细胞转染有效。另外,对照组1 的YAP1 mRNA 相对表达量为(1.08±0.18)、对照组2 为(0.99±0.12)、实验组1 为(0.47±0.06)、实验组2 为(1.68±0.19)、控制组为(1.00±0.16),经方差分析,差异有统计学意义(F=25.662,P=0.000),实验组1 较对照组1 降低(P<0.05),实验组2 较对照组2 升高(P<0.05)。Western blotting 检测结果显示,对照组1 的YAP1 蛋白相对表达量为(0.58±0.08)、对照组2 为(0.59±0.05)、实验组1 为(0.31±0.04)、实验组2 为(0.84±0.06)、控制组为(0.59±0.09),经方差分析,差异有统计学意义(F=28.324,P=0.000),实验组1 较对照组1降低(P<0.05),实验组2较对照组2升高(P<0.05)(见图4)。

图4 各组YAP1蛋白的表达
2.5 lncRNA UCA1 通过miR-206/YAP1 促进OSCC细胞的增殖并抑制凋亡
为进一步验证该信号机制,笔者在细胞中转染siUCA1 的同时转染miR-206 inhibitor,对照组不做处理,实验组1 转染siUCA1,实验组2 转染siNC 和miR-206 inhibitor 的阴性对照,实验组3 转染siUCA1和miR-206 inhibitor。对照组miR-206mRNA 相对表达量为(1.05±0.11)、实验组1为(2.45±0.15)、实验组2 为(2.37±0.25)、实验组3 为(1.16±0.12),经方差分析,差异有统计学意义(F=62.351,P=0.000),实验组1较对照组升高(P<0.05),促进了miR-206 的表达;实验组3 较实验组2 降低,抑制了miR-206 的表达(P<0.05)。对照组YAP1 mRNA 相对表达量为(1.09±0.16)、实验组1 为(0.45±0.07)、实验组2 为(0.43±0.08)、实验组3 为(0.96±0.13),经方差分析,差异有统计学意义(F=24.863,P =0.000),实验组1 较对照组降低(P<0.05),抑制YAP1 mRNA 的表达,实验组3较实验组2 升高(P<0.05),恢复YAP1 的表达。Western blotting 检测结果显示,对照组YAP1蛋白相对表达量为(0.67±0.08)、实验组1为(0.42±0.06)、实验组2 为(0.43±0.10)、实验组3 为(0.74±0.10),经方差分析,差异有统计学意义(F=11.503,P=0.003),实验组1 YAP1 蛋白相对表达量较对照组降低(P<0.05),抑制YAP1 蛋白的表达,实验组3 较实验组2 升高,恢复了YAP1蛋白的表达(P<0.05)(见图5)。

图5 各组YAP1蛋白表达
各组24 h、48 h、72 h、96 h 的OD 值比较,经重复测量设计的方差分析,结果:①不同时间点的OD值有差异(F=232.034,P=0.000);②各组的OD 值有差异(F=24.691,P=0.000);③各组的OD值变化趋势有差异(F=8.123,P=0.000)(见表3)。流式细胞术结果显示,对照组细胞凋亡率为(4.14±1.04)%、实验组1 为(14.14±1.49)%、实验组2为(14.54±1.81)%、实验组3为(6.06±1.67)%,经方差分析,差异有统计学意义(F=37.312,P=0.000)。实验组1细胞凋亡率较对照组升高(P<0.05),实验组3 较实验组2 降低(P<0.05)(见图6)。
表3 各组不同时间点OD值比较(n=3,±s)

表3 各组不同时间点OD值比较(n=3,±s)
注:①与对照组比较,P<0.05;②与实验组2比较,P<0.05。
组别对照组实验组1实验组2实验组3 96 h 0.93±0.06 0.58±0.06①0.56±0.10 0.86±0.08②24 h 0.19±0.05 0.21±0.04 0.21±0.04 0.22±0.03 48 h 0.32±0.03 0.27±0.04 0.25±0.03 0.30±0.03 72 h 0.52±0.06 0.36±0.05①0.35±0.07 0.51±0.05②
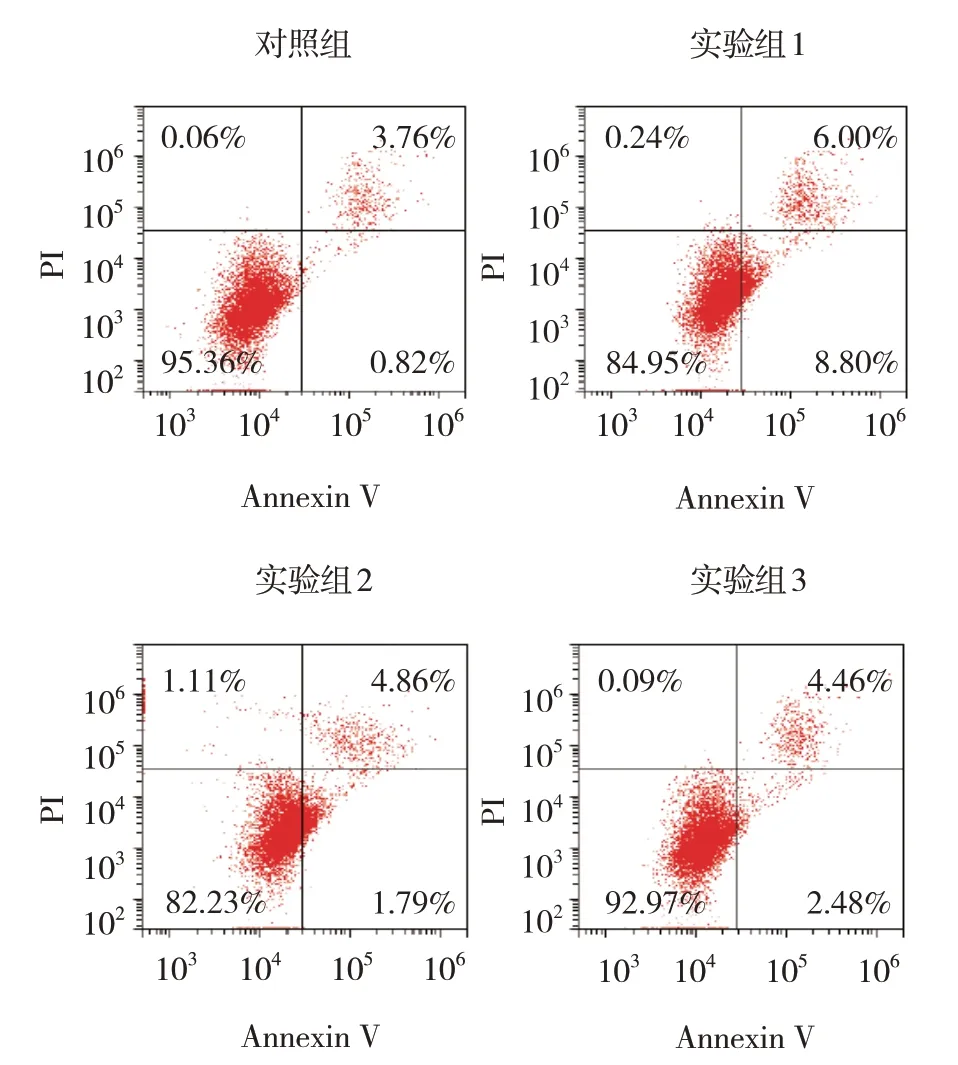
图6 各组NH13细胞流式细胞图
3 讨论
近年来,越来越多的研究证实了lncRNAs 通过调控细胞的增殖、分化、迁移侵袭等生物学进程参与癌症的进展[10]。目前发现多种lncRNA 在OSCC 中表达有差异, lncRNA HOXA11-AS、lncRNA AC007271.3 和lncRNA CASC9 等在OSCC 中高表达从而促进OSCC 细胞增殖,抑制凋亡,加速OSCC 的进展[16-18]。现今lncRNA UCA1已经被报道在胶质母细胞瘤、膀胱癌、胃癌和前列腺癌等癌症中发挥致癌作用[11-14]。而少有的几篇关于lncRNA UCA1在OSCC 中的研究证实了其在OSCC中表达升高,并能够促进细胞增殖和增强耐药性[15,19-20]。本研究结果与其一致,证实lncRNA UCA1在OSCC细胞中的表达水平显著高于人正常口腔角质细胞,通过抑制lncRNA UCA1表达能够显著阻碍细胞增殖并促进细胞凋亡。并且通过生物信息学预测结果与实验验证发现lncRNA UCA1通过miR-206/YAP1 促进OSCC 进展的分子机制,这是不同于先前报道的新发现。
miRNAs也是一种非编码RNA且高度保守,长度只有20~25 个核苷酸,能通过与靶基因mRNA 结合调控蛋白表达,参与多种细胞生物学过程[21]。已有文献证实miRNAs能够参与各种疾病的进展,尤其是癌症[22]。其中,miR-206 在癌症中作为一种抑癌因子,通常抑制癌症进展,这已在非小细胞肺癌[23]、前列腺癌[24]、甲状腺癌[25]和宫颈癌[26]等研究中得到证实。目前关于miR-206 在OSCC 中的功能尚不清楚,而本研究证实miR-206 在OSCC 细胞中表达水平显著降低,其作为肿瘤抑制因子发挥作用,这与miR-206在其他癌症中的研究结果相一致。并且本研究结果证实miR-206能够与lncRNA UCA1互补结合,其表达被lncRNA UCA1调控,并进一步影响下游基因表达。而通过转染miR-206 inhibitor 抑制miR-206 的表达能够逆转siUCA1 的功能,促进细胞增殖,抑制细胞凋亡。此外,本研究结果证实了miR-206 是通过调控YAP1蛋白的表达水平实现对癌细胞生物学过程的调控。
YAP1表达水平升高往往促进癌症的进展,相关研究表明YAP1能够促进结直肠癌上皮间质转化和血管生成[27],在乳腺癌[28]、甲状腺癌[29]和胰腺导管癌[30]中都具有促癌作用。有研究表明,YAP1 同样也在OSCC 中发挥了促癌作用,对其抑制能够显著抑制癌症进展[31-33],本研究结果与以上结果一致,YAP1 能够促进OSCC 细胞增殖,抑制凋亡。本研究还证实YAP1是miR-206 的1 个靶基因,其表达受到miR-206的调控,而lncRNA UCA1能够通过miR-206间接调控YAP1 的表达,从而影响OSCC 细胞的增殖、凋亡,参与OSCC 的进展。本研究结果显示了敲除lncRNA UCA1后,YAP1 蛋白表达水平显著下降,同时细胞活力显著降低,凋亡细胞显著增多。本研究通过敲除lncRNA UCA1在OSCC中的表达,证实了其促癌作用,并生物信息学预测结果和双荧光素酶验证了miR-206和lncRNA UCA1、YAP1 间的靶向结合关系,进一步实验验证了三者在OSCC中的相互作用及对OSCC进展的影响。
综上所述,本研究阐明了lncRNA UCA1在OCSS中通过靶向miR-206调控YAP1的表达,介导OSCC细胞增殖和凋亡,这一分子机制的发现为OSCC的诊断和治疗提供了新思路。然而,鉴于lncRNAs的多功能靶向作用,lncRNA UCA1在OSCC 中更详细的分子机制还有待进一步探索,对其在临床诊断治疗中的应用还需更多的研究和论证。

