头颈癌放射治疗口腔感染病原菌的特点及危险因素分析*
段红红,王伟
(1.邢台市人民医院放疗科,河北邢台054000;2.邢台医学高等专科学校第二附属医院手术室,河北邢台054099)
头颈部是肿瘤好发部位,头颈部恶性肿瘤占恶性肿瘤的5%~8%,包括耳鼻喉科肿瘤、颈部肿瘤及口腔颌面部肿瘤[1]。放射治疗(以下简称放疗)、化学治疗(以下简称化疗)是治疗头颈部恶性肿瘤的主要方法,但放疗不仅杀伤肿瘤细胞,对正常细胞组织也具有杀伤作用。有报道指出,放射线会损伤唾液腺,减少唾液分泌,削弱牙齿自我保护功能,易发生口腔感染[2]。另有研究表明,放疗造成的唾液分泌减少常伴随口腔内菌群平衡被破坏,造成菌斑堆积,增加患者机会性感染风险[3]。头颈癌放疗患者发生口腔感染不仅影响正常饮食,增加治疗风险,若处理不及时或不得当还会中断治疗,影响预后。故本研究分析邢台市人民医院收治的头颈部恶性肿瘤放疗患者临床资料,探讨其口腔感染病原菌特点及发生的危险因素,为临床防治提供参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月—2020年1月邢台市人民医院收治的头颈部恶性肿瘤行放射治疗的636 例患者临床资料。其中,男性371 例,女性265 例;年龄24~75 岁, 平均(60.90±6.82)岁。 参照《NCCN 头颈癌诊治指南(2007 版)》[4]作为诊断标准。纳入标准:①确诊头颈部肿瘤并需要放疗;②年龄≥18 岁。排除标准:①合并呼吸道感染者;②临床病案资料不完整者;③合并严重肝、肾功能异常者;④近期使用抗生素、激素、口腔黏膜保护剂治疗者;⑤合并免疫、血液系统疾病或其他恶性肿瘤者。将124 例患者发生口腔感染作为口腔感染组,512 例患者未发生口腔感染作为未口腔感染组。患者均签署知情同意书。
1.2 方法
标本采集及病原菌检测:嘱咐患者张口发“啊”音,将咽喉暴露,使用已消毒的长棉签轻柔擦拭患者腭弓、咽或扁桃体上分泌物。试管口消毒后将采集标本置于试管中,送检。采用梅里埃VITEK 2 Compact全自动细菌鉴定药敏系统鉴定细菌种类。
记录患者性别、年龄、文化程度、肿瘤分期、肿瘤部位、口腔环境、口腔自洁习惯、化疗、糖尿病、高血压、抗生素使用、口腔黏膜保护剂使用情况,并分析影响头颈癌放疗患者口腔感染的危险因素。口腔环境为口腔整体情况,包括唇、舌、牙、牙周组织等的健康状况与口腔颜色、气味;口腔自洁习惯为患者日常进行口腔清洁的方式与频率,通过问卷调查收集数据,均由口腔科医生评定。
1.3 评价指标
口腔感染情况及菌群分布:参照《医院感染诊断标准》[5]中口腔感染诊断标准:①经组织病理检查或外科手术证实口腔感染;②口腔中有脓性分泌物;③临床医师诊断感染并采取口腔抗真菌治疗。符合以上任意一条者即可诊断口腔感染。口腔感染发生率=口腔感染发生例数/总例数×100%。根据病原菌培养、鉴定结果,记录分析头颈癌放疗患者口腔感染病原菌分布情况。
1.4 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;影响因素的分析采用多因素Logistic 回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 口腔病原菌分布
共检出病原菌182 株。真菌感染71 例,其中感染白色念珠菌最多,为57 例(31.32%);革兰阳性菌感染59 例,其中感染金黄色葡萄球菌最多,为34 例(18.68%);革兰阴性菌感染52 例,其中感染大肠埃希菌最多,为28 例(15.38%)。见表1。

表1 病原菌分布 株(%)
2.2 两组患者临床资料比较
两组患者年龄、文化程度、肿瘤分期、口腔环境、口腔自洁习惯、化疗、糖尿病、抗生素使用情况比较,差异有统计学意义(P<0.05)。两组患者性别、肿瘤部位、高血压、口腔黏膜保护剂使用情况比较,差异无统计学意义(P>0.05)。见表2。

表2 头颈癌放疗患者口腔感染组与未口腔感染组临床资料比较
2.3 影响头颈癌放疗患者口腔感染的多因素Logistic回归模型分析
以患者口腔感染为因变量,发生赋值为“1”,将单因素分析后差异有统计学意义的因素(年龄、文化程度、肿瘤分期、口腔环境、口腔自洁习惯、化疗、糖尿病、抗生素使用情况)作为自变量,建立多因素Logistic 回归模型。各因素赋值见表3。在校正各个资料带来的影响后,结果显示:年龄大[=2.517(95% CI:1.362,4.364)]、肿瘤分期高[=2.953(95% CI:1.473,6.201)]、口腔环境差[=2.805(95% CI:1.339,5.955)]、口腔自洁习惯差[=2.979(95% CI:1.817,7.509)]、化疗[=3.164(95% CI:2.072,9.116)]、合并糖尿病[=4.102(95% CI:2.239,10.254)]、未使用抗生素[=2.331(95% CI:1.261,3.889)]是影响头颈癌放疗患者口腔感染的危险因素(P<0.05)。见表4。
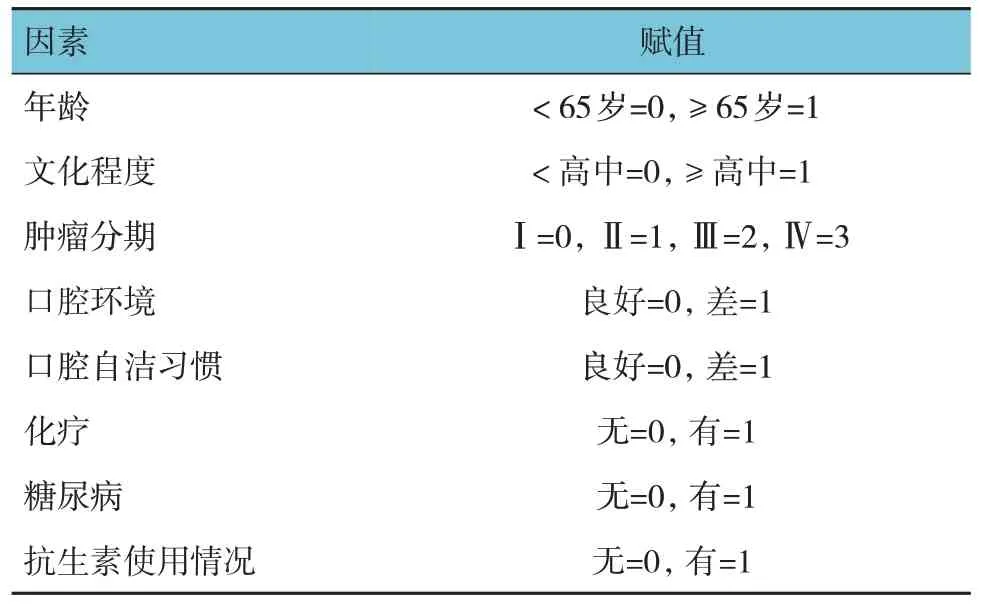
表3 赋值表

表4 影响头颈癌放疗患者口腔感染的多因素Logistic分析参数
3 讨论
口腔是病原菌侵袭机体的重要途径之一,正常情况下,口腔黏膜可抵御病原菌,防止病原菌进一步侵犯机体[6]。但放疗过程中放射线会直接损伤口腔黏膜,减少唾液分泌,机体免疫力下降及抗菌药物的滥用等导致患者体内微环境平衡被打破,口腔不良反应率较高,如放射性口腔黏膜炎、口腔黏膜感染、牙周破坏等[7]。有文献指出,部分放疗患者口腔黏膜病原菌感染后发生移形、易位,引发呼吸道感染,甚至发生败血症危及生命[8]。因此防治口腔黏膜感染对改善头颈部恶性肿瘤放疗患者预后具有重要意义。
有研究显示,鼻咽癌患者放疗前后唾液标本中葡萄球菌、念珠菌以及大肠杆菌等显著增加[9]。另有研究发现,头颈部肿瘤患者放疗后唾液标本中奈瑟菌、假单胞菌明显增加[10]。本研究结果显示,636 例头颈癌放疗患者中124 例发生口腔感染,口腔感染发生率19.50%。其中检出真菌71 株,占比最高,提示真菌是头颈部恶性肿瘤患者放疗后较易感染病原菌,可能与临床上预防性使用抗菌药物有关。真菌感染中以白色念珠菌感染为主,占31.32%。分析认为白色念珠菌多存在于人口腔、呼吸道、肠道等,其致病力和侵袭力强,代谢产物还可抑制机体免疫功能,因此头颈部恶性肿瘤放疗患者最易感染[11]。本研究中头颈部肿瘤放疗患者革兰阳性菌与革兰阴性菌感染率相当,阳性菌以金黄色葡萄球菌为主,阴性菌以大肠埃希菌为主,与报道[13]有所不同,可能与不同地区、不同医院菌种流行情况不同有关。
有研究指出,高龄住院患者由于器官衰退、免疫功能低下及合并多种慢性疾病更易发生院内获得性感染[12]。本研究结果显示,口腔感染与口腔未感染头颈癌放疗患者年龄具有统计学差异。经多因素分析,年龄大是影响头颈癌放疗患者口腔感染的独立危险因素,与文献[13]报道结论一致。本研究多因素分析结果显示,临床分期高是影响头颈癌放疗患者口腔感染的危险因素。相关报道指出,约70%的院内获得性感染患者分离出的病原菌与口腔定植菌同源[14]。本研究中,口腔环境差、口腔自洁习惯差均是影响头颈癌放疗患者口腔感染的危险因素。分析认为口腔自洁习惯差者大多口腔环境较差,适宜口腔内致病病原菌生存和繁殖,提高了口腔感染的发生风险[15]。化疗也是头颈癌肿瘤治疗过程中的另一有效措施,但化疗不良反应较放疗更多、更严重,口腔黏膜损害就是其常见的不良反应之一[16]。本研究中,化疗是影响头颈癌放疗患者口腔感染的危险因素。分析认为除了化疗对口腔黏膜的直接损害外,化疗导致机体白细胞下降、免疫力下降、骨髓抑制等也是口腔感染风险增加的重要原因。本研究中,合并糖尿病患者口腔感染率明显高于未合并糖尿病患者,经多因素分析,合并糖尿病是影响头颈癌放疗患者口腔感染的危险因素。相关研究指出[17],老年淋巴瘤放疗患者预防性使用抗生素较未使用抗生素者口腔黏膜反应轻,感染发生率低。抗生素能有效灭杀口腔环境中细菌,降低炎症反应。本研究中,预防性使用抗生素患者口腔感染发生率较低。
综上所述,头颈癌放疗患者口腔易发生真菌感染,年龄大、肿瘤分期高、口腔环境差、口腔自洁习惯差、化疗、合并糖尿病、未使用抗生素是头颈癌放疗患者发生口腔感染的高危因素。

