鲜食葡萄果实单萜合成关键基因的eQTL分析
王慧玲,闫爱玲,孙磊,张国军,王晓玥,任建成,徐海英*
鲜食葡萄果实单萜合成关键基因的eQTL分析
王慧玲1,闫爱玲2,孙磊3,张国军1,王晓玥1,任建成1,徐海英1*
1北京市农林科学院林业果树研究所,北京 100093;2北京市落叶果树工程技术研究中心,北京 100097;3农业部华北地区园艺作物生物学与种质创制重点实验室,北京 100097
【目的】通过对鲜食葡萄果实单萜合成关键基因进行eQTL定位及候选基因挖掘,深入了解单萜合成调控机制,为优良玫瑰香味葡萄新品种培育及种质改良奠定基础。【方法】以‘摩尔多瓦’ב瑞都香玉’F1代群体及亲本为供试材料,分别在转色期和成熟期采集葡萄果实样品;利用实时荧光定量qPCR技术对7个单萜合成途径基因(、、、、、和)的表达量进行检测获得表达性状表型数据;基于区间作图法,采用MapQTL6.0软件,对单萜基因表达性状进行eQTL定位分析;将eQTL连锁标记定位到基因组区域,通过Ensembl Plants和NCBI数据库进行基因注释;利用葡萄全基因组芯片技术检测不同发育时期亲本果实样品中候选基因的表达谱。【结果】7个单萜合成基因表达量在F1代群体中呈现连续分布数量遗传特征;各个单萜基因表达之间具有显著的相关性;在转色期,7个表达性状一共定位到13个eQTL,主要位于1号、6号、14号、16号、17号、10号和12号等染色体上,表型解释率介于12.2%—23.5%。其中位于14号染色体的eQTL(qDXS1-v14、qHDR-v14-1和qTerp-v14)覆盖相同的遗传区间57.582—76.979 cM,qLiner-v10、qTerp-v10和qGermD-v10共定位到10号染色体相同的遗传区间;在成熟期,共检测到16个eQTL,主要位于1号、6号、12号、8号、13号和19号等染色体。qDXS1-m6-2、qDXR-m6-2、qLiner-m6和qGermD-m6共定位到6号染色体139.212—143.161 cM遗传区间;针对成熟期与转色期各个基因的表达量比值变化进行定位分析,共检测到18个eQTL,分别位于1号、3号、7号、10号、12号、15号和19号等染色体。定位于12号染色体的qDXS1-r12-1、qDXR-r12-1、qHDR-r12、qLiner-r12和qGermD-r12覆盖相同的遗传区间6.330—6.967 cM。对多个基因表达性状共定位的eQTL区域进行基因注释,共筛选到90个转录因子基因,表达谱及相关性分析最终确定11候选基因。其中4个候选基因(、、和)与激素信号通路调控相关,一个候选基因()编码光敏色素作用因子与光响应相关,还有一些编码Myb类、WRKY类转录因子或者未知功能蛋白基因。【结论】在两个不同的生长发育期共检测到37个与单萜合成基因表达性状连锁的eQTL,主要定位于6号、10号、12号和14号染色体。基于基因注释和表达谱分析结果,确定了包含和在内的11个可能的候选基因,这些候选基因与多个单萜基因表达高度相关。
葡萄;单萜;关键基因;eQTL
0 引言
【研究意义】单萜是葡萄果实重要的次生代谢产物,赋予葡萄及葡萄酒怡人的玫瑰香味。深入研究其合成调控机制,挖掘调控单萜合成的关键基因,对于指导香味葡萄分子育种及提高品质育种的效率具有重要的理论意义和应用价值。【前人研究进展】单萜是葡萄果实中含量最丰富的萜类化合物,根据游离态单萜类化合物的含量高低,欧洲种酿酒葡萄品种被分为玫瑰香型(游离态单萜化合物总量高达6 mg∙L-1)、非玫瑰香芳香型(游离态单萜化合物总量达1-4 mg∙L-1)和非芳香型(游离态单萜化合物总量低于1 mg∙L-1)三类[1]。通过比较基因组学和反向遗传学等方法,人们对于单萜物质合成的途径和一些关键的基因有了一定了解。葡萄中的单萜主要是通过位于质体中的脱氧-木酮糖-5-磷酸/甲基磷酸赤藓糖途径(DXP/MEP)合成[2]。由丙酮酸(pyruvate)和3-磷酸甘油醛(G3P)开始,在1-脱氧-木酮糖-5-磷酸合酶(DXS1和DXS3)的作用下转化成1-脱氧-木酮糖-5-磷酸(DOXP),之后1-脱氧-木酮糖-5-磷酸还原异构酶(DXR)催化将DXP转化成2-甲基-赤藓糖醇-4-磷酸(MEP)。MEP经一系列酶作用形成1-羟基-2-甲基-2-(E)-丁烯-4-二磷酸(HMBPP),并在异戊烯基单磷酸激酶(HDR)的作用下催化形成中间体异戊烯基焦磷酸(IPP,C5)及其双键异构体二甲基烯丙基焦磷酸(DMAPP,C5),最后各1分子的两同分异构中间体IPP和DMAPP在香叶基二磷酸合酶(GPPS)的作用下经头尾缩合生成香叶基二磷酸(GPP)。GPP是所有单萜化合物生物合成的底物,在单萜合成酶(mono-TPS)作用下催化合成一系列单萜化合物。但是对调控单萜合成的关键基因位点还不明确,是由合成途径中的某个基因还是多个基因调控,亦或是存在其他的调节因子。基于遗传图谱构建和数量性状基因座(quantitative trait loci,QTL)的扫描与定位方法,国外科学家依据人类对葡萄果实香味的感官评价进行QTL分析,将相关基因定位在1、5和7号染色体上[3-4]。此后,对3—5种单萜化合物进行气相质谱(GC/MS)测量分析作为性状分离数据,在第5、10连锁群上检测到与五种单萜含量有关的QTL位点,其中在第5号连锁群上发现一个控制5种单萜总含量的主效QTL与单萜合成途径的第一个基因定位在一起[5-6],通过进一步研究发现葡萄果实中单萜含量高低与的第1 822位单核苷酸突变密切相关[7]。近年来,国内科学家也针对本土葡萄品种进行单萜的遗传位点分析,鉴定出一些新的QTL位点[8-10]。【本研究切入点】目前的研究主要集中于感官评价和单萜化合物分析数据,忽略了基因表达水平的差异对性状的影响。生物的表型性状受基因控制,而基因的表达水平则是基因和表型性状间的桥梁,因此,鉴定出调控基因表达水平的调控因子,可以更加深入地揭示生物代谢发育的遗传机理。将基因表达水平视为数量性状,并按照遗传学方法对这些数量性状进行QTL定位,得到基因表达的数量性状基因座(expression quantitative trait loci,eQTL),可以鉴别控制基因表达的上游调控位点、推断出调节基因和被调节基因之间的相关关系及因果关系,以阐明基因调控的机制,从而在表达及调控两个水平研究控制复杂性状的遗传基础[11]。eQTL定位已经被成功应用到多种植物中,如拟南芥[12]、玉米[13]和小麦[14]等,成为国际上一个新的研究热点。在葡萄中,该方法也成功应用到花色苷和原花色素合成关键调控基因挖掘中[15-16]。【拟解决的关键问题】本研究以不同发育时期杂交后代群体及亲本葡萄果实为材料,结合实时荧光定量基因表达分析技术和传统的QTL定位方法,对7个单萜合成途径关键基因(、、、和3个单萜合成酶基因、、)表达水平进行eQTL分析,研究单萜的调控机制,挖掘出重要的调控基因位点,为优良玫瑰香味葡萄新品种培育及种质改良奠定基础。
1 材料与方法
1.1 试验材料
本试验以2010年母本‘瑞都香玉’与父本‘摩尔多瓦’杂交构建的F1代群体及亲本为研究材料。‘瑞都香玉’属于欧亚种,是北京市林业果树科学研究院通过‘京秀’和‘香妃’杂交育成,果实黄绿色,果皮薄,果肉硬脆,具有浓郁的玫瑰香味,单萜含量较高[17]。父本‘摩尔多瓦’,欧美杂种,由葡萄品种‘Guzal Kara’和‘Villard blanc’杂交而得,1997年引入中国,没有玫瑰香味,单萜含量低[18]。2011年对该群体进行定植,共236株,从中随机选出160个健壮单株构建作图群体。F1群体与亲本单株均定植于北京市林业果树科学院葡萄试验园内(北纬39°58′,东经116°13′),单臂篱架水平龙干整形,株行距0.75 m×2 m,南北走向,采用简易避雨、地表园艺地布覆盖、滴灌供水和常规病虫害等管理模式,生长期内修剪及肥水管理一致。
1.2 试验方法
1.2.1 样品采集 于2018年对F1代群体及亲本进行果实样品采集。研究表明玫瑰香型葡萄果实单萜化合物积累从转色期开始[19-20],基于此,本研究取样主要分为两个时期:转色期和成熟期。因为杂交群体各个样本的转色和成熟时间都不相同,依据往年物候期记载,转色时间主要分布在6月下旬至7月中旬,每5 d对样本植株的果实成熟度进行跟踪观察,发现果实转色后(50%果粒变红或者变软)随即进行取样。果实的成熟期根据果实种子颜色变褐状况并结合可溶性固形物含量(°Brix≥16)进行判断。成熟时间主要分布在8月中旬至9月下旬,与转色期取样一致,每5 d对果实成熟度进行观察,发现果实成熟随即进行取样。
在每一杂交株上随机选取3穗果实,每一穗从不同位置选取大约10—20个果实作为一个重复。采收后样品用液氮速冻,放入-80℃冰箱中冷冻保存。
两个亲本不同发育时期果实样品采集分为3个时期:幼果期(花后20 d),转色期(50%果粒变红或者变软)和成熟期(°Brix≥16),在两个亲本品种上随机取3—5穗果实,每一穗从不同位置选取大约15—20个果实作为一个重复,每个时期采3个重复,采集后马上用液氮速冻,置于-80℃冰箱中备用。
1.2.2 RNA提取和cDNA合成 取大约10粒葡萄果实置于预冷的研钵中,在液氮保护条件下将葡萄碾碎、去籽去梗,磨成粉末,取1 g粉末用于总RNA提取,总RNA提取采用植物RNA快速提取试剂盒(北京华越洋生物科技有限公司)进行,提取步骤详见试剂盒说明书。RNA质量和浓度采用琼脂糖凝胶电泳和NanoDrop 3300(Eppendorf)进行检测。然后使用反转录试剂盒(Promega,A3500),参照说明书反转录成cDNA,置于-80℃保存备用。
1.2.3 实时荧光定量PCR分析 利用伯乐CFX 96实时荧光定量PCR仪(Bio-Rad,Richmond,CA)分析转录本的数量,反应体系为:10 μL SYBR Green RT-PCR Master Mix(ABI 4385612),1 μL cDNA,和0.5 μL引物,8 μL ddH2O,共20 μL。反应条件:95℃预变性20 s,95℃ 10 s,60℃ 31 s,40个循环。
基因表达相对定量分析采用2-ΔΔCT法,选取和内参基因作为葡萄果实基因表达的参比标准。每个基因PCR扩增有3个重复。在单萜生物合成途径中7个关键基因及内参基因的引物序列参照孙磊等[21]的方法合成。
1.2.4 单萜合成基因eQTL检测 基于已经构建好的葡萄高密度遗传图谱[22],采用QTL分析软件mapQTL6.0[23]及区间作图法,进行eQTL定位和效应分析,首先通过PT检验1 000次设定LOD阈值,先考虑0.99置信度对应的阈值,若没有定位区间则考虑0.95置信度对应的阈值;若没有定位区间则考虑0.90置信度的阈值。若仍没有结果则不考虑PT检验的结果,手动降低LOD阈值到3.0;若3.0没有区间则降到2.5;若2.5没有区间则降到2。确定主要eQTL,并将eQTL连锁标记定位到基因组区域,通过Ensembl Plants(http://plants.ensembl.org/index.html)和NCBI(https://www.ncbi.nlm.nih.gov/)数据库进行基因注释;如果在此区间内存在单萜合成基因则该eQTL为-eQTL,表明基因自身定位于此;如果此区段未发现单萜合成基因,则该eQTL为-QTL,表明该eQTL可能为该基因上游调控基因的所在位点。
1.2.5 基因表达芯片检测 亲本不同发育时期果实样品总RNA采用QIAGEN的Micro Kit试剂盒纯化(加入PolyA control),具体步骤参照说明书;cDNA合成使用Affymetrix one-cycle cDNA Synthesis Kit;之后采用Affymetrix Gene Chip Sample Cleanup Module进行纯化;cDNA标记使用Affymetrix Gene Chip IVT Labeling Kit,纯化使用Affymetrix Genechip Sample Cleanup Module,所有操作参考说明书。本研究所用的葡萄基因芯片为美国Affymetrix公司基因芯片(GeneChip®Genome Array)。葡萄基因芯片与样品杂交由北京中康博科技有限公司完成,具体杂交过程按照芯片杂交要求完成。芯片杂交信号数据采用GeneChip 3000 7G扫描仪进行扫描。扫描仪通过捕获荧光信号,并通过GCOS软件将信号转化,从而获得每个探针的信号值,生成CEL文件。差异表达的基因使用Ensemble plant、NCBI和Swissprot数据库进行基因注释。
1.3 数据处理与统计分析
数据统计利用分析软件Excel 2007,采用SPSS 13.0进行Spearman和Pearson相关性分析,差异显著水平<0.05;聚类分析采用MetaboAnalyst 5.0[24];绘图采用Sigma Plot 10.0。
2 结果
2.1 杂交后代及亲本果实单萜合成途径关键基因表达遗传规律分析
由图1-A可见,在转色期,大部分单萜合成途径基因在双亲中的表达并不存在明显差异,父本‘摩尔多瓦’中的表达水平略高于母本‘瑞都香玉’。F1群体中均表现连续的分布模式,呈现多基因控制的数量性状遗传特点。到成熟期,除了,大部分检测基因的表达水平高于转色期,且母本‘瑞都香玉’中的表达水平明显高于父本,在F1杂交后代中也表现连续的分布模式(图1-B)。进一步对各个基因成熟期与转色期表达量比值进行分析,在果实成熟过程中,各个基因在‘瑞都香玉’中的表达变化明显高于父本‘摩尔多瓦’,并且在F1群体中呈现连续分布的数量遗传特征(图1-C)。
两个不同发育时期的这7个单萜合成基因之间均存在显著的正相关(表1)。转色期,各个单萜基因之间相关系数在0.40—0.91;成熟期,各个单萜基因之间相关系数在0.34—0.94。相较于其他单萜合成相关基因,的相关系数较低(转色期0.40—0.65,成熟期0.34—0.47),可能该基因存在不一样的调控位点。不同单萜合成途径基因之间具有非常显著的相关性,表明它们之间不是互相独立的,推测它们可能具有相同的上游调控基因。
2.2 单萜合成途径关键基因eQTL分析
基于7个单萜合成途径基因在后代群体转色期和成熟期果实中的表达数据,利用父母本整合图谱进行eQTL分析。由表2可知,在转色期,7个基因表达性状一共定位到13个eQTL,主要位于1号、6号、14号、16号、17号、10号和12号等染色体上,表型解释率介于12.2%—23.5%。其中检测到3个eQTL(qDXS1-v1、qDXS1-v6和qDXS1-v14),分别位于1号、6号和14号染色体,表型解释率为17%、15.7%和15.9%;也定位到3个eQTL:qDXS3- v12、qDXS3-v16和qDXS3-v17,分别位于12号、16号和17号染色体,表型解释率介于16.4%—23.5%;与表达量连锁的eQTL有1个(qDXR-v17),位于17号染色体上标记Marker179340和Marker108104之间,解释率为14.4%;在14号染色体检测到2个eQTL(qHDR-v14-1和qHDR-v14-2),表型解释率分别为16.7%和15.6%;而3个单萜合成酶基因、和均在10号染色体检测到eQTL(qLiner-v10、qTerp-v10和qGermD-v10),解释率介于13.7%—16%,这3个eQTL共定位到相同的遗传区间146.183—148.835 cM,说明在这个位点可能存在同时调控3个基因表达的重要基因。此外,还在14号染色体检测到1个eQTL(qTerp-v14),这个eQTL与qDXS1-v14和qHDR-v14-1定位到相同的遗传区间57.582—76.979 cM,说明这个位点可能与和这两个基因表达相关。
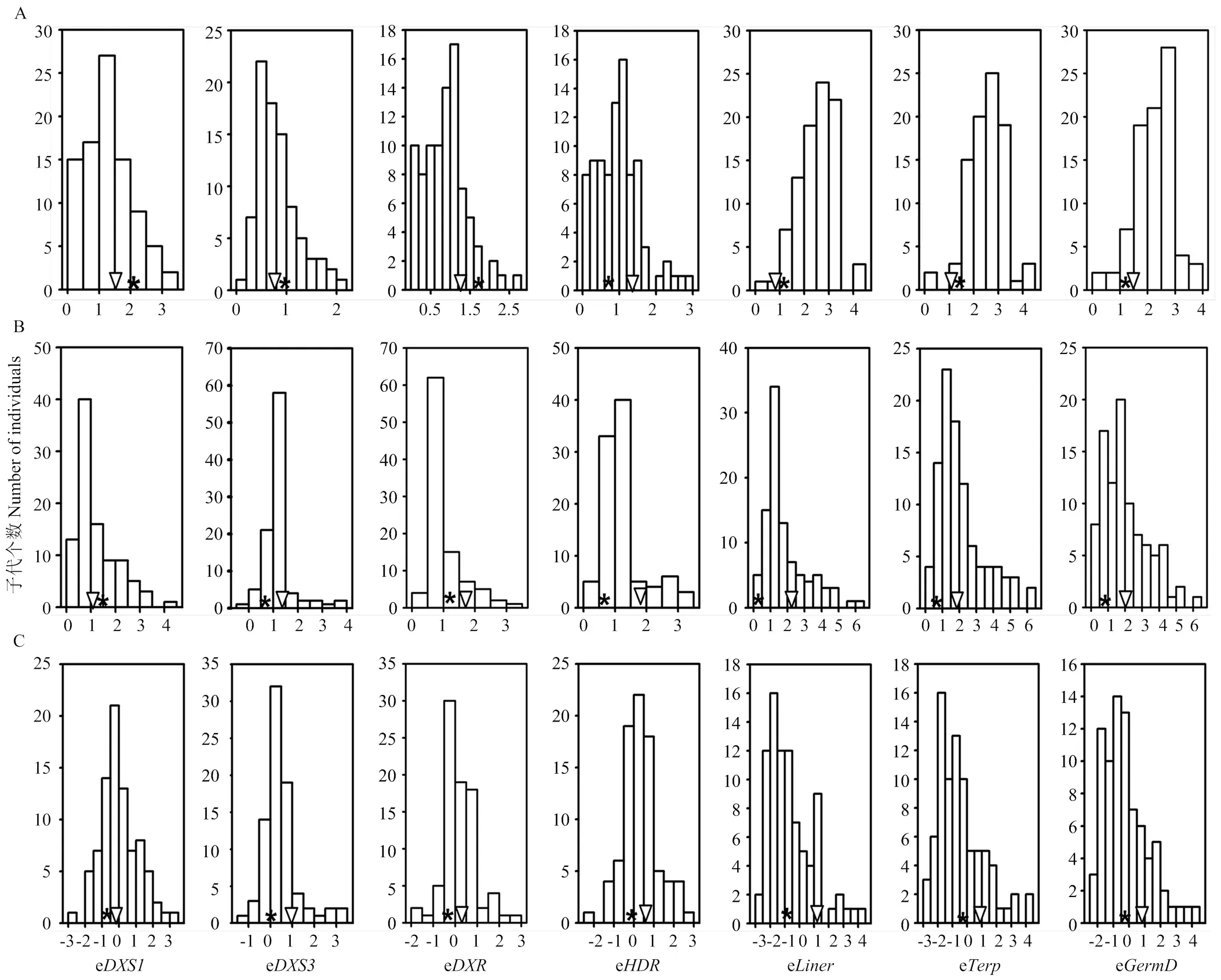
A:转色期;B:成熟期;C:成熟期与转色期表达量比值;“*”代表父本‘摩尔多瓦’;“▽”代表母本‘瑞都香玉’
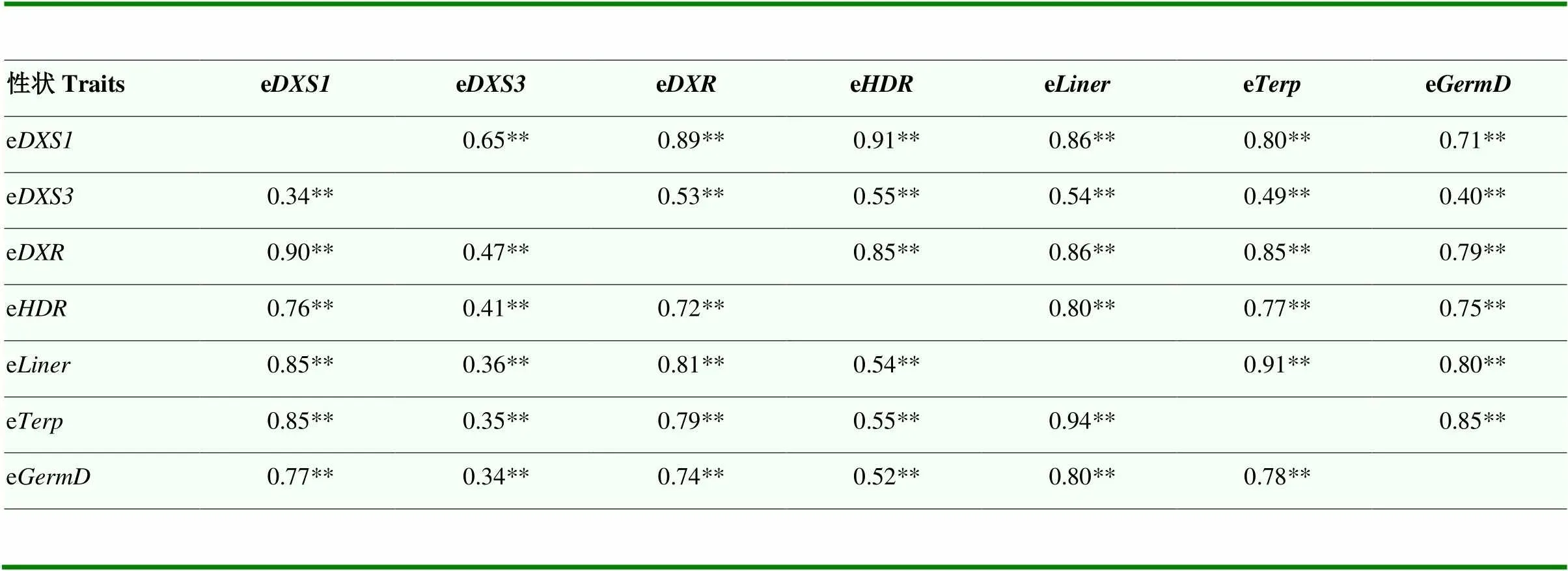
表1 单萜合成相关基因相对表达之间的相关性分析
左下:成熟期;右上:转色期 Bottom left: Mature stage; Top right: Verasion stage
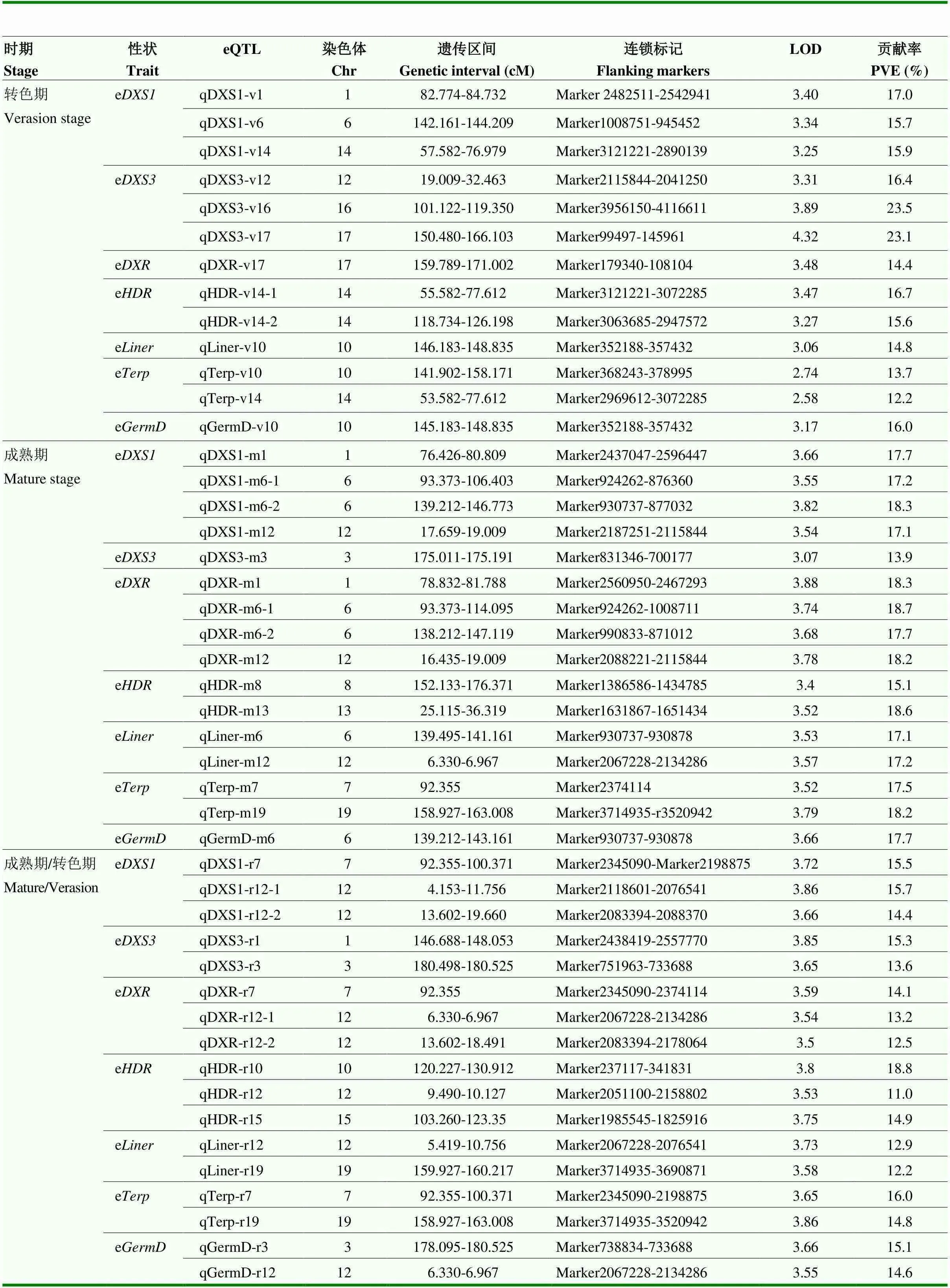
表2 中性图谱单萜合成相关基因eQTL信息
在成熟期,7个基因的表达量性状数据共定位到16个eQTL,主要位于1号、6号、12号、8号、13号、3号和19号等染色体(表2)。其中与和相连锁的eQTL位于1号、6号和12号染色体,qDXS1-m1和qDXR-m1、qDXS1-m6-1和qDXR-m6-1、qDXS1-m6-2和qDXR-m6-2、qDXS1-m12和qDXR-m12均定位到相同遗传区域,该区间可能有共同的基因调控这两个基因的表达;相关eQTL位于3号染色体,介于Marker831346和Marker700177之间,解释率13.9%;与表达量相关的eQTL分别位于8号(qHDR-m8)和13号(qHDR-m13)染色体;和表达量也在6号染色体定位到eQTL,说明6号染色体上存在调控单萜合成的关键基因;与连锁的eQTL位于7号和19号染色体。
进一步以成熟期与转色期各个基因的表达量比值变化作为表型数据进行分析,在遗传图谱上共检测到18个eQTL,分别位于1号、3号、7号、10号、12号、15号和19号等染色体(表2)。qDXS1-r12-1、qDXR-r12-1、qHDR-r12、qLiner-r12和qGermD-r12覆盖相同的遗传区间6.330—6.967 cM,在此位点可能存在重要因子调控这些基因的表达。和均在3号染色体检测到覆盖相同遗传区间的eQTL(qDXS3-r3和qGermD-r3);和这两个基因分别在19号染色体上检测到qLiner-r19和qTerp-r19,覆盖相同的遗传区间。
此外,在不同的发育时期,7个基因的表达性状检测到不同的遗传位点(表2)。在转色期与相连锁的eQTL位于1号、6号和14号染色体,而在成熟期检测到的eQTL主要位于1号、6号和12号染色体。但是位于6号染色体的qDXS1-m6-2与转色期eQTL位点qDXS1-v6覆盖相同遗传区间,说明在6号染色体上存在调控表达的基因,且该基因可能在整个果实成熟期发挥作用;其余6个基因在2个不同发育时期并未检测到相同的遗传调控位点。
不同于传统的数量性状位点定位,表达数量性状位点分析还可以鉴定表达性状变异的调控模式即顺式作用(-)或反式(-)调控。本研究所检测的7个单萜合成途径基因、、、、和分别位于5号、4号、17号、3号、13号和18号染色体上,而()并未锚定到任何一个染色体[1]。综上,并未在这7个单萜合成相关基因所分布染色体相关区域检测到连锁的eQTL,所检测到的eQTL均是-类型。
2.3 关键候选基因的挖掘
利用已公布的葡萄基因组序列信息,将与多个单萜合成基因表达量相关的eQTL位点连锁标记定位到葡萄基因组上,在对应基因组区域内提取基因,根据这些基因的功能注释分析结果,筛选区域内所有的转录因子及与萜类合成相关的基因共90个(图2)。为了进一步确定可能的候选基因,对两个亲本不同发育时期的样品进行全基因组芯片检测。将单萜合成途径基因及候选转录因子基因进行共表达分析(图2),发现在果实发育过程中,和在早期表达量高,后期表达量随着果实成熟而降低,其中候选基因和等表现出相似的表达模式;其余5个单萜合成基因表达模式聚为一类,随着果实成熟则表达量升高,包含等在内的10个候选基因的表达模式与其一致(图2)。
进一步依据各个基因表达量进行Spearman相关分析,并针对每一个单萜合成基因筛选出与之表达相关度最高的20个基因(图3),与高度关联的候选基因有、、、、、、、、、、和等。其中和等8个基因与和等相关系数也较高,而、和等这些候选基因也与单萜合成酶基因(、和)的表达高度相关。但是和高度关联的候选基因与其他单萜合成基因表达的相关度并不高,这与eQTL定位结果相一致,可能其具有不同的调控基因位点。将高相关度的基因进行两两比对分析,最终筛选出与多个单萜基因表达高度相关的潜在候选基因11个(表3),其中4个候选基因(、、和)与激素信号通路调控相关,一个候选基因()编码光敏色素作用因子与光响应相关,还有一些编码Myb类、WRKY类转录因子或者未知功能蛋白。
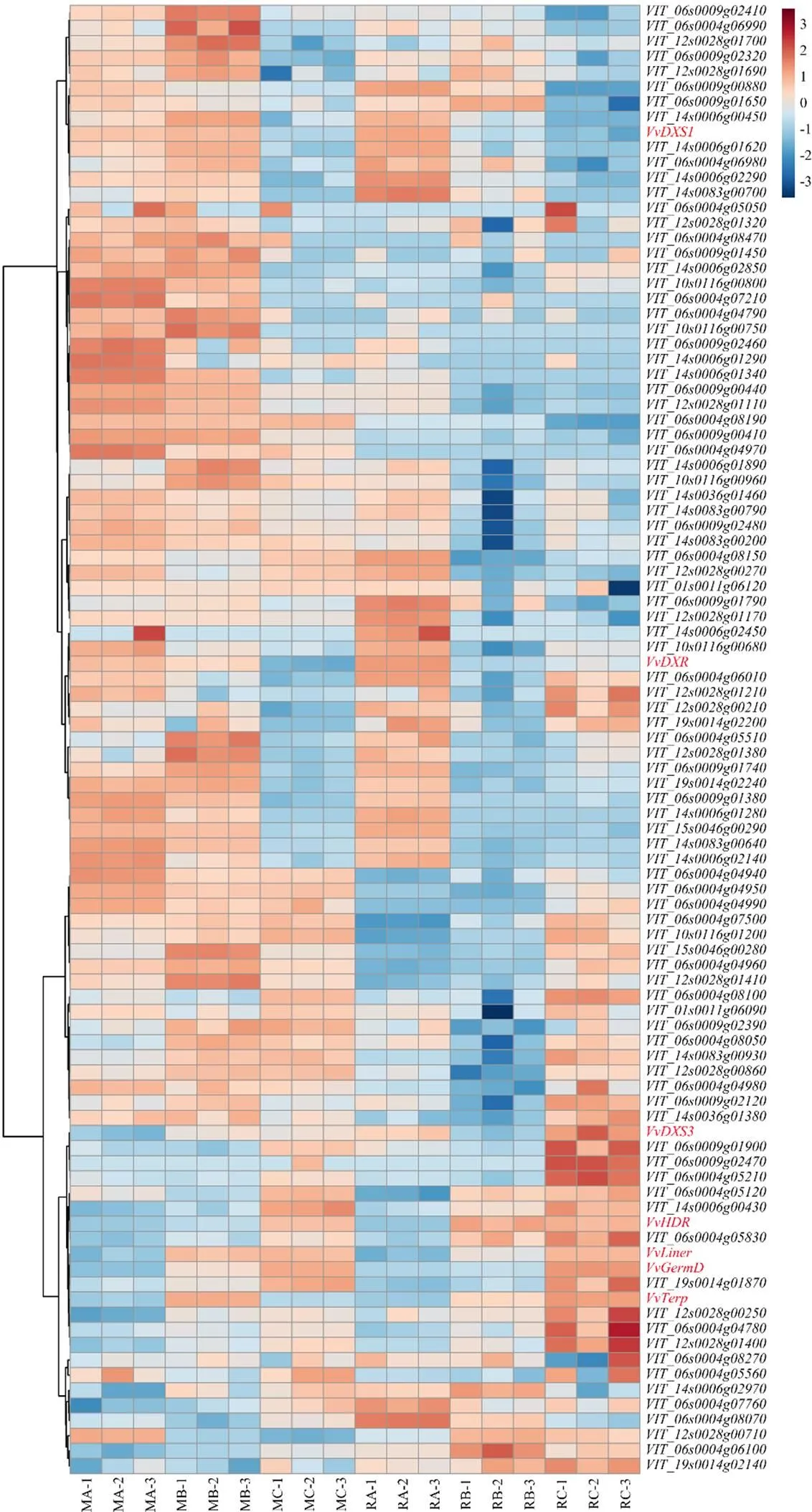
MA:幼果期‘摩尔多瓦’样品;MB:转色期‘摩尔多瓦’样品;MC:成熟期‘摩尔多瓦’样品;RA:幼果期‘瑞都香玉’样品;RB:转色期‘瑞都香玉’样品;RC:成熟期‘瑞都香玉’样品
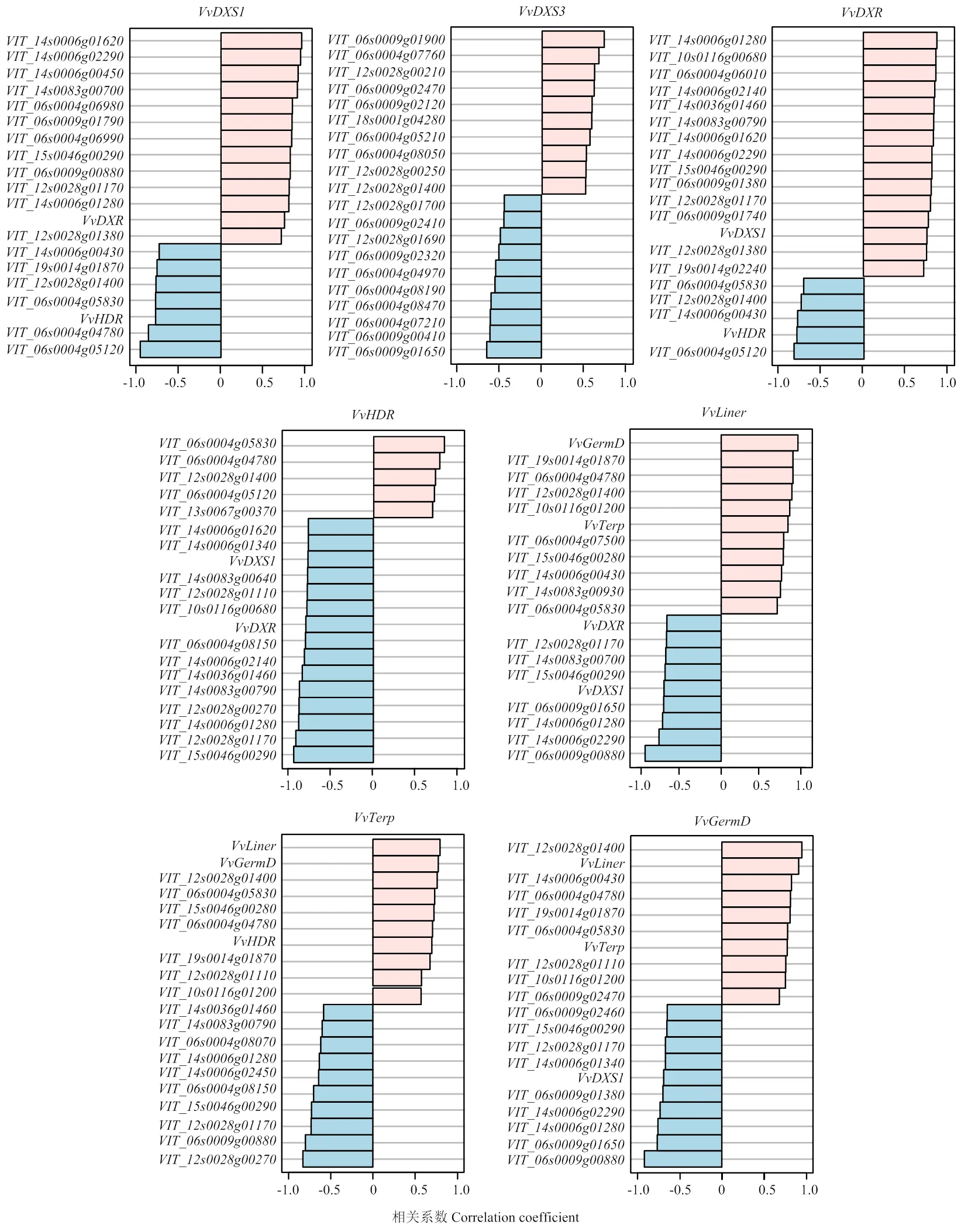
图3 与单萜合成途径基因表达高相关的候选基因
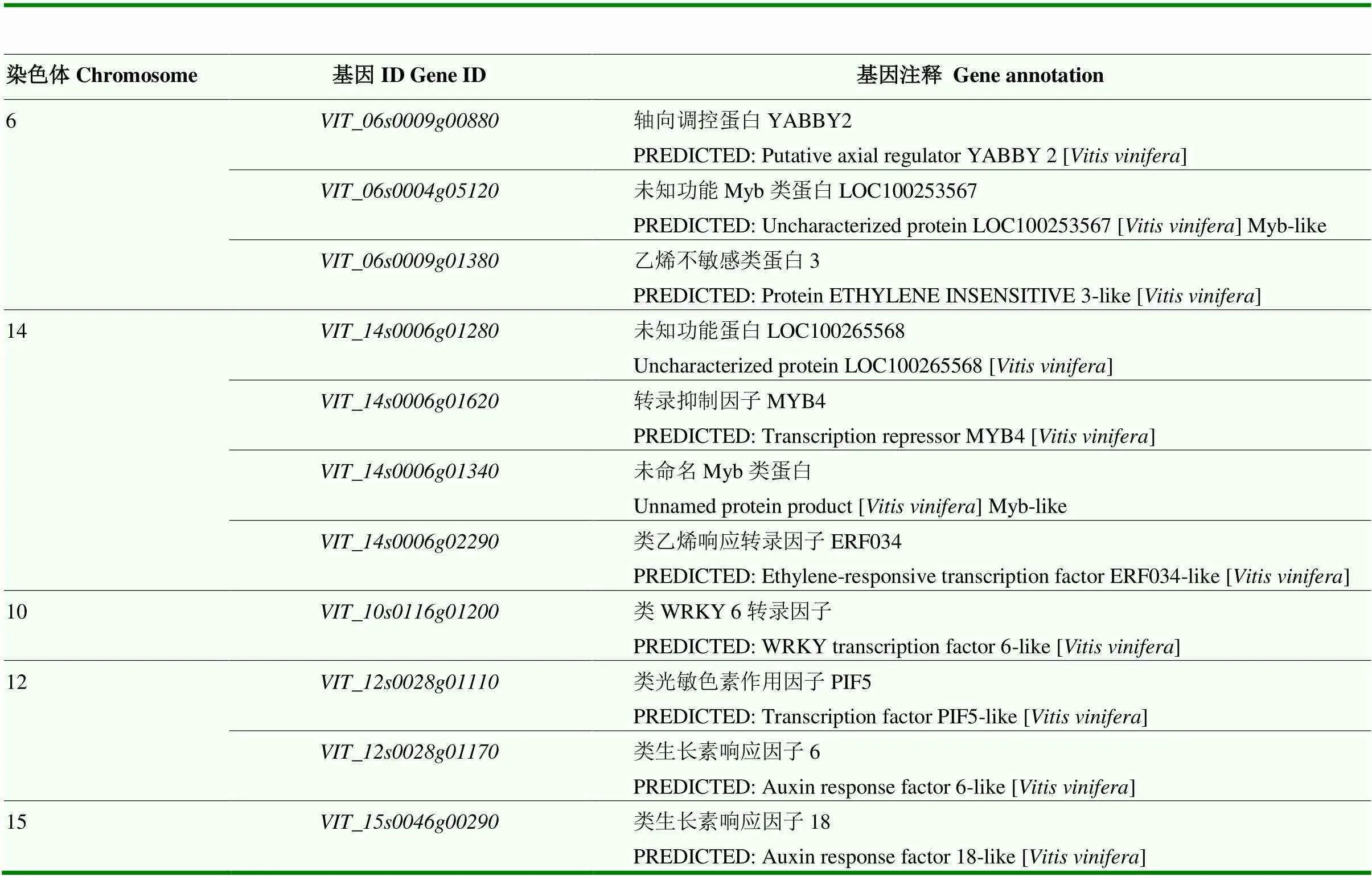
表3 eQTL位点可能的候选基因
3 讨论
3.1 单萜合成途径关键基因表达性状遗传特点
单萜是葡萄果实中重要的异戊二烯衍生物,是玫瑰香型葡萄的典型香气成分。因此其合成调控机制引起科学家广泛关注。研究者先后利用不同亲本杂交后代群体,在5号染色体定位到一个调控5种单萜含量的主效QTL[3-4],进一步确定单萜合成途径入口酶为调控葡萄果实单萜合成的关键基因[5-6]。尽管取得了一些进展,但是以往的研究表明葡萄中单萜的积累涉及复杂的多基因调控[3-4,22]。除了外,还有其他重要的调控基因位点有待进一步挖掘。大量研究表明葡萄果实单萜含量差异与相关基因表达水平有着必然联系[2,19,25]。本研究选择了单萜合成途径中的7个关键基因,检测了它们在亲本与杂交群体中表达水平变化,除了,大部分单萜合成基因在成熟期表达升高,且在高含量单萜亲本‘瑞都香玉’中的表达水平明显高于低含量单萜亲本‘摩尔多瓦’,这与单萜积累相一致。之前的研究发现,由于DXS1是单萜合成途径入口酶,其表达高峰往往早于化合物积累高峰[20,25],这可能是导致并未检测到高表达的原因。各个单萜基因表达水平在杂交后代中呈现较大变异范围,在两个发育时期均出现超亲现象,有遗传的加性效应。来自多个杂交群体化合物测定数据显示,单萜化合物合成在后代中存在超亲遗传,个别化合物在杂交后代中超亲率较高,在遗传效应上呈典型的增强变异[8-10],这与本试验基因表达结果部分一致。此外,本研究还发现在不同果实发育期,7个单萜合成基因表达水平具有显著相关性(表1)。前期研究也曾指出许多植物萜类代谢途径的相关基因有共表达的现象,推测可能受同一个家族转录因子的调控[26]。
3.2 单萜合成途径关键基因QTL位点
本研究共定位到37个eQTL位点,其中位于14号、6号和12号等染色体上的遗传位点与多个单萜基因表达相关,可能存在重要的共调控因子。刘翠霞[8]以单萜化合物含量为表型数据进行QTL分析,也分别在6号、12号和14号染色体鉴定到与多个化合物含量连锁的QTL位点,且位于6号和12号染色体的QTL位点物理位置与本研究结果相近。刘若瑾[10]利用关联分析在12号染色体检测到与单萜化合物含量相关的遗传基因位点。目前关于单萜合成相关基因表达层面遗传定位研究较少。Huang等[15]对葡萄花色苷合成途径花青素糖基转移酶基因进行了eQTL定位分析,鉴定到一个位于本身的-eQTL和一个-eQTL,该-eQTL与转录因子MYBAs共定位。同时对5个参与原花色素合成的基因进行了eQTL分析,定位到4个-eQTL和17个-eQTL[16]。但是本研究所检测到的eQTL均是-类型,说明单萜各个基因表达水平的变化并不是由自身基因结构变化引起,而是存在另外的上游调控因子影响单萜基因的表达,并且存在可以调控多个单萜合成相关基因表达的位点。
3.3 候选基因鉴定
转录因子作为植物次生代谢途径的上游调控元件,往往能够对下游代谢途径中的多个关键酶同时进行调控,通过转录因子激活或抑制萜类合成相关酶基因的表达可以促进萜烯类物质的合成[27]。因此,本研究着重对共定位区域内转录因子进行分析,共注释到90个候选转录因子基因,并鉴定到、、、、、和等这些候选基因与多个单萜合成基因的表达高度相关;基因功能注释显示和为乙烯信号通路重要基因(表3)。Sarker等[28]研究发现乙烯响应因子ERF-1和ERF-2会影响薰衣草中单萜物质芳樟醇及其衍生物合成;甜橙AP2/ERF家族转录因子ERF71能够通过与萜烯合成酶基因的启动子结合从而促进挥发性单萜香叶醇的合成[29]。这些研究表明乙烯信号通路在单萜合成调控中发挥着重要作用。ERF家族转录因子是乙烯代谢路径中的响应因子,可以影响呼吸跃变型果实的成熟进度[30]。葡萄属于非呼吸跃变植物,对乙烯并不敏感,但是其在葡萄果实发育和成熟过程中也起着关键的作用[31]。目前,已经在葡萄中鉴定出149个AP2/ERF家族成员,其中50个AP2/ERF转录因子基因在葡萄果实从转色到成熟过程中的表达发生显著变化[32],而这个时期也是果实单萜积累的关键阶段[19-20],二者可能存在较大的关联性。Cramer等[31]和Wen等[19]通过转录组测序研究发现在16号染色体上的一组ERF6类转录因子可能参与调控葡萄萜烯积累。但是本研究并未在16号染色体检测到主效eQTL位点,可能因为检测方法和供试材料遗传背景不同所致。此外,和编码Myb类转录因子蛋白,编码WRKY 6类转录因子蛋白。Myb类转录因子被报道是与植物萜烯类化合物代谢相关的6个主要TFs家族成员之一[33]。Costantini等[25]通过转录组测序方法,也在14号染色体筛选到可能与单萜合成调控有关的编码MYB24转录因子的候选基因。Li等[34]报道一个WRKY家族转录因子WRKY40通过GT14参与调控葡萄果实糖苷结合态单萜合成。还有一些已被报道的可能参与调控葡萄果实中单萜合成的转录因子如GATA 5Tike、GT-2、NAC等[19,25],但是本研究中并未检测到。
在高等植物中,影响类异戊二烯生物合成的重要信号之一是光,它在转录和转录后水平激活MEP途径[35]。前期研究表明光照可以在整个发育过程影响葡萄果实萜烯合成和积累,避光处理后单萜含量会降低[36]。已有报道发现HY5(长轴蛋白5,)在葡萄光诱导萜类生物合成调控中发挥重要作用[37]。本研究发现候选基因编码光敏色素作用因子蛋白PIF5,而研究表明PIF转录因子往往与HY以分子模块形式发挥作用[38-39]。后续研究将进一步通过转基因和基因敲除等技术对这些候选基因进行基因功能验证。
4 结论
基于构建好的葡萄高密度遗传图谱,在2个不同生长发育期,对‘摩尔多瓦’ב瑞都香玉’F1代群体共检测到37个与单萜合成途径基因表达相关的eQTL,主要定位于6号、12号和14号染色体。基于基因注释和表达谱分析,筛选到了包含和在内的11个可能的候选基因,这些候选基因与多个单萜基因表达高度相关。
[1] MATEO J J, JIMÉNEZ M.Monoterpenes in grape juice and wines.Journal of Chromatography A, 2000, 881(1/2): 557-567.doi: 10.1016/s0021-9673(99)01342-4.
[2] MARTIN D M, CHIANG A, LUND S T, BOHLMANN J.Biosynthesis of wine aroma: transcript profiles of hydroxymethylbutenyl diphosphate reductase, geranyl diphosphate synthase, and linalool/ nerolidol synthase parallel monoterpenol glycoside accumulation in Gewürztraminer grapes.Planta, 2012, 236(3): 919-929.doi: 10.1007/ s00425-012-1704-0.
[3] DOLIGEZ A, AUDIOT E, BAUMES R, THIS P.QTLs for Muscat flavor and monoterpenic odorant content in grapevine (L.).Molecular Breeding, 2006, 18(2): 109-125.doi: 10.1007/ s11032-006-9016-3.
[4] DUCHÊNE E, BUTTERLIN G, CLAUDEL P, DUMAS V, JAEGLI N, MERDINOGLU D.A grapevine (L.) deoxy-D- xylulose synthase gene colocates with a major quantitative trait loci for terpenol content.Theoretical and Applied Genetics, 2009, 118(3): 541-552.
[5] BATTILANA J, COSTANTINI L, EMANUELLI F, SEVINI F, SEGALA C, MOSER S, VELASCO R, VERSINI G, GRANDO M S.The 1-deoxy-d-xylulose 5-phosphate synthase gene co-localizes with a major QTL affecting monoterpene content in grapevine.Theoretical and Applied Genetics, 2009, 118(4): 653-669.doi: 10.1007/s00122- 008-0927-8.
[6] EMANUELLI F, BATTILANA J, COSTANTINI L, CUNFF L L, GRANDO M S.A candidate gene association study for muscat flavor in grapevineL.BMC Plant Biology, 2010, 10(1): 241.
[7] BATTILANA J, EMANUELLI F, GAMBINO G, GRIBAUDO I, GASPERI F, BOSS P K, GRANDO M S.Functional effect of grapevine 1-deoxy-D-xylulose 5-phosphate synthase substitution K284N on Muscat flavour formation.Journal of Experimental Botany, 2011, 62 (15): 5497-5508.
[8] 刘翠霞.葡萄果实单萜化合物含量的QTL定位及其合成调控的候选基因筛选[D].武汉: 中国科学院武汉植物园, 2017.
LIU C X.QTL mapping of monoterpene content in grape berry and screening of candidate genes related to regulation [D].Wuhan: Wuhan Botanical Garden, Chinese Academy of Sciences, 2017.(in Chinese)
[9] LIN H, GUO Y S, YANG X X, KONDO S, ZHAO Y H, LIU Z D, LI K, GUO X W.QTL identification and candidate gene identification for monoterpene content in grape (L.) berries.Vitis-Geilweilerhof, 2020, 59(1): 19-28.
[10] 刘若瑾.葡萄单萜遗传规律及全基因组单标记关联分析[D].北京: 北京林业大学, 2020.
LIU R J.Genetic rules and genome-wide single marker analysis of monoterpenoids in grapes [D].Beijing: Beijing Forestry University, 2020.(in Chinese)
[11] JANSEN R C, NAP J P.Genetical genomics: The added value from segregation.Trends in Genetics, 2001, 17(7): 388-391.doi: 10.1016/ s0168-9525(01)02310-1.
[12] KABELITZ T, KAPPEL C, HENNEBERGER K, BENKE E, NOH C, BAURLE I.eQTL Mapping of transposon silencing reveals a position-dependent stable escape from epigenetic silencing and transposition ofLineage.The Plant Cell, 2014, 26(8): 3261-3271.
[13] FU J J, CHENG Y B, LINGHU J J, YANG X H, KANG L, ZHANG Z X, ZHANG J, HE C, DU X M, PENG Z Y, WANG B, ZHAI L H, DAI C M, XU J B, WANG W D, LI X R, ZHENG J, CHEN L, LUO L H, LIU J J, QIAN X J, YAN J B, WANG J, WANG G Y.RNA sequencing reveals the complex regulatory network in the maize kernel.Nature Communications, 2013, 4: 2832.doi:10.1038/ ncomms3832.
[14] JORDAN M C, SOMERS D J, BANKS T W.Identifying regions of the wheat genome controlling seed development by mapping expression quantitative trait loci.Plant Biotechnology Journal, 2007, 5(3): 442-453.doi:10.1111/j.1467-7652.2007.00253.x.
[15] HUANG Y F, BERTRAND Y, GUIRAUD J L, VIALET S, LAUNAY A, CHEYNIER V, TERRIER N, THIS P.Expression QTL mapping in grapevine: Revisiting the genetic determinism of grape skin colour.Plant Science, 2013, 207: 18-24.doi:10.1016/j.plantsci.2013.02.011.
[16] HUANG Y F, VIALET S, GUIRAUD J L, TORREGROSA L, BERTRAND Y, CHEYNIER V, THIS P, TERRIER N.A negative
MYB regulator of proanthocyanidin accumulation, identified through expression quantitative locus mapping in the grape berry.The New Phytologist, 2014, 201(3): 795-809.doi:10.1111/nph.12557.
[17] XU H Y, SUN L, ZHANG G J, YAN A L.‘Ruidu Xiangyu’: A new table grape with Muscat flavor.Vitis Geilweilerhof, 2012, 51(3): 143-144.
[18] 牛早柱, 陈展, 赵艳卓, 牛帅科, 魏建国, 杨丽丽.15个不同葡萄品种果实香气成分的GC-MS分析.华北农学报, 2019, 34(Z1): 85-91.
NIU Z Z, CHEN Z, ZHAO Y Z, NIU S K, WEI J G, YANG L L.Analysis of aromatic components from the berries of fifteen grape varieties by GC-MS.Acta Agriculturae Boreali-Sinica, 2019, 34(Z1): 85-91.(in Chinese)
[19] WEN Y Q, ZHONG G Y, GAO Y, LAN Y B, DUAN C Q, PAN Q H.Using the combined analysis of transcripts and metabolites to propose key genes for differential terpene accumulation across two regions.BMC Plant Biology, 2015, 15: 240.doi:10.1186/s12870- 015-0631-1.
[20] 王慧玲, 王晓玥, 闫爱玲, 孙磊, 张国军, 任建成, 徐海英.不同架式‘爱神玫瑰’葡萄果实成熟期间单萜积累及相关基因的表达.中国农业科学, 2019, 52(7): 1136-1149.doi:10.3864/j.issn.0578-1752.2019.07.002.
WANG H L, WANG X Y, YAN A L, SUN L, ZHANG G J, REN J C, XU H Y.The accumulation of monoterpenes and the expression of its biosynthesis related genes in ‘Aishen Meigui’ grape berries cultivated in different trellis systems during ripening stage.Scientia Agricultura Sinica, 2019, 52(7): 1136-1149.doi:10.3864/j.issn.0578-1752.2019.07.002.(in Chinese)
[21] 孙磊, 朱保庆, 孙晓荣, 许晓青, 王晓玥, 张国军, 徐海英.‘亚历山大’葡萄果实单萜生物合成相关基因转录及萜类物质积累规律.中国农业科学.2014, 47(7):1379-1386.
SUN L, ZHU B Q, SUN X R, XU X Q, WANG X Y, ZHANG G J, XU H Y.Terpenes biosynthesis related gene transcript profiles and terpenes accumulation of ‘Aishen Meigui’ grape.Scientia Agricultura Sinica, 2014, 47(7): 1379-1386.(in Chinese)
[22] WANG H L, YAN A L, SUN L, ZHANG G J, WANG X Y, REN J C, XU H Y.Novel stable QTLs identification for berry quality traits based on high-density genetic linkage map construction in table grape.BMC Plant Biology, 2020, 20: 411.
[23] VAN OOIJEN J W.MapQTL 6.0, Software for the mapping of quantitative trait loci in experimental populations of diploid species.Wageningen, Netherlands: Kyazma B.V, 2009.
[24] XIA J, PSYCHOGIOS N, YOUNG N, WISHART D S.MetaboAnalyst: A web server for metabolomic data analysis and interpretation.Nucleic Acids Research, 2009, 37(web server issue): W652-W660.doi: 10.1093/nar/gkp356.
[25] COSTANTINI L, KAPPEL C D, TRENTI M, BATTILANA J, EMANUELLI F, SORDO M, MORETTO M, CAMPS C, LARCHER R, DELROT S, GRANDO M S.Drawing links from transcriptome to metabolites: The evolution of aroma in the ripening berry of moscato bianco (L.).Frontiers in Plant Science, 2017, 8: 780.doi: 10.3389/fpls.2017.00780.
[26] MAHMOUD S S, CROTEAU R B.Strategies for transgenic manipulation of monoterpene biosynthesis in plants.Trends in Plant Science, 2002, 7(8): 366-373.doi: 10.1016/s1360-1385(02) 02303-8.
[27] 董燕梅, 张文颖, 凌正一, 李靖锐, 白红彤, 李慧, 石雷.转录因子调控植物萜类化合物生物合成研究进展.植物学报, 2020, 55(3): 340-350.doi: 10.11983/CBB19186.
DONG Y M, ZHANG W Y, LING Z Y, LI J R, BAI H T, LI H, SHI L.Advances in transcription factors regulating plant terpenoids biosynthesis.Chinese Bulletin of Botany, 2020, 55(3): 340-350.doi: 10.11983/CBB19186.(in Chinese)
[28] SARKER L S, ADAL A M, MAHMOUD S S.Diverse transcription factors control monoterpene synthase expression in lavender ().Planta, 2019, 251(1): 1-5.doi: 10.1007/s00425-019- 03298-w.
[29] LI X, XU Y Y, SHEN S L, YIN X R, KLEE H, ZHANG B, CHEN K S.Transcription factor CitERF71 activates the terpene synthase gene CitTPS16 involved in the synthesis of E-geraniol in sweet orange fruit.Journal of Experimental Botany, 2017, 68(17): 4929-4938.doi: 10.1093/jxb/erx316.
[30] LI T, JIANG Z, ZHANG L, TAN D, WEI Y, YUAN H, LI T, WANG A.Apple () MdERF2negatively affects ethylene biosynthesis during fruit ripening by suppressing MdACS1transcription.The Plant Journal, 2016, 88(5): 735-748.doi: 10.1111/ tpj.13289.
[31] CRAMER G R, GHAN R, SCHLAUCH K A, TILLETT R L, HEYMANN H, FERRARINI A, DELLEDONNE M, ZENONI S, FASOLI M, PEZZOTTI M.Transcriptomic analysis of the late stages of grapevine (cv.Cabernet Sauvignon) berry ripening reveals significant induction of ethylene signaling and flavor pathways in the skin.BMC Plant Biology, 2014, 14: 370.
[32] LICAUSI F, GIORGI F M, ZENONI S, OSTI F, PEZZOTTI M, PERATA P.Genomic and transcriptomic analysis of the AP2/ERF superfamily in.BMC Genomics, 2010, 11: 719.
[33] XU Y Y, ZHU C Q, XU C J, SUN J, CHEN K S.Integration of metabolite profiling and transcriptome analysis reveals genes related to volatile terpenoid metabolism in finger citron (var.sarcodactylis).Molecules, 2019, 24(14): 2564.
[34] LI X Y, HE L, AN X H.WRKY40, a WRKY transcription factor, regulates glycosylated monoterpenoid production byGT14 in grape berry.Genes, 2020, 11(5): 485.
[35] MANNEN K, MATSUMOTO T, TAKAHASHI S, YAMAGUCHI Y, TSUKAGOSHI M, SANO R, SUZUKI H, SAKURAI N, SHIBATA D, KOYAMA T, NAKAYAMA T.Coordinated transcriptional regulation of isopentenyl diphosphate biosynthetic pathway enzymes in plastids by phytochrome-interacting factor 5.Biochemical and Biophysical Research Communications, 2014, 443(2): 768-774.doi: 10.1016/j.bbrc.2013.12.040.
[36] ZHANG H H, FAN P G, LIU C X, WU B H, LI S H, LIANG Z C.Sunlight exclusion from Muscat grape alters volatile profiles during berry development.Food Chemistry, 2014, 164: 242-250.doi: 10.1016/j.foodchem.2014.05.012.
[37] SASAKI K, TAKASE H, MATSUYAMA S, KOBAYASHI H, MATSUO H, IKOMA G, TAKATA R.Effect of light exposure on linalool biosynthesis and accumulation in grape berries.Bioscience, Biotechnology, and Biochemistry, 2016, 80(12): 2376-2382.doi:10.1080/09168451.2016.1217148.
[38] ZHOU F, SUN T H, ZHAO L, PAN X W, LU S.The bZIP transcription factor HY5 interacts with the promoter of the monoterpene synthase gene QH6 in modulating its rhythmic expression.Frontier in Plant Science, 2015, 6: 304
[39] TOLEDO-ORTIZ G, JOHANSSON H, LEE K P, BOU-TORRENT J, STEWART K, STEEL G, RODRÍGUEZ-CONCEPCIÓN M, HALLIDAY K J.The HY5-PIF regulatory module coordinates light and temperature control of photosynthetic gene transcription.PLoS Genetics, 2014, 10(6): e1004416.
eQTL Analysis of Key Monoterpene Biosynthesis Genes in Table Grape
WANG HuiLing1, YAN AiLing2, SUN Lei3, ZHANG GuoJun1, WANG XiaoYue1,REN JianCheng1, XU HaiYing1*
1Institute of Forestry and Pomology, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100093;2Beijing Engineering Research Center for Deciduous Fruit Trees, Beijing 100097;3Key Laboratory of Biology and Genetic Improvement of Horticultural Crops (North China), Ministry of Agriculture and Rural Affairs, Beijing 100097
【Objective】The eQTL mapping for monoterpene biosynthesis related gene expression traits were performed and the candidate genes were mined to deeply understand the regulation mechanism of monoterpene synthesis, so as to lay a foundation for the cultivation of new Muscat grape varieties and germplasm improvement.【Method】The F1population generated by crossing Moldova and Ruiduxiangyu were used as materials in this study, and the grape berry samples were collected at verasion and ripening stage respectively.The phenotypic data of expression traits were obtained by detecting the expression levels of seven monoterpene synthesis pathway genes (,,,,,, and) by using real-time quantitative qPCR technique.eQTL mapping of monoterpene gene expression traits were performed with the mapQTL6.0 software based on the interval mapping method.The associated markers of eQTL were mapped to the genomic region, and the genes within eQTLs were annotated and analyzed via the databases of Ensembl Plants and NCBI.The expression profiles of candidate genes in the samples of parents at different developmental stages were detected by grape whole genome microarray.【Result】The expression levels of seven monoterpene biosynthesis related genes in F1population showed a continuous quantitative genetic distribution.A significant correlation between the expression of monoterpene genes was observed.At verasion, 13 eQTLs for the seven expression traits were mapped on chromosome 1, 6, 14, 16, 17, 10 and 12, respectively, and the phenotypic explanation value ranged from 12.2% to 23.5%.Among them, eQTLs (qDXS1-v14, qHDR-v14-1 and qTerp-v14) on chromosome 14 covered the same genetic interval of 57.582-76.979 cM, and qLiner-v10, qTerp-v10 and qGermD-v10 were co-located on chromosome 10.At the mature stage, 16 eQTLs were detected, mainly located on chromosome 1, 6, 12, 8, 13 and 19.qDXS1-m6-2, qDXR-m6-2, qLiner-m6 and qGermD-m6 were co-located in the genetic interval 139.212-143.161 cM of chromosome 6.In addition, a total of 18 eQTLs on chromosomes 1, 3, 7, 10, 12, 15 and 19 were detected for the change ratio of each gene expression between maturity and verasion, respectively.qDXS1-r12-1, qDXR-r12-1, qHDR-r12, qLiner-r12 and qGermD-r12 covered the same genetic interval of 6.330-6.967cM on chromosome 12.The eQTL region for multiple expression traits co-located were further annotated, 90 transcription factor genes were screened, and 11 candidate genes were finally identified by expression profile and correlation analysis.Among them, four candidate genes of,,andwere predicted to participate in the regulation of hormone signaling pathway, one candidate geneencodes a phytochrome interacting factor related to light response, and some other genes encode Myb, WRKY transcription factors or unknown functional proteins.【Conclusion】A total of 37 eQTLs linked to monoterpene synthesis gene expression traits were detected at two different development stages, which mainly located on chromosome 6, 12 and 14.Based on the results of gene annotation and expression profile analysis, 11 candidate genes includingandwere identified, and these candidate genes were highly correlated with the expression of multiple monoterpene genes.
grape; monoterpenes; key genes; eQTL
2021-05-17;
2021-07-27
北京市自然科学基金(6182007)、国家自然科学基金青年基金(31601712)、北京市农林科学院创新能力建设专项(kjcx20200406)、财政部和农业农村部:国家现代农业产业技术体系(CARS-29)
王慧玲,E-mail:wanghui198216@126.com。通信作者徐海英,Tel:010-82592156;E-mail:haiyingxu63@sina.com
(责任编辑 赵伶俐)

