钙敏感受体和胆囊收缩素-1受体介导大豆蛋白水解物对小鼠食欲的影响
王绿阳,崔雷鸿,冯江银,洪秋霞,游美敬,保浩宇,杭苏琴
钙敏感受体和胆囊收缩素-1受体介导大豆蛋白水解物对小鼠食欲的影响
王绿阳,崔雷鸿,冯江银,洪秋霞,游美敬,保浩宇,杭苏琴
南京农业大学国家动物消化道营养国际联合研究中心/江苏省消化道营养与动物健康重点实验室/消化道微生物研究室,南京 210095
【】探究大豆蛋白水解物(soy protein hydrolysate,SPH)对小鼠食欲的影响及其机制,以期从营养角度为猪采食调控技术的研究提供新思路。利用胃蛋白酶水解大豆蛋白产生SPH。首先探究灌胃不同浓度SPH对小鼠短期采食量及十二指肠肽钙敏感受体(Calcium sensing receptor,CaSR)、G蛋白偶联受体93(G protein-coupled receptor 93,GPR93)和肽转运受体(Oligopeptide transporter 1,PepT1)基因表达的影响;在此基础上,通过腹腔分别注射CaSR抑制剂NPS2143和外周CCK-1受体(Cholecystokinin-1 receptor,CCK-1R)抑制剂Devazepide,探究SPH是否通过CaSR-CCK- CCK-1R-下丘脑途径抑制机体采食。灌胃1.5g·kg-1SPH显著降低小鼠0—1 h采食量(<0.05)、显著提高十二指肠的表达(<0.05);与SPH组相比,SPH+NPS2143组小鼠0—1 h采食量升高,血液CCK水平降低,且均与对照组无差异(0.05<<0.5)。同时,SPH显著降低小鼠0-1 h胃排空速率,显著提高下丘脑厌食神经因子POMC的基因表达(<0.05),而SPH+Devazepide组这种作用消失。但灌胃SPH对小肠传输速率和下丘脑促食相关因子NPY(Neuropeptide Y)和AgRP(Agoutirelated peptide)的基因表达均无影响。十二指肠CaSR介导SPH促进CCK分泌,并通过外周CCK-1R延缓胃排空速率、提高下丘脑厌食神经因子POMC(Pro-opiomelanocortin)的基因表达来抑制食欲。
大豆蛋白水解物;采食;钙敏感受体;胆囊收缩素;CCK-1受体;下丘脑
0 引言
【研究意义】与其他营养素相比,日粮蛋白质更易引起机体的饱腹感[1];且高蛋白饮食能够抑制机体采食并降低体重,这可能与胃肠道对蛋白质降解产物的感应有关[2]。【前人研究进展】研究表明,十二指肠及空肠前端分布的内分泌I细胞分泌的CCK(cholecystokinin)是重要的内源性饱感激素,它能够抑制胃排空、抑制胆囊收缩等,并作为脑肠肽通过外周CCK-1受体(CCK-1 receptor,CCK-1R)将信号传至下丘脑而抑制机体采食[3]。体内外研究表明蛋白水解物能够有效地刺激缩胆囊素分泌。CUBER等对猪十二指肠在体灌注酪蛋白水解物,发现猪血液CCK水平迅速升高[4];此外酪蛋白水解物可刺激内分泌细胞系STC-1细胞分泌CCK[5]。据报道,胃肠道内分泌细胞(enteroendocrine cells,EECs)表达众多G蛋白偶联型受体(G protein-coupled receptors,GPCRs),负责感应和识别日粮营养素而介导胃肠激素的分泌,调节机体采食[6]。其中感应受体钙敏感受体(Galcium sensing receptor,CaSR)和G蛋白偶联型受体93(G protein-coupled receptor 93,GPR93)可介导蛋白水解物刺激STC-1细胞分泌CCK[7]。此外,位于肠上皮细胞的寡肽转运体PepT1(oligopeptide transporter 1,PepT1)也可间接介导蛋白水解物刺激STC-1细胞分泌CCK[8]。但这些研究大多集中于细胞试验,而体内的研究很少。【本研究切入点】大豆蛋白是饲料蛋白质的主要来源之一。机体进食大豆蛋白后,首先经胃蛋白酶初步消化再进入小肠被感应、消化和吸收,而大豆蛋白对采食的影响及调控机制目前还不清楚。【拟解决的关键问题】本研究选用经胃蛋白酶水解的大豆蛋白-即大豆蛋白水解物(soy protein hydrolysate,SPH),作为大豆蛋白在体内的生理形式,以小鼠为模型探究SPH对小鼠食欲的影响及其机制。
1 材料与方法
试验于2018年10—12月于南京农业大学动物试验基地进行。每次试验结束小鼠恢复一周。
1.1 试验动物
选取若干只8周龄体重相近(39.79 ± 0.23 g)的雄性ICR小鼠,单笼饲养,鼠房温度(25 ± 2)℃,保持12 h光照循环;自由采食饮水,提供啮齿动物标准颗粒料。饲养标准符合我国《实验动物管理条例》。小鼠及颗粒料均购自南京市青龙山动物繁殖中心。
1.2 SPH的制备
根据KIM[9]的描述,将大豆分离蛋白(soybean protein isolate,SPI)(货号:S9510,索莱宝)溶于去离子水(10 %,w/v),用2 mol·L-1的HCl调节pH= 2.0。加入猪胃蛋白酶(货号:P8160,索莱宝)(1%,w/v),于37℃恒温持续搅拌1 h,最后用2 mol·L-1NaOH溶液调节pH = 7.0终止酶解反应。将水解物置于-20℃冷冻24 h,用真空冷冻干燥机(型号:Alpha 1-2LDplus,德国CHRIST)冻干得到SPH固体粉末。SPH固体粉末可完全溶于生理盐水。
1.3 抑制剂
抑制剂NPS2143(HY-10007)和Devazepide(HY-106301)均购自MedChem Express(中国,上海)。
1.4 试验设计及样品采集
1.4.1 试验一:灌胃不同浓度SPH对小鼠采食的影响 试验时间线如图1-A所示。选取体重相近的小鼠随机分为4组(n = 8),分为对照组(生理盐水)、SPH 0.5 g·kg-1组、SPH 1.0 g·kg-1组和SPH 1.5 g·kg-1组[10]。研究上午10:00禁食,下午18:00分别灌胃2 mL生理盐水和0.5/1.0/1.5 g·kg-1SPH。分别于18:30、19:00、20:00和22:00测定0.5/1.0/2/4 h采食量。根据采食量结果确定显著降低小鼠采食的SPH浓度,用于后续灌胃试验。
1.4.2 试验二:SPH对小鼠十二指肠氨基酸感应/转运受体表达的影响 禁食和灌胃的时间点与试验一相同。根据试验一的结果,选取体重相近的小鼠随机分为2组(n = 8),分别灌胃2 mL生理盐水和1.5 g·kg-1SPH。1 h后颈椎脱臼处死,采集十二指肠黏膜检测感应受体的基因表达。
1.4.3 试验三:CaSR抑制剂对小鼠采食的影响 试验时间线如图1-B所示。选取体重相近的小鼠随机分为4组(n = 8),分为对照组(生理盐水)、NPS 2143组(20 mg·kg-1)、SPH(1.5g·kg-1)组和SPH(1.5g·kg-1)+ NPS 2143组(20 mg·kg-1)。NPS 2143溶于生理盐水,并加入5 %二甲基亚砜(dimethyl sulfoxide,DMSO)助溶[11]。上午10:00禁食,下午17:30对其中两组灌胃100 μL生理盐水,另外两组灌胃100 μLNPS 2143溶液。18:00对灌胃NPS 2143两组中的一组灌胃2 mL生理盐水,另一组灌胃2 mL 1.5 g·kg-1SPH;灌胃生理盐水的两组也如此。灌胃后于18:00—19:00通过颌下静脉每15 min进行采血,血液收集至含有20 μL1% EDTA(v/v)的无菌1.5 mL离心管中,4 °C、3 500×离心10 min,取上清用于后续CCK浓度的测定;并于18:30、19:00、20:00和22:00测定0.5/1.0/2/4 h采食量。
1.4.4 试验四:CCK-1受体抑制剂对小鼠采食的影响 试验时间线如图1-B所示,选取体重相近的小鼠随机分为4组(n = 8),分为对照组(生理盐水)、Devazepide组(600 μg·kg-1)、SPH(1.5g·kg-1)组和SPH(1.5g·kg-1)+ Devazepide组(600 μg·kg-1)。Devazepid溶于生理盐水,并加入3 % DMSO助溶[12]。上午10:00禁食,下午17:30对其中两组灌胃100 μL生理盐水,另外两组腹腔注射100 μL Devazepid溶液。其他试验操作同试验三。
1.4.5 试验五:CCK-1受体抑制剂对小鼠胃排空、小肠传输和下丘脑食欲相关因子表达的影响 禁食和灌胃的时间点与试验三相同。试验时间线如图1-C所示,选取体重相近的小鼠随机分为3组(n=8),分为对照组(生理盐水)、SPH(1.5g·kg-1)组和SPH(1.5g·kg-1)+ Devazepide组(600 μg·kg-1)。上午10:00禁食,下午17:30对前两组腹腔注射100 μL生理盐水,最后一组腹腔注射100 μL Devazepide溶液。18:00对第一组小鼠灌胃2 mL生理盐+ 0.05 %酚红(w/v),后两组小鼠均灌胃2 mL SPH + 0.05 %酚红。30 min后进行颈椎脱臼处死,5 min内完整地取出胃肠组织置于4 ℃冰垫上。根据SHIN等的描述[13],将胃剪碎放入5 mL 0.01 mol·L-1NaOH溶液中震荡摇匀,并加入1 mL20 %三氯乙酸,1 050×离心10 min,取0.05 mL上清加入0.2 mL 0.5 mol·L-1NaOH,于560 nm测定吸光值,胃排空速率(%)=(1-胃残留量/初始量)×100;取小肠并沿中线剪开,从十二指肠滴加0.01mol·L-1NaOH溶液,测量显色部位到十二指肠前端的距离,小肠传输速率(%)=(1-显色部位长度/小肠全长)×100;5 min内将脑从小鼠头骨中取出置于4 ℃冰垫上,根据小鼠脑的解剖结构识别下丘脑区域[14],利用无菌刀片分出下丘脑区域迅速冻存于液氮,用于食欲相关因子表达的测定。
1.5 指标测定及方法
1.5.1 血清CCK浓度测定 严格按照小鼠CCK ELISA试剂盒(南京奥青)说明书检测血清中CCK的浓度。CCK试剂盒检测浓度范围为10—200 ng·L-1,批次间变异系数 < 15%,批次内变异系数 < 9%。
1.5.2 十二指肠氨基酸感应/转运受体和下丘脑食欲相关基因的表达分析 按照Trizol法(TaKaRa,中国大连)提取总RNA,利用反转录试剂盒Prime ScriptTMRT Master Mix(RR036A,TaKaRa,中国)将1 μg RNA反转录为cDNA。用StepOne-Plus定量PCR仪(Thermo Scientific,USA)及StepOne软件(version 2.2.2,Applied Biosystems)进行荧光定量。PCR反应体系(20 μL):SYBR Premix 10 μL,上、下引物分别为0.4 μL,ROX Reference Dye(50×)0.4 μL,无RNA酶水6.8 μL,cDNA2 μL。PCR条件为 95 ℃ 30 s,95℃ 5 s,60 ℃ 30 s 40个循环,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样品3个重复。测定十二指肠、和肽转运体;下丘脑厌食神经因子()和促食神经因子(和)。引物序列详见表1。
1.6 数据统计分析
数据用Excel 2010进行初步分析后,采用SPSS 23.0单因素方差分析模型(one-way ANOVA)中的Tukey test进行多重比较,< 0.05代表差异显著。结果均以平均数± 标准误表示。
2 结果
2.1 SPH对食欲及十二指肠肽感应/转运受体基因表达的影响
如图2所示。灌胃1.5 g·kg-1SPH显著降低小鼠0—1 h采食量(< 0.05),但对0—2和0—4 h的采食量没有影响,因此选取1.5 g·kg-1的浓度进行后续灌胃试验。此外,1.5 g·kg-1SPH显著提高小鼠十二指肠的表达(< 0.05),但对感应受体和肽转运体的表达无影响。
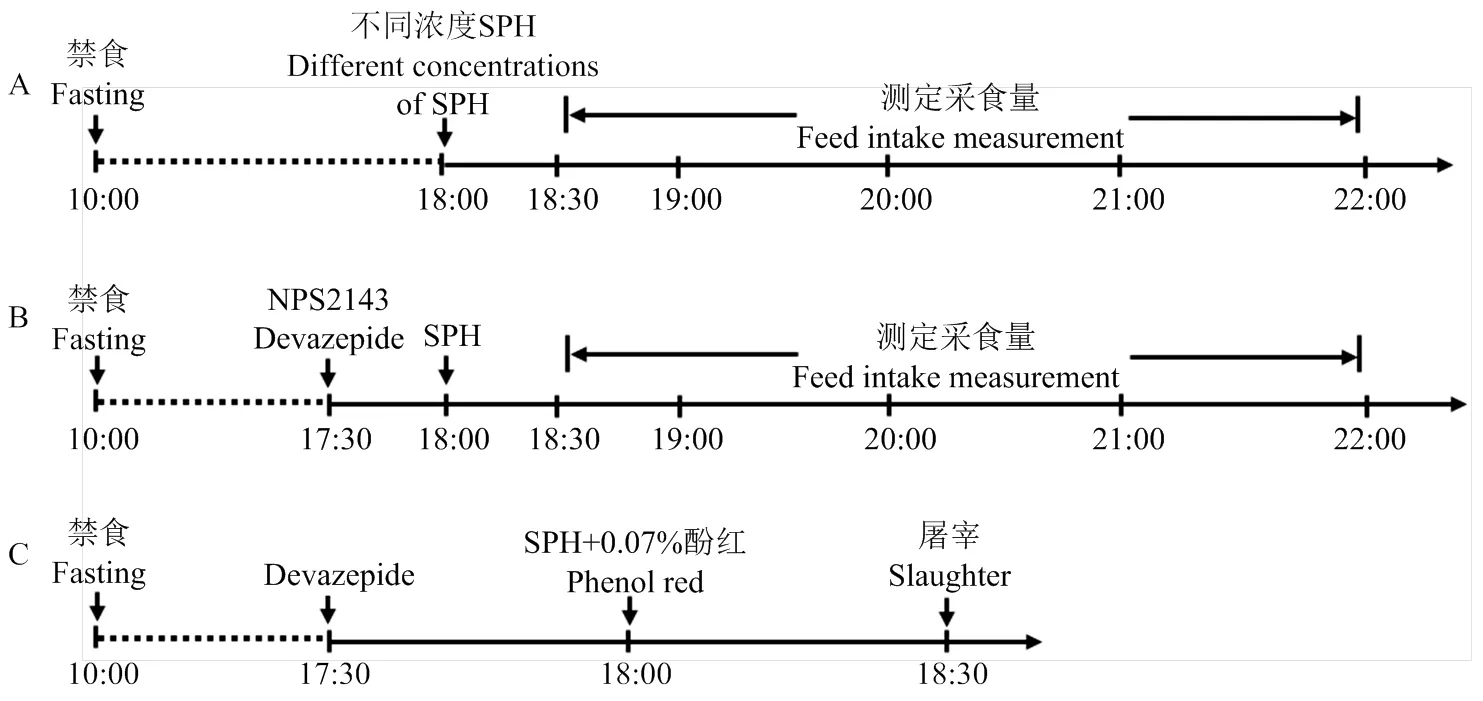
图1 试验时间线
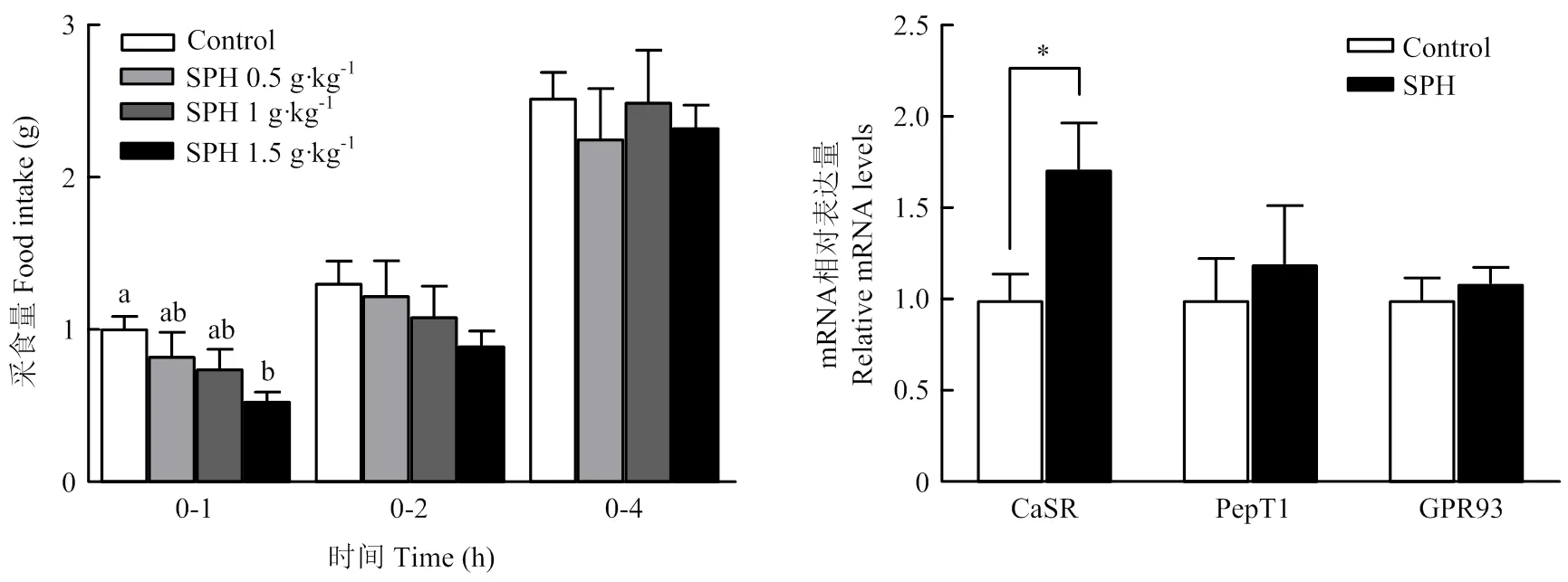
Control:生理盐水;SPH:大豆蛋白水解物;“*”表示Control vs SPH且差异显著(P<0.05);不同字母表示差异显著(P<0.05)。下同
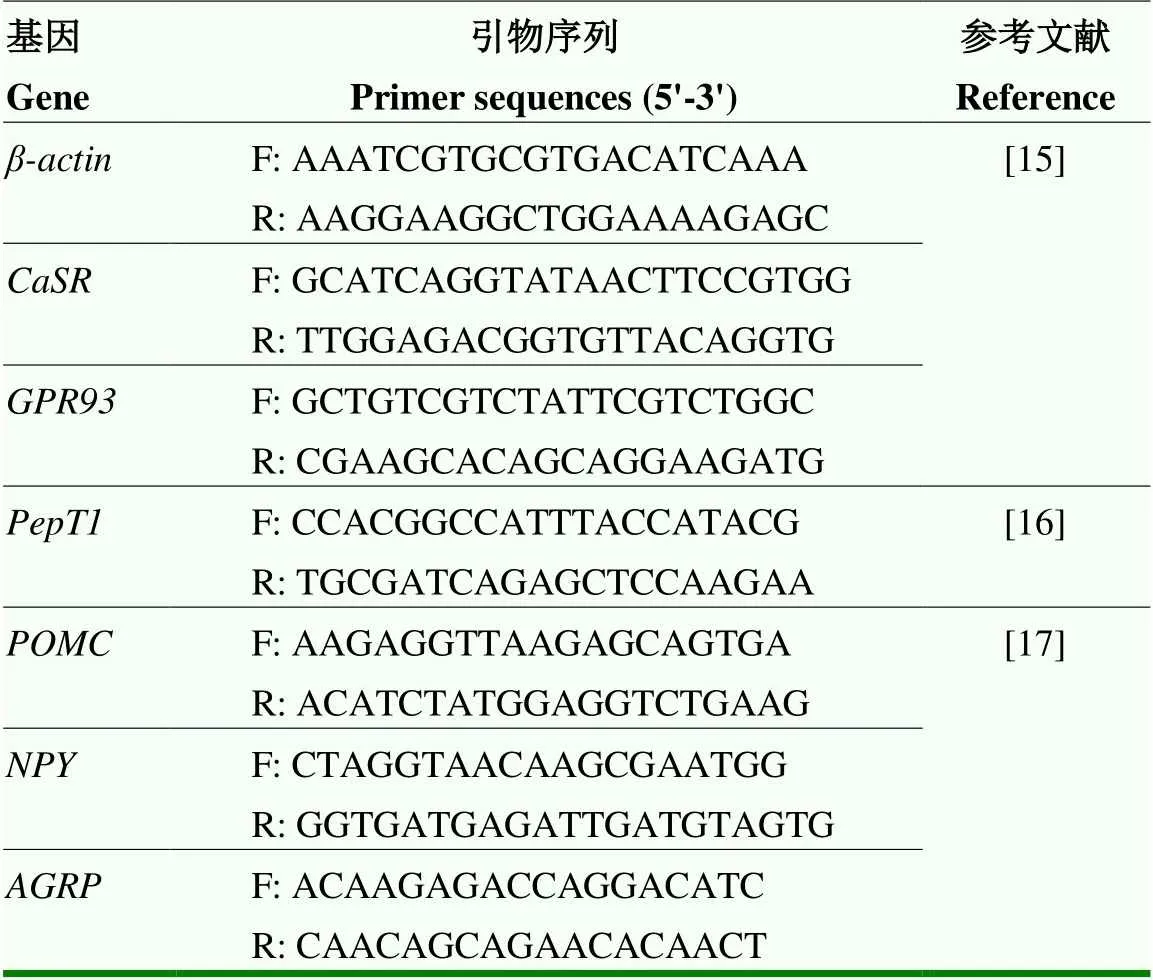
表1 荧光定量PCR引物序列
2.2 CaSR抑制剂对SPH抑制采食及促CCK分泌的影响
如图3所示。与对照组相比,SPH组小鼠0—1 h采食量显著降低,血液15 min时的CCK水平显著提高(< 0.05);而SPH + NPS2143组0—1 h采食量高于SPH组(= 0.365),且与对照组无差异(= 0.282),并伴随15 min时血液CCK水平的显著降低(<0.05)(图3-A,B)。进一步通过曲线下面积(area under the cure,AUC)分析结果表明,SPH组1 h内血液CCK分泌的总水平显著高于对照组(< 0.05),且虽然也高于SPH + NPS2143组,但差异不显著(= 0.255)(图3-C)。上述结果表明CaSR参与介导SPH抑制小鼠采食和CCK分泌。
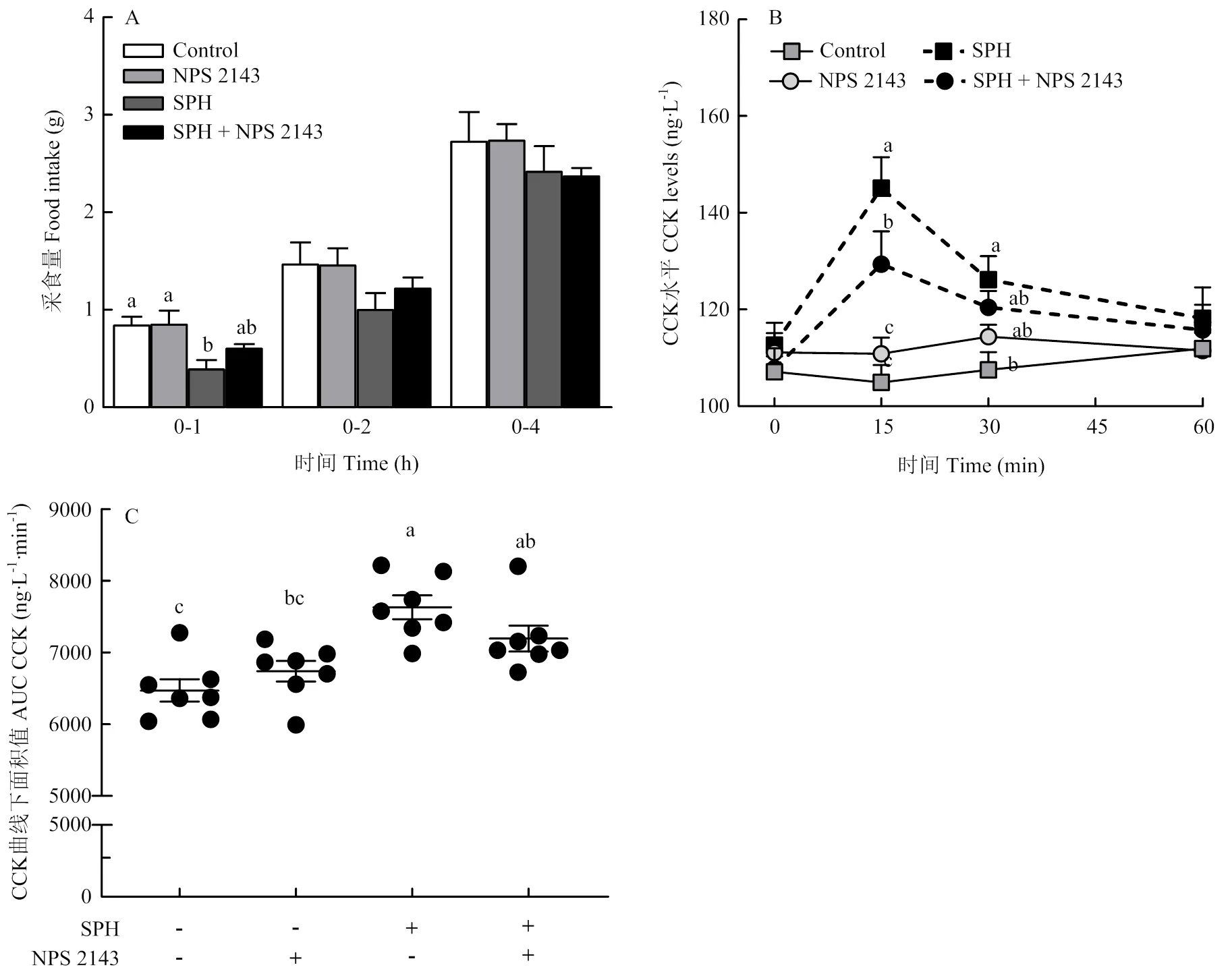
图3 CaSR抑制剂对小鼠采食和CCK分泌的影响
2.3 CCK-1受体抑制剂对SPH抑制采食的影响
如图4所示。与对照组相比,SPH组0—1和0—2 h采食量显著降低,而SPH + Devazepide组0—1和0—2 h采食量显著高于SPH组(< 0.05),且与对照组无差异(图4-A);同时,SPH组显著降低小鼠0—1 h胃排空速率(< 0.05),而对小肠蠕动速率没有影响,而SPH+Devazepide组胃排空速率显著高于SPH组(< 0.05),且与对照组无差异(图4-B,C)。此外,灌胃SPH显著提高下丘脑厌食神经因子的表达(< 0.05),而注射Devazepide后这种作用消失;但SPH对促食神经因子和的表达均无影响(图4-D)。上述结果表明SPH抑制小鼠食欲是通过刺激分泌的CCK作用于外周CCK-1受体而抑制胃排空,并提高下丘脑厌食神经因子表达实现的。
3 讨论
3.1 SPH抑制小鼠食欲,提高十二指肠CaSR的表达
研究表明蛋白水解物能抑制机体采食,Sufian等[18]灌胃猪肉蛋白水解物能显著抑制大鼠0—1 h的采食。同样地,本研究显示灌胃1.5 g·kg-1SPH显著降低小鼠0—1 h采食量,但对0—2和0—4 h的采食量无影响,这表明SPH可抑制小鼠食欲。β-伴大豆球蛋白(β-conglycinin,7S)和大豆球蛋白(glycinin,11S)是大豆蛋白的主要成分[19]。研究表明十二指肠灌注经胃蛋白酶水解后的7S蛋白而非完整的大豆蛋白,能显著降低大鼠采食量[10],这表明SPH中抑制采食的主要成分可能是水解后的7S蛋白。进一步研究发现7S中富含精氨酸的β51-63肽(Val-Arg-Ile-Arg-Leu-Leu- Gln-Arg-Phe-Asn-Lsy-Arg-Ser)是抑制食欲的关键活性肽[20]。
灌胃的SPH能够首先进入十二指肠并被该部位的营养感应受体所识别,同时十二指肠也是分泌CCK的主要部位,因此笔者进一步检测了十二指肠肽感应/转运受体的基因表达。结果显示感应受体的表达显著提高,这提示CaSR可能是介导SPH抑制小鼠采食的关键受体。CaSR既可以感应L-氨基酸(L-苯丙氨酸和L-色氨酸)[21],也可以感应γ-Glu-Cys- Gly[22]、多聚-L- Lys[23]等不同分子量的多肽。但是对于蛋白水解物而言(包括肉蛋白、酪蛋白等),CaSR主要感应其中分子量大于500Da的肽,而非游离氨基酸或二/三肽等[5]。这也提示CaSR可能主要感应SPH中的7S蛋白而抑制采食。但目前为止并无研究明确蛋白水解物中特异性激活CaSR的多肽序列。而灌胃SPH对和的表达无影响。研究表明STC-1细胞可被蛋白水解物激活促进和的表达,并提高CCK基因的转录和CCK的分泌[7-8];但以上这些研究均在细胞层面被证明,而体内环境的复杂多样可能是导致差异结果的原因。
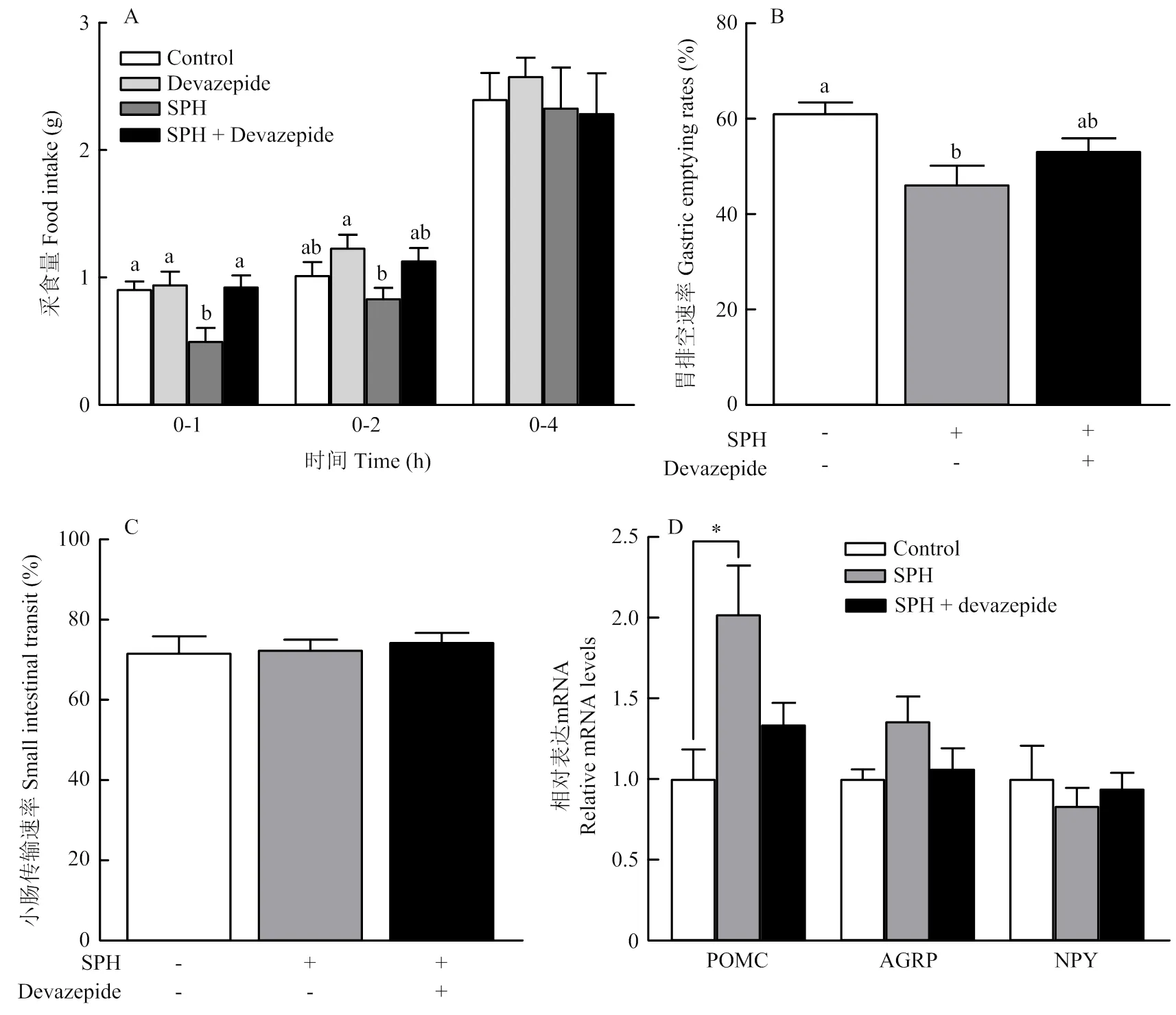
Devazepid:CCK-1R抑制剂;“#”表示SPH vs SPH+Devazepid,且差异显著
3.2 CaSR介导SPH刺激CCK分泌,抑制小鼠食欲
前一部分已证明SPH抑制小鼠采食的同时,提高了十二指肠的表达,因此笔者进一步通过腹腔注射CaSR特异性抑制剂NPS2143探究CaSR是否在SPH抑制小鼠采食中发挥关键作用。结果表明,SPH+NPS2143组0—1 h采食量高于SPH组且与对照组无差异,这表明抑制CaSR能够降低SPH对采食的抑制作用。研究表明CaSR可介导蛋白水解物刺激STC-1细胞分泌CCK[5];此外用酪蛋白水解物刺激由CaSR-/-小鼠分离得到的I细胞,发现其分泌CCK的能力显著降低[24]。由此推测CaSR可能参与介导SPH刺激CCK的分泌而抑制小鼠采食。结果表明SPH组15 min 时血液CCK水平显著高于对照组;而SPH + NPS 2143组血液CCK水平在15 min时显著低于SPH组。同时SPH组0—1 h CCK分泌的总水平显著高于对照组,而SPH+NPS2143组低于SPH组但差异不显著,这表明CaSR参与介导SPH刺激CCK的分泌。研究表明,蛋白水解物激活的CaSR一方面能通过cAMP促进PKA及CREB(cAMP-response element binding protein,CREB)转录因子的磷酸化,激活CCK基因启动子来促进CCK的转录[3];另一方面通过信号分子PLC及电压门控钙离子通道(voltage-gated calcium channel,VGCC)等通道,提高胞内Ca2+水平而促进CCK的分泌[25]。
作为主要的饱感激素,CCK主要在进食后的短时间内分泌来发挥抑制食欲的作用[26]。本研究中血液CCK水平在15 min时达到最高,这也可以部分解释为什么仅0—1 h的采食量显著降低。此外CaSR抑制剂并没有完全抑制SPH所引起的CCK分泌,这表明除了CaSR以外可能还存在其他调控通路介导SPH刺激CCK的分泌。研究表明肠黏膜能够分泌一种肠腔CCK释放因子(luminal CCK-releasing factor,LCRF),它可直接作用于分泌CCK的细胞,并通过L-型钙离子通道增加细胞内Ca2+浓度而促进CCK分泌[27]。
3.3 CCK通过外周CCK-1R抑制小鼠食欲
CCK抑制食欲的作用主要由外周CCK-1受体介导,且该信号能够通过迷走神经传入下丘脑并整合转变为采食的指令[28]。因此笔者进一步腹腔注射CCK-1R特异性抑制剂Devazepide,探究SPH刺激分泌的CCK如何抑制小鼠采食。结果表明SPH显著降低小鼠0—1 h的胃排空速率,而这种作用在SPH+ Devazepide组消失,这表明CCK可通过外周CCK-1R延缓胃排空速率而抑制食欲。RAYBOULD等[29]发现营养素刺激CCK分泌而抑制胃排空主要是通过激活迷走神经来实现的,进一步的研究揭示了这一过程,主要包括CCK通过迷走神经CCK-1R将信号传至孤束核,激活儿茶酚胺、胆碱能等抑胃神经信号并通过迷走传出神经传至肌间神经丛而抑制胃平滑肌收缩[30]。
进一步检测下丘脑摄食相关因子的表达发现SPH组厌食神经因子阿黑皮素原(pro‐opiomelanocortin,POMC)的表达显著提高,而SPH+Devazepide组与对照组的表达无变化,这表明CCK可通过CCK-1受体将信号传至下丘脑,并通过提高的表达产生厌食效应而抑制采食。大量研究表明POMC与食欲调节相关,FAN等[31]发现CCK可通过调节下丘脑POMC神经元降低小鼠采食;此外家兔饲喂高蛋白日粮可显著提高十二指肠CCK及下丘脑弓形核POMC的表达[32]。但是本研究中促食相关因子神经肽Y(neuropeptide Y,NPY)和野鼠相关肽(agouti- related peptide,AgRP)的表达均无显著变化。研究表明,NPY的表达主要随机体对能量需求的增强而升高[33]。在本试验中小鼠可自由获取食物,没有产生明显饥饿感,这可能导致灌胃SPH没有显著影响NPY基因的表达。
4 结论
大豆蛋白水解物能激活十二指肠钙敏感受体,刺激缩胆囊素分泌,抑制采食;主要通过外周缩胆囊素-1受体形成迷走神经回路,延缓胃排空速率,并提高了下丘脑厌食神经因子POMC的表达,共同抑制采食。
[1] SANTOS-HERNÁNDEZ M, MIRALLES B, AMIGO L, RECIO I. Intestinal signaling of proteins and digestion-derived products relevant to satiety. Journal of Agricultural and Food Chemistry, 2018, 66(39): 10123-10131. doi:10.1021/acs.jafc.8b02355.
[2] VELDHORST M, SMEETS A, SOENEN S, HOCHSTENBACH- WAELEN A, HURSEL R, DIEPVENS K, LEJEUNE M, LUSCOMBE- MARSH N, WESTERTERP-PLANTENGA M. Protein-induced satiety: effects and mechanisms of different proteins. Physiology & Behavior, 2008, 94(2): 300-307. doi:10.1016/j.physbeh.2008.01. 003.
[3] CARON J, DOMENGER D, DHULSTER P, RAVALLEC R, CUDENNEC B. Protein digestion-derived peptides and the peripheral regulation of food intake. Frontiers in Endocrinology, 2017, 8: 85. doi:10.3389/fendo.2017.00085.
[4] CUBER J C, BERNARD C, LEVENEZ F, CHAYVIALLE J A. Lipids, proteins and carbohydrates stimulate the secretion of intestinal cholecystokinin in the pig. Reproduction, Nutrition, Development, 1990, 30(2): 267-275.
[5] NAKAJIMA S, HIRA T, HARA H. Calcium-sensing receptor mediates dietary peptide-induced CCK secretion in enteroendocrine STC-1 cells. Molecular Nutrition & Food Research, 2012, 56(5): 753-760. doi:10.1002/mnfr.201100666.
[6] MACE O J, TEHAN B, MARSHALL F. Pharmacology and physiology of gastrointestinal enteroendocrine cells. Pharmacology Research & Perspectives, 2015, 3(4): e00155. doi:10.1002/prp2. 155.
[7] REIMANN F, TOLHURST G, GRIBBLE F M. G-protein-coupled receptors in intestinal chemosensation. Cell Metabolism, 2012, 15(4): 421-431. doi:10.1016/j.cmet.2011.12.019.
[8] LIOU A P, CHAVEZ D I, ESPERO E, HAO S Z, WANK S A, RAYBOULD H E. Protein hydrolysate-induced cholecystokinin secretion from enteroendocrine cells is indirectly mediated by the intestinal oligopeptide transporter PepT1. American Journal of Physiology Gastrointestinal and Liver Physiology, 2011, 300(5): G895-G902. doi:10.1152/ajpgi.00521.2010.
[9] KIM S S, AHN C B, MOON S W, JE J Y. Purification and antioxidant activities of peptides from sea squirt () protein hydrolysates using pepsin hydrolysis. Food Bioscience, 2018, 25: 128-133. doi:10.1016/j.fbio.2018.08.010.
[10] NISHI T, HARA H, TOMITA F. Soybean beta-conglycinin peptone suppresses food intake and gastric emptying by increasing plasma cholecystokinin levels in rats. The Journal of Nutrition, 2003, 133(2): 352-357. doi:10.1093/jn/133.2.352.
[11] WU W D, ZHOU H R, PESTKA J J. Potential roles for calcium- sensing receptor (CaSR) and transient receptor potential ankyrin-1 (TRPA1) in murine anorectic response to deoxynivalenol (vomitoxin). Archives of Toxicology, 2017, 91(1): 495-507. doi:10.1007/s00204- 016-1687-x.
[12] FLANNERY B M, CLARK E S, PESTKA J J. Anorexia induction by the trichothecene deoxynivalenol (vomitoxin) is mediated by the release of the gut satiety hormone peptide YY. Toxicological Sciences, 2012, 130(2): 289-297. doi:10.1093/toxsci/kfs255.
[13] SHIN S J, KIM D, KIM J S, KIM I, LEE J R, KIM S C, KIM B J. Effects of gamisoyo-San decoction, a traditional Chinese medicine, on gastrointestinal motility. Digestion, 2018, 98(4): 231-237. doi:10. 1159/000489455.
[14] LE THUC O, NOËL J, ROVÈRE C. Anperifusion method for quantitative determination of neuropeptide release from mouse hypothalamic explants. BIO-PROTOCOL, 2017, 16 (7): 1-9. doi:10. 21769/bioprotoc.2521.
[15] SYMONDS E L, PEIRIS M, PAGE A J, CHIA B, DOGRA H, MASDING A, GALANAKIS V, ATIBA M, BULMER D, YOUNG R L, BLACKSHAW L A. Mechanisms of activation of mouse and human enteroendocrine cells by nutrients. Gut, 2015, 64(4): 618-626. doi:10.1136/gutjnl-2014-306834.
[16] HU Y J, XIE Y H, WANG Y Q, CHEN X M, SMITH D E. Development and characterization of a novel mouse line humanized for the intestinal peptide transporter PEPT1. Molecular Pharmaceutics, 2014, 11(10): 3737-3746. doi:10.1021/mp500497p.
[17] PATKAR P P, HAO Z, MUMPHREY M B, TOWNSEND R L, BERTHOUD H R, SHIN A C. Unlike calorie restriction, Roux-en-Y gastric bypass surgery does not increase hypothalamic AgRP and NPY in mice on a high-fat diet. International Journal of Obesity, 2019, 43(11): 2143-2150. doi:10.1038/s41366-019-0328-x.
[18] SUFIAN M, HIRA T, MIYASHITA K, NISHI T, ASANO K, HARA H. Pork peptone stimulates cholecystokinin secretion from enteroendocrine cells and suppresses appetite in rats. Bioscience, Biotechnology, and Biochemistry, 2006, 70(8): 1869-1874. doi:10. 1271/bbb.60046.
[19] LIU C, WANG H L, CUI Z M, HE X L, WANG X S, ZENG X X, MA H. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein. Food Chemistry, 2007, 102(4): 1310-1316. doi:10.1016/j.foodchem.2006.07.017.
[20] NISHI T, HARA H, ASANO K, TOMITA F. The soybean beta- conglycinin beta 51-63 fragment suppresses appetite by stimulating cholecystokinin release in rats. The Journal of Nutrition, 2003, 133(8): 2537-2542. doi:10.1093/jn/133.8.2537.
[21] OHSU T, AMINO Y, NAGASAKI H, YAMANAKA T, TAKESHITA S, HATANAKA T, MARUYAMA Y, MIYAMURA N, ETO Y. Involvement of the calcium-sensing receptor in human taste perception. Journal of Biological Chemistry, 2010, 285(2): 1016-1022. doi:10.1074/jbc.M109.029165.
[22] RAY K, NORTHUP J. Evidence for distinct cation and calcimimetic compound (NPS 568) recognition domains in the transmembrane regions of the human Ca2+receptor. Journal of Biological Chemistry, 2002, 277(21): 18908-18913. doi:10.1074/jbc.M202113200.
[23] DIAKOGIANNAKI E, PAIS R, TOLHURST G, PARKER H E, HORSCROFT J, RAUSCHER B, ZIETEK T, DANIEL H, GRIBBLE F M, REIMANN F. Oligopeptides stimulate glucagon-like peptide-1 secretion in mice through proton-coupled uptake and the calcium- sensing receptor. Diabetologia, 2013, 56(12): 2688-2696. doi:10.1007/ s00125-013-3037-3.
[24] PAIS R, GRIBBLE F M, REIMANN F. Signalling pathways involved in the detection of peptones by murine small intestinal enteroendocrine L-cells. Peptides, 2016, 77: 9-15. doi:10.1016/j. peptides.2015.07.019.
[25] 王绿阳, 李英英, 李忠鑫, 杭苏琴. 动物胃肠道氨基酸感应与转运. 动物营养学报, 2020, 32(7): 3031-3038. doi:10.3969/j.issn.1006-267x. 2020.07.011.
WANG L Y, LI Y Y, LI Z X, HANG S Q. Amino acid sensing and transport in animal gastrointestinal tract. Chinese Journal of Animal Nutrition, 2020, 32(7): 3031-3038. doi:10.3969/j.issn.1006-267x.2020. 07.011. (in Chinese)
[26] SAM A H, TROKE R C, TAN T M, BEWICK G A. The role of the gut/brain axis in modulating food intake. Neuropharmacology, 2012, 63(1): 46-56. doi:10.1016/j.neuropharm.2011.10.008.
[27] WÓJCIK-GŁADYSZ A, SZLIS M. Hypothalamo-gastrointestinal axis–role in food intake regulation. Journal of Animal and Feed Sciences, 2016, 25(2): 97-108. doi:10.22358/jafs/65569/2016.
[28] LIU W L, JIN Y Y, WILDE P J, HOU Y Y, WANG Y P, HAN J Z. Mechanisms, physiology, and recent research progress of gastric emptying. Critical Reviews in Food Science and Nutrition, 2021, 61(16): 2742-2755. doi:10.1080/10408398.2020.1784841.
[29] RAYBOULD H E, ZITTEL T T, HOLZER H H, LLOYD K C, MEYER J H. Gastroduodenal sensory mechanisms and CCK in inhibition of gastric emptying in response to a meal. Digestive Diseases and Sciences, 1994, 39(12 Suppl.): 41S-43S. doi:10.1007/ BF02300368.
[30] GOYAL R K, GUO Y, MASHIMO H. Advances in the physiology of gastric emptying. Neurogastroenterology and Motility, 2019, 31(4): e13546. doi:10.1111/nmo.13546.
[31] FAN W, ELLACOTT K L J, HALATCHEV I G, TAKAHASHI K, YU P X, CONE R D. Cholecystokinin-mediated suppression of feeding involves the brainstem melanocortin system. Nature Neuroscience, 2004, 7(4): 335-336. doi:10.1038/nn1214.
[32] 隋啸一, 高琴, 刘磊, 李福昌. 饲粮蛋白质水平对家兔食欲肽基因表达的影响. 动物营养学报, 2015, 27(9): 2947-2954.
SUI X Y, GAO Q, LIU L, LI F C. Effects of dietary protein level on appetitive peptide gene expression of rabbits. Chinese Journal of Animal Nutrition, 2015, 27(9): 2947-2954. (in Chinese)
[33] CHU S C, CHEN P N, HO Y J, YU C H, HSIEH Y S, KUO D Y. Both neuropeptide Y knockdown and Y1 receptor inhibition modulate CART-mediated appetite control. Hormones and Behavior, 2015, 67: 38-47. doi:10.1016/j.yhbeh.2014.11.005.
Effects of CaSR and CCK-1R Mediated Soybean Protein Hydrolysate on Appetite Using Mouse
WANG LÜYang, CUI LeiHong, FENG JiangYin, HONG QiuXia, YOU MeiJing, BAO HaoYu, HANG SuQin
National Center for International Research on Animal Gut Nutrition/Jiangsu Key Laboratory of Gastrointestinal Nutrition and Animal Health/Laboratory of Gastrointestinal Microbiology, Nanjing Agricultural University, Nanjing 210095
【】The study aimed to investigate the effects and mechanisms of soy protein hydrolysate (SPH) on the appetite in mice, so as to provide the new frame work guidelines for strategies towards manipulating feed intake in pigs.【】In this study, the pepsin was used to hydrolyze soy protein to produce SPH. Firstly, the effects on short-term feed intake and the expressions of duodenal peptide sensing receptors calcium sensing receptor (CaSR), G protein-coupled receptor 93 (GPR9)3 and oligopeptide transporter 1 (PepT1) were investigated by intragastrically different concentrations of SPH in mice. Based on this, the CaSR inhibitor NPS2143 and the peripheral cholecystokinin-1 receptor (CCK-1R) inhibitor Devazepide were intraperitoneally injected, respectively, to investigate whether SPH inhibited feed intake by the CASR-CCK-CCK-1R-hypothalamus pathway.【】The amount of 1.5g·kg-1SPH reduced the 0-1 h feed intake (<0.05), and increased theexpression (<0.05). Compared with SPH group, the feed intake of SPH+NPS2143 group were increased at 0-1 h, and the plasma CCK levels were decreased, and there were no differences from the control group (0.05<<0.5). Meanwhile, SPH reduced 0-1 h gastric emptying rate and increased the expression of hypothalamus anorexia nerve factor pro-opiomelanocortin (POMC) (<0.05), while the effects disappeared in SPH+Devazepide group. However, SPH had no effect on the small intestine transit rate or the expression of the hypothalamic food-promoting factors neuropeptide Y (NPY) and agouti related peptide (AgRP).【】CaSR mediated SPH to promote CCK secretion, delayed gastric emptying rate through the peripheral CCK-1 receptor, and improved the expression of hypothalamic anorexia nerve factor POMC to suppress appetite.
soy protein hydrolysate; food intake; calcium sensing receptor; cholecystokinin; CCK-1 receptor; hypothalam

10.3864/j.issn.0578-1752.2022.04.015
2020-12-24;
2021-05-13
国家重点基础研究发展计划(“973”项目)(2013CB127301)、南京农业大学校级大学生创新创业训练计划(202017YX04)
王绿阳,Tel:18168080743;E-mail:2018105079@njau.edu.cn。通信作者杭苏琴,E-mail:suqinhang69@njau.edu.cn
(责任编辑 林鉴非)

