斑马鱼g型溶菌酶基因序列分析及其原核表达
陈华 林晨韬 陈曦 葛均青






摘要:【目的】實现斑马鱼g型溶菌酶在大肠杆菌中表达,以获得高纯度且具溶菌活性的融合蛋白,为探究g型溶菌酶在斑马鱼抗菌过程中的作用机制及其开发利用打下基础。【方法】通过ClustalW、ExPASy、SignalP-5.0 Server及PSIPRED等在线软件对斑马鱼g型溶菌酶进行生物信息分析,经密码子优化后合成斑马鱼g型溶菌酶基因,亚克隆至pET-28a(+)表达载体并转化大肠杆菌BL21(DE3)感受态细胞,以IPTG进行诱导表达,并通过非干扰型蛋白浓度测定试剂盒和溶菌酶测定试剂盒(比浊法)测定其浓度及溶菌活性。【结果】从GenBank检索获得的斑马鱼溶菌酶基因g1(NM_001002706.1)和g2(XM_002664371.5)分别命名为Zeb-Lys-g1和Zeb-Lys-g2。Zeb-Lys-g1基因开放阅读框(ORF)长591 bp,共编码196个氨基酸残基,其编码蛋白分子量约21.6 kD;Zeb-Lys-g2的ORF长576 bp,共编码191个氨基酸残基,其编码蛋白分子量约21.1 kD;2种斑马鱼g型溶菌酶序列中均含有2个半胱氨酸残基及3个保守的催化残基位点(Glu、Asp和Asp)。Zeb-Lys-g1的N端含有17个氨基酸的信号肽,而Zeb-Lys-g2不存在典型的信号肽结构,但其三级结构均具有多个α-螺旋结构。在基于溶菌酶序列相似性构建的系统发育进化树中,Zeb-Lys-g1序列与金鱼g型溶菌酶序列的亲缘关系最近,而Zeb-Lys-g2序列与鲈形目和鲽形目鱼类的g型溶菌酶序列亲缘关系较近。将合成的斑马鱼 g型溶菌酶基因(Zeb-Lys-g1和Zeb-Lys-g2)亚克隆至pET-28a(+)表达载体并转化BL21(DE3)感受态细胞,20 ℃下经IPTG(终浓度0.5 mmol/L)诱导16 h,可获得融合蛋白Zeb-Lys-g1和Zeb-Lys-g2,纯化后的浓度分别为1.01和1.66 mg/mL,对应的溶菌活性分别为689.68和44.39 U/mg。【结论】鱼类g型溶菌酶的基因变异较保守,经密码子优化及全基因合成方式合成的斑马鱼g型溶菌酶基因Zeb-Lys-g1和Zeb-Lys-g2可通过原核表达获得高纯度、高溶菌活性的融合蛋白,为探究斑马鱼溶菌酶的抗菌机制提供了技术支持。
关键词: 斑马鱼;g型溶菌酶;序列特征;原核表达;溶菌活性
中图分类号: S965.819 文献标志码: A 文章编号:2095-1191(2022)01-0229-09
Sequence analysis and prokaryotic expression of zebrafish
g-type lysozyme gene
CHEN Hua1, LIN Chen-tao2, CHEN Xi1, GE Jun-qing1*
(1Institute of Biotechnology,Fujian Academy of Agricultural Sciences,Fuzhou 350003, China; 2College of Life Sciences, Fujian Normal University/Center of Engineering Technology Research for Microalgae Germplasm Improvement of Fujian, Southern Institute of Oceanography/Fujian Key Laboratory of Special
Marine Bio-resources Sustainable Utilization, Fuzhou 350117, China)
Abstract:【Objective】Zebrafish g-type lysozyme was expressed in Escherichia coli to obtain a fusion protein with high purity and bacteriolytic activity, which laid a foundation for the further study of antibacterial function and application of zebrafish g-type lysozyme. 【Method】 The biological information of g-type lysozyme gene of zebrafish was analyzed by online softwares such as ClustalW, ExPASy, SignalP-5.0 Server and PSIPRED. After coding codon optimization, g-type lysozyme gene of zebrafish was synthesized, respectively, and cloned into expression vector pET-28a(+). The constructed plasmids were transformed into competent cells of E. coli BL21(DE3). Then induced with IPTG to express the g-type lysozyme, whichwas used to determine its concentration and bacteriolytic activity by non-interference protein concentration determination kit and lysozyme determination kit(turbidimetry). 【Result】Zebrafish lysozyme genes g1 (NM_001002706.1) and g2 (XM_002664371.5) retrieved from GenBank were named Zeb-lys-g1 and Zeb-lys-g2, respectively. The open reading frame (ORF) of Zeb-lys-g1 gene was 591 bp in length and encoded 196 amino acid residues, with predicted molecular weight of 21.6 kD. The ORF of Zeb-lys-g2 was 576 bp in length and encoded 191 amino acid residues, with predicted molecular weight of 21.1 kD. The two zebrafish g-type lysozyme genes both had two cysteine residues and three conserved catalytic residues (Glu, Asp and Asp). Zeb-lys-g1 contained 17 amino acid signal peptide at N-terminal, while Zeb-lys-g2 had no signal peptide, but its tertiary structure had multiple α-Spiral structure. In the phylogenetic tree constructed based on the similarity of lysozyme sequence, Zeb-lys-g1 sequence was the closest to the g-type lysozyme sequence of goldfish, while Zeb-lys-g2 sequence was closer to the g-type lysozyme sequence of perch and flounder. Zebrafish g-type lysozyme genes(Zeb-lys-g1 and Zeb-lys-g2) were subcloned intoexpression vector pET-28a(+) and transferred into competent cells of BL21(DE3). The fusion proteins Zeb-lys-g1 and Zeb-lys-g2 were obtained after induction by IPTG (final concentration 0.5 mmol/L) at 20 ℃ for 16 h. The purified concentrations were 1.01 and 1.66 mg/mL respectively, and the corresponding lysozyme activities were 689.68 and 44.39 U/mg, respectively. 【Conclusion】The gene variation of fish g-lysozyme is relatively conservative. Zebrafish g-lysozyme genes zeb-lys-g1 and zeb-lys-g2 are synthesized by codon optimization and whole gene synthesis ,which cab obtain fusion proteins with high purity and high bacteriolytic activity through prokaryotic expression, which provides technical support for exploring the antibacterial mechanism of zebrafish lysozyme.
Key words: zebrafish; g-type lysozyme; sequence characters; prokaryotic expression; bacteriolytic activity
Foundation items:Basal Research Projects for Public-interest Scientific Institutions of Fujian(2020R1027005); Free Exploration of Scientific and Technological Innovation Project of Fujian Academy of Agricultural Science(ZYTS2019013);“5511”Collaborative Innovation Project of Fujian Academy of Agricultural Sciences(XTCXGC2021013);Foreign Coo-peration Project of Fujian Academy of Agricultural Sciences(DEC201918)
0 引言
【研究意義】溶菌酶(Lysozyme)又称N-乙酰胞壁酸水解酶,可通过破坏细胞壁中肽聚糖的1,4-糖苷键,导致细菌细胞壁破裂而使细菌溶解。根据来源、结构及理化性质的不同,可将溶菌酶分为鸡蛋清溶菌酶(Chicken-type lysozyme,c型)、鹅溶菌酶(Goose-type lysozyme,g型)、无脊椎动物溶菌酶(Invertebrate-type lysozyme,i型)、细菌溶菌酶、植物溶菌酶和噬菌体溶菌酶(P型)6种类型,其中,c型、g 型及i 型溶菌酶属于动物性溶菌酶,广泛存在于动物的免疫器官和免疫细胞中(张士璀和许娜,2014;邱本丹,2016)。溶菌酶作为鱼类重要的非特异性免疫因子,与鱼类抵御细菌感染的免疫力密切相关(Ponce et al.,2011;Zhang et al.,2018;何乐等,2019)。研究表明,多数鱼类体内同时存在c型和g型2种溶菌酶,而不同类型的溶菌酶其结构特征和理化性质不同,在组织内的分布也存在差异(邱本丹,2016)。因此,探析斑马鱼g型溶菌酶基因序列特征并进行诱导表达,可为揭示g型溶菌酶在斑马鱼抗菌过程中的作用机制及其开发利用打下基础。【前人研究进展】溶菌酶可诱导硬骨鱼类的特异性和非特异性免疫应答,提高机体免疫力,具有抗菌、抗病毒和抗炎症等特性,是一种天然的内源性抗生素(Shakoori et al.,2019)。鱼类溶菌酶主要有c型和g型,且在多数鱼类体内同时存在,包括草鱼(Ctenopharyngodon idella)(Wang et al.,2016)、大菱鲆(Scophthalmus maximus)(姚佳俊,2017)、长丰鲫(Carassius auratus gibelio)(姚佳俊,2017)和牙鲆(Paralichthys olivaceus)(刘然然,2018)等。目前,针对鱼类溶菌酶的研究主要集中在c型,仅有几种重要经济鱼类g型溶菌酶的相关报道,如团头鲂(Megahbrama amblycephala)(章琼等,2015)、大黄鱼(Larimichthys crocea)(邱本丹,2016)、淇河鲫(C. auratus)(Wang et al.,2016)及达氏鲟(Acipenser dabryanus)(Zhang et al.,2018)等。此外,部分经济鱼类的g型溶菌酶已被成功表达。Ye等(2010)采用原核表达系统成功表达出草鱼g型溶菌酶,并证实其具有溶菌活性,但与草鱼c型溶菌酶在免疫防御功能上存在明显差异;徐玮(2015)从七鳃鳗(Lampetra japonica)中克隆获得g型溶菌酶基因cDNA序列,经脂多糖(LPS)体内刺激后g型溶菌酶在生殖腺中的表达量显著升高,且通过扫描电镜观察发现重组酶能使溶壁微球菌破裂;杨勇等(2017)通过构建真核表达载体,在内皮祖细胞(EPCs)中成功表达出日本鳗鲡(Anguilla japonica) c型溶菌酶,并证实其对溶壁微球菌有明显的生长抑制作用。斑马鱼(Danio rerio)是脊椎动物研究中应用最广泛的模式动物之一,由于不同种类的病原菌均能感染斑马鱼及其胚胎(单颖,2016;冯鹏霏等,2021),因此成为研究鱼类病原菌感染免疫应答的理想模型(Rakus et al.,2019),目前已建立多种斑马鱼—细菌感染模型,包括迟钝爱德华氏菌(Edwardsiella tarda)、链球菌(Streptococcus)、杀鲑气单胞菌(Aeromonas salmonicida)、柱状黄杆菌(Flavobacterium cloumnare)及海分枝杆菌(Mycobacterium ma-rinum)等(单颖,2016)。本课题组前期研究也发现,创伤弧菌(Vibrio vulnificus)感染斑马鱼后其肾脏中的溶菌酶表达量极显著升高,故推测溶菌酶在斑马鱼抵御创伤弧菌过程中发挥了重要作用(陈华等,2018;Chen et al.,2020)。【本研究切入点】斑马鱼体内同时存在c型和g型溶菌酶(Jiménez-Cantizano et al.,2008),且母源性溶菌酶在斑马鱼胚胎抗菌过程中扮演着重要角色。虽然Liu和Wen(2015)从斑马鱼头肾中成功克隆出c型溶菌酶,并证实其在斑马鱼巨噬细胞系中特异表达,但至今鲜见针对斑马鱼g型溶菌酶的研究报道。【拟解决的关键问题】对斑马鱼g型溶菌酶氨基酸序列进行生物信息学分析,通过优化密码子筛选蛋白诱导表达条件,实现斑马鱼g型溶菌酶在大肠杆菌中表达,以获得高纯度且具溶菌活性的融合蛋白,为探究g型溶菌酶在斑马鱼抗菌过程中的作用机制及其开发利用打下基础。
1 材料与方法
1. 1 试验材料
pET-28a表达载体和大肠杆菌(Escherichia coli)BL21(DE3)感受态细胞由福建省农业科学院生物技术研究所保存提供。pMD18-T载体、Premix Taq DNA聚合酶及QuickCutTM BamH I/Xho I购自宝日医生物技术(北京)有限公司,非干扰型蛋白质浓度测定试剂盒购自生工生物工程(上海)股份有限公司,溶菌酶测定试剂盒购自南京建成科技有限公司。
1. 2 溶菌酶序列生物信息学分析
利用ClustalW(https://www.ebi.ac.uk/Tools/msa/clustalw2/)对从NCBI检索斑马鱼g型溶菌酶氨基酸序列Zeb-Lys-g1(NM_001002706.1)和Zeb-Lys-g2(XM_002664371.5)進行比对;采用ExPASy(https://web.expasy.org/protparam/)预测蛋白理化性质;运用CDD(https://www.ncbi.nlm.nih.gov/cdd/)分析目的蛋白保守功能域;利用SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP-5.0/)预测蛋白信号肽;采用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白亲/疏水性;利用SWISS-MODEL(https://swissmodel.expasy.org/)预测蛋白三级结构,以PredictProtein(https://predictprotein.org/)分析其二硫键;运用DNAMAN进行氨基酸序列比对分析,并通过MEGA 4.0的邻接法(Neighbor-joining,NJ)构建系统发育进化树,设Bootstrap为1000次。
1. 3 斑马鱼g型溶菌酶基因密码子优化
按照大肠杆菌密码子偏好性和避免重复序列的原则,在不改变氨基酸序列的前提下,去除信号肽序列后利用密码子优化软件对其基因序列进行密码子优化。同时,根据密码子优化后的斑马鱼g型溶菌酶基因(Zeb-Lys-g1和Zeb-Lys-g2)设计扩增引物(表1),并在5'端引入BamH I酶切位点、3'端引入Xho I酶切位点(下划线部分)。密码子优化后的斑马鱼 g型溶菌酶基因扩增引物委托生工生物工程(上海)股份有限公司合成。
1. 4 溶菌酶基因表达载体构建
以合成的斑马鱼g型溶菌酶基因序列Zeb-Lys-g1和Zeb-Lys-g2为模板,采用上述引物进行PCR扩增,纯化回收扩增产物,利用BamH I/Xho I对扩增产物和pET-28a(+)表达载体进行双酶切,酶切后的片段经2.0%琼脂糖凝胶电泳分离,分别割胶回收目的条带,并进行双酶切鉴定。用T4连接酶连接后,转化TOP10感受态细胞,挑选阳性克隆提取质粒,将酶切验证呈阳性的重组质粒送至生工生物工程(上海)股份有限公司测序,构建成功的重组质粒分别命名为pET-Zeb-Lys-g1和pET-Zeb-Lys-g2。
1. 5 溶菌酶诱导表达与纯化
通过热激法将重组质粒pET-Zeb-Lys-g1和pET-Zeb-Lys-g2分别转化BL21(DE3)感受态细胞,挑取单菌落接种至含50 μg/mL卡那霉素的LB液体培养基中,当OD达0.6时,添加IPTG至终浓度为0.5 mmol/L,在不同温度下进行诱导表达。离心收集菌体,加入咪唑缓冲液进行重悬,超声波破碎后收集上清液(粗蛋白)。取5 mL Ni-NTA,以5倍柱床体积的Binding Buffer清洗平衡柱,流速5 mL/min。上清液与平衡的柱填料孵育1 h后上柱,以尿素缓冲液清洗平衡柱,再以含尿素的咪唑缓冲液洗柱子并进行洗脱,收集流出液。对纯化的蛋白进行透析和浓缩,采用SDS-PAGE电泳进行验证,-80 ℃保存备用。
1. 6 纯化斑马鱼g型溶菌酶蛋白浓度测定及活性分析
根据非干扰型蛋白浓度测定试剂盒说明测定纯化后的斑马鱼g型溶菌酶融合蛋白(Zeb-Lys-g1和Zeb-Lys-g2)浓度;同时采用溶菌酶测定试剂盒(比浊法)测定复性溶菌酶的溶菌活性,具体操作步骤如下:取4个离心管分别加入30.0 μL双蒸水、溶菌酶标准应用液、纯化融合蛋白Zeb-Lys-g1和Zeb-Lys-g1,各管中加入300.0 μL应用菌液,混匀后置于37 ℃水浴中孵育15 min,取出置于冰水浴中3 min,然后转移至96孔细胞板中,采用酶标仪测定530 nm处的透光度T15,计算溶菌酶活性。
2 结果与分析
2. 1 斑马鱼g型溶菌酶序列特征分析结果
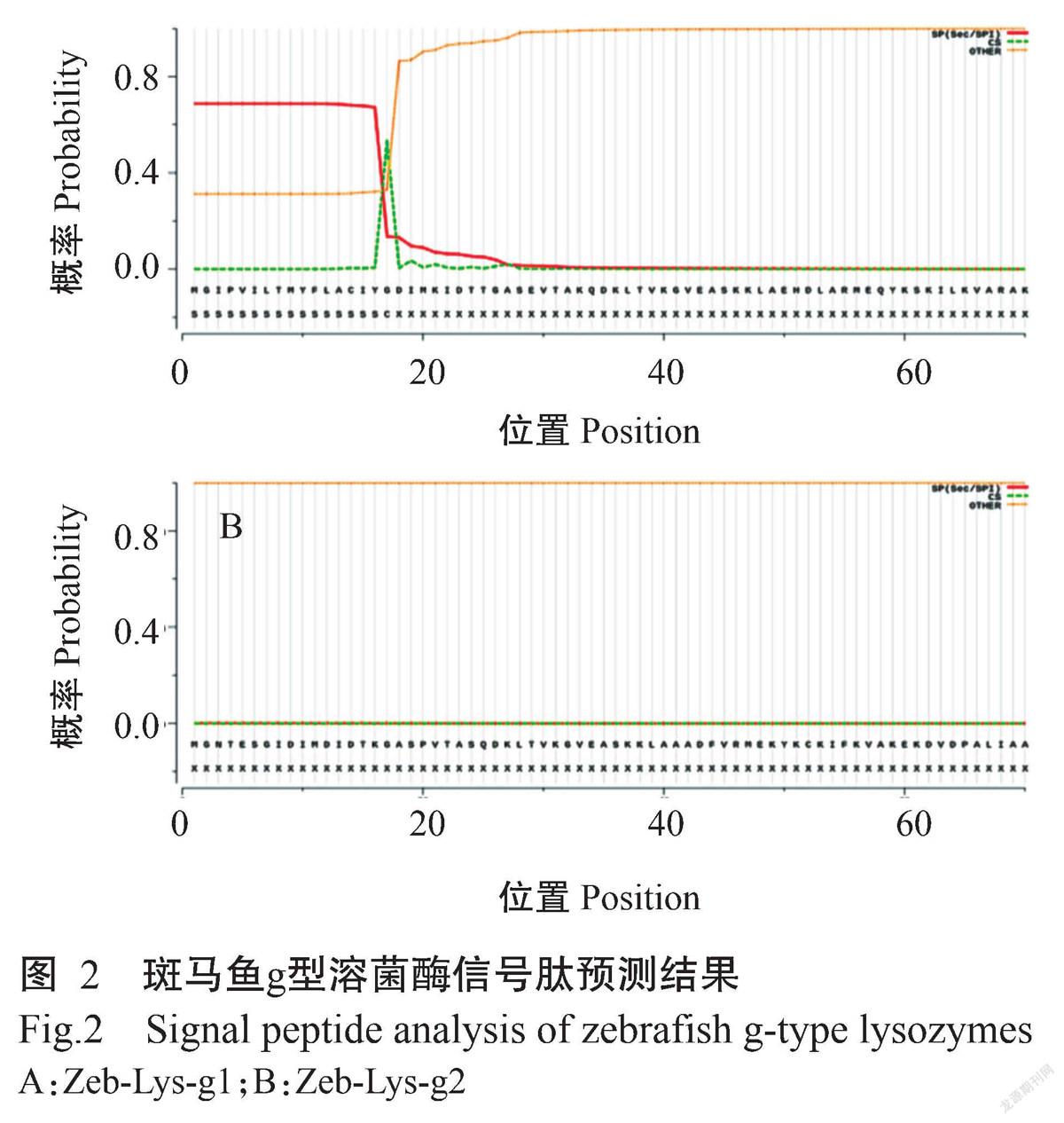
从GenBank检索斑马鱼溶菌酶基因g1(NM_001002706.1)和g2(XM_002664371.5)的开放阅读框(ORF)序列,分别命名为Zeb-Lys-g1和Zeb-Lys-g2。Zeb-Lys-g1基因ORF长591 bp,共编码196个氨基酸残基(图1-A);其编码蛋白分子量约21.6 kD,包含3个保守的催化位点,分别为Glu(84E)、Asp(97D)和Asp(108D);有11个糖结合位点,分别为Glu(84E)、Gln(106Q)、Val(107V)、Asp(108D)、Tyr(111Y)、His(112H)、Ile(130I)、Tyr(134Y)、Tyr(158Y)、Asn(159N)和Gly(161G);有2个半胱氨酸残基,分别为Cys(14C)和Cys(150C)。Zeb-lys-g2基因ORF长576 bp,共编码191个氨基酸残基(图1-B);其编码蛋白分子量约21.1 kD,包含3个保守的催化位点,分别为Glu(75E)、Asp(88D)和Asp(99D);有11个糖结合位点,分别为Glu(75E)、Gln(97Q)、Val(98V)、Asp(99D)、Tyr(102Y)、His(103H)、Ile(121I)、Phe(125F)、Tyr(149Y)、Asn(150N)和Gly(152G);有2个半胱氨酸残基,分别为Cys(52C)和Cys(141C)。蛋白保守功能结构域预测发现,Zeb-Lys-g1和Zeb-Lys-g2均含有g型溶菌酶的鹅蛋清溶菌酶(GEWL)结构域、可溶性裂解转糖苷酶(SLT)结构域和裂解转糖苷酶(LT)催化结构域。SignalP-5.0信号肽预测结果显示,Zeb-Lys-g1的N端含有17个氨基酸的信号肽,其剪切位点可能位于第 17~18位氨基酸之间(图2-A);而Zeb-Lys-g2不存在典型的信号肽结构(图2-B)。
2. 2 斑马鱼g型溶菌酶结构特征分析结果
氨基酸排列方式及其亲/疏水性直接影响蛋白的空间结构,进而决定蛋白的理化性质和功能。Zeb-lys-g1氨基酸酸碱性及亲/疏水性预测结果(图3-A)显示:酸性氨基酸23个(占12.73%),出现频率为11.73%;碱性氨基酸28个(占17.05%),出现频率为14.29%;极性氨基酸43个(占23.21%),出现频率为21.94%;疏水性氨基酸68个(占33.05%),出现频率为34.69%。Zeb-lys-g1二级结构中α-螺旋(Alpha helix)占42.35%、β-折叠(Extended strand)占26.53%、无规则卷曲(Random coil)占31.12%;其三级结构预测结果显示,Zeb-lys-g1具有多个α-螺旋结构(图4-A)。
Zeb-lys-g2氨基酸酸碱性及亲/疏水性预测结果(图3-B)显示:酸性氨基酸27个(占15.26%),出现频率为14.14%;碱性氨基酸29个(占18.17%),出现频率为15.18%;极性氨基酸39个(占20.85%),出现频率为20.42%;疏水性氨基酸67个(占33.69%),出现频率为35.08%。Zeb-lys-g2二级结构中α-螺旋占43.46%、β-折叠占18.85 %、无规则卷曲占37.70%;其三级结构预测结果显示,Zeb-Lys-g2也具有多个α-螺旋结构(图4-B)。
2. 3 斑马鱼g型溶菌酶的系统进化分析结果
将Zeb-Lys-g1和Zeb-Lys-g2与其他28种不同物种的g型溶菌酶进行多序列比对,并采用NJ法构建系统发育进化树,结果(图5)显示,Zeb-Lys-g1序列与鲤科金鱼(C. auratus)g型溶菌酶序列的亲缘关系最近,其次是与鮰科蓝色鲶鱼(Ictalurus furcatus)和斑点叉尾鮰(I. punctatus)的g型溶菌酶序列;Zeb-Lys-g2序列则与鲈形目和鲽形目鱼类的g型溶菌酶序列亲缘关系较近,与鸟类和爬行类动物的g型溶菌酶序列亲缘关系也相对较近;而哺乳动物、节肢动物和软体动物的g型溶菌酶聚于另一进化分支。
2. 4 斑马鱼g型溶菌酶基因密码子优化结果
按照大肠杆菌的密码子偏好性和避免重复序列的原则,在不改变编码氨基酸序列的情况下对斑马鱼g型溶菌酶基因(Zeb-Lys-g1和Zeb-Lys-g2)序列进行密码子优化,优化前后的基因核苷酸序列序列如图6所示。
2. 5 斑马鱼g型溶菌酶基因表达载体构建
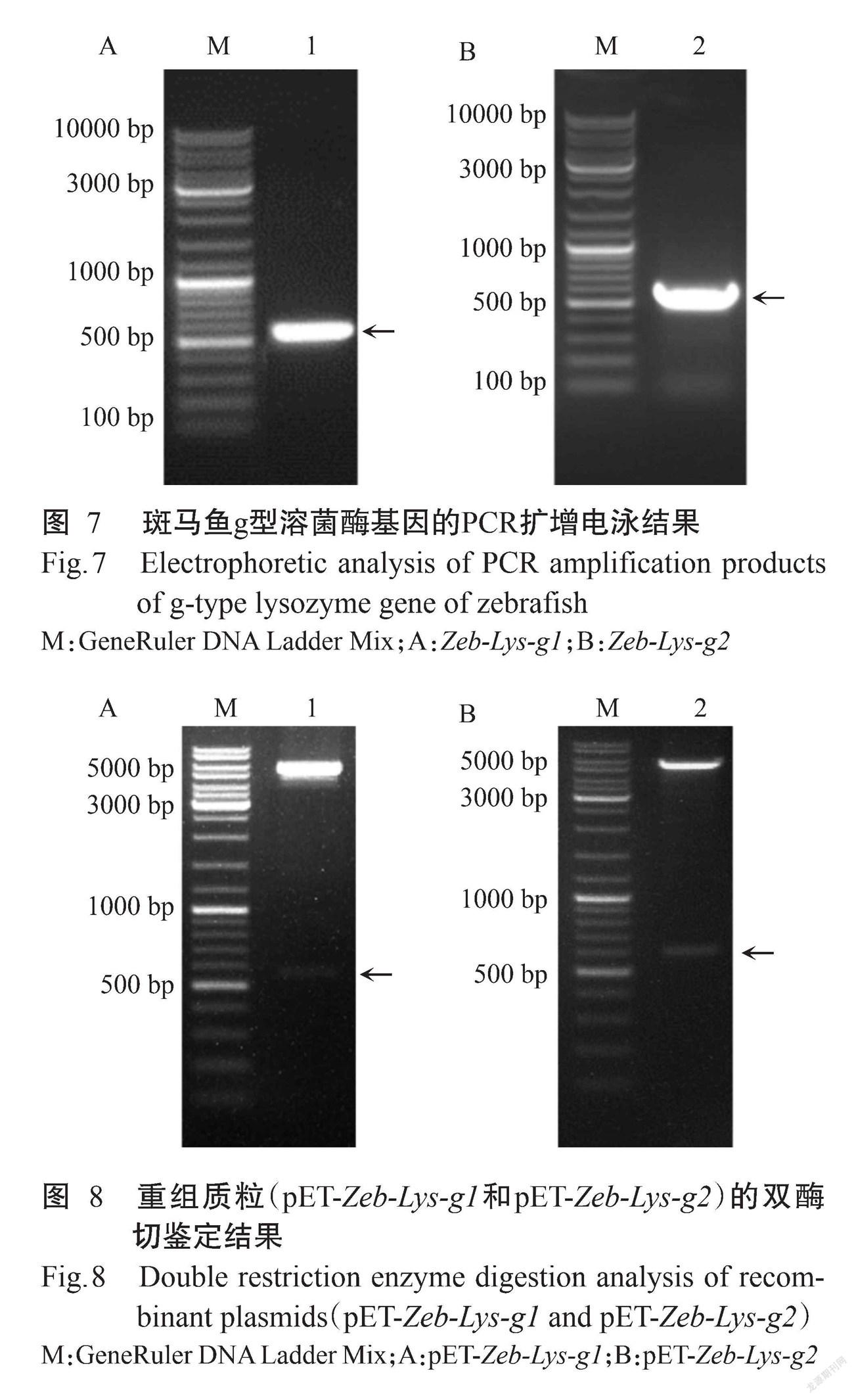
以合成的Zeb-Lys-g1和Zeb-Lys-g2基因为模板进行PCR扩增,PCR扩增产物经2.0%琼脂糖凝胶电泳,结果(图7)显示均扩增出大小约500 bp的特异性条带,与预期结果相符。利用BamH I/Xho I对PCR扩增产物进行双酶切,回收溶菌酶基因片段,与pET-28a(+)表达载体连接,获得的重组质粒以BamH I/Xho I进行双酶切鉴定,结果均获得与预期结果一致的特异性条带(图8)。测序验证结果表明,已成功构建获得重组质粒pET-Zeb-Lys-g1和pET-Zeb-Lys-g2。
2. 6 斑马鱼g型溶菌酶在大肠杆菌中的表达情况
将重组质粒pET-Zeb-Lys-g1和pET-Zeb-Lys-g2分别转化BL21(DE3)感受态细胞,在20 ℃下以IPTG诱导表达16 h,经纯化、透析和浓缩后进行SDS-PAGE电泳检测。结果(图9)显示,以重组质粒pET-Zeb-Lys-g1和pET-Zeb-Lys-g2转化的BL21感受态细胞分别在24.2和25.5 kD处出现特异性条带,表明可通过大肠杆菌体外诱导表达获得融合蛋白Zeb-Lys-g1和Zeb-Lys-g2。
2. 7 纯化融合蛋白浓度及落菌活性分析结果
依据非干扰型蛋白浓度测定试剂盒的标准品绘制标准曲线,得到融合蛋白浓度线性方程为:y= -217.91x+193.24(R2=0.9913),测得纯化的融合蛋白Zeb-Lys-g1浓度为1.01 mg/mL,Zeb-Lys-g2浓度为1.66 mg/mL。进一步利用溶菌酶测定试剂盒测定重组斑马鱼g型溶菌酶的溶菌活性,结果显示Zeb-Lys-g1和Zeb-Lys-g2的溶菌活性分别为689.68和44.39 U/mg,表明已成功原核表达获得具较高溶菌活性的斑马鱼g型溶菌酶,但二者的溶菌活性差异明显,可能与其功能作用相关。
3 讨论
鱼类溶菌酶较陆生动物溶菌酶具有更广的抗菌谱,能溶解革兰氏阳性菌和革兰氏阴性菌(朱站英,2012),在水生动物病害防治中具有良好的应用前景。鹅蛋清溶菌酶是g型溶菌酶的典型代表,具有3个酶活性位点,分别为73Glu、86Asp和97Asp(杨勇等,2017)。本研究结果表明,斑马鱼g型溶菌酶结构域中也含有这3个保守的活性催化位点,即Zeb-Lys-g1的Glu(84E)、Asp(97D)、Asp(108D)和Zeb-Lys-g2的Glu(75E)、Asp(88D)、Asp(99D),與欧洲鳗鲡(A. anguilla)、大黄鱼、金鱼等鱼类的g型溶菌酶(王美娟等,2014;邱本丹,2016)一致,但各自所在的位置不同。也有部分鱼类g型溶菌酶仅存在2个保守的催化位点,如日本鳗鲡缺失Asp(86D)催化位点(杨勇等,2017)。此外,斑马鱼g型溶菌酶(Zeb-Lys-g1和Zeb-Lys-g2)氨基酸序列与多数经济鱼类的g型溶菌酶氨基酸序列具有较高的相似性,故推测鱼类g型溶菌酶结构域中的第1位Glu和第3位Asp残基可能是其发挥抗菌作用的特殊结构。
半胱氨酸(Cys)残基是形成二硫键的必要条件,而二硫键的存在有助于维持溶菌酶结构稳定性,从而增强鱼类对环境改变的适应性(刘然然,2018)。已有研究表明,鱼类c型溶菌酶中存在8个Cys残基,可形成4对二硫键(邱本丹,2016);但g型溶菌酶中的Cys残基数量较少,大西洋鲑鱼g型溶菌酶中仅存在3个Cys残基(邱本丹,2016),日本鳗鲡和大菱鲆等仅存在2个Cys残基(Zhao et al.,2011;杨勇等,2017),大黄鱼仅有1个Cys残基(邱本丹,2016),鲤和条石鲷中不存在Cys残基(Savan et al.,2003;Whang et al.,2011)。本研究中,2种斑马鱼g型溶菌酶序列中均含有2个Cys残基,但并未形成二硫键,可能是由于这2个Cys残基没有在形成二硫键的正确位置上,故推测鱼类g型溶菌酶还存在其他结构稳定机制。
多数鱼类的c型溶菌酶因存在N端信号肽,被认为是一种分泌型蛋白(Wang et al.,2016);但鱼类 g型溶菌酶无信号肽,无法通过分泌途径进行分泌,故推测是一种胞内蛋白(朱站英,2012;王美娟等,2014)。系统进化分析结果显示,鱼类g型溶菌酶较保守,多数鱼类仅含有1种g型溶菌酶,而斑马鱼存在2种g型溶菌酶,且溶菌酶Zeb-Lys-g1存在N端信号肽,说明这2种g型溶菌酶可能具有不同的分子功能,但具体的溶菌活性差异及其作用机制有待进一步探究。本研究的系统发育进化树显示,Zeb-Lys-g1和Zeb-Lys-g2均优先与经济鱼类的g型溶菌酶聚为一支,且相似性在90.0%以上,说明在生物进化过程中鱼类g型溶菌酶的基因变异较保守,也进一步证实斑马鱼溶菌酶与大部分经济鱼类溶菌酶的亲缘关系较近。
本研究通过原核表达载体成功诱导表达获得斑马鱼g型溶菌酶的融合蛋白Zeb-Lys-g1和Zeb-Lys-g2,并对其溶菌活性进行分析,结果发现诱导表达获得的2种融合蛋白均具备溶菌活性,为以溶菌酶作为动物养殖替抗物的开发与应用打下了基础,但今后还需以创伤弧菌、嗜水气单胞菌(Aeromonas hydro-phila)、鳗弧菌(V. anguillarum)、爱德华氏菌(Edwar-dsiella)及罗非鱼无乳链球菌(Streptococcus agalactiae)等主要鱼源致病菌作为指示菌进行抑菌试验,通过比浊法或扫描电镜等验证Zeb-Lys-g1和Zeb-Lys-g2对不同病原菌的抑菌效果,系统探索鱼类g型溶菌酶的抗菌机制。
4 结论
鱼类g型溶菌酶的基因变异较保守,经密码子优化及全基因合成方式合成的斑马鱼g型溶菌酶基因Zeb-Lys-g1和Zeb-Lys-g2可通过原核表达获得高纯度、高溶菌活性的融合蛋白,为探究斑马鱼溶菌酶的抗菌机制提供了技术支持。
参考文献:
陈华,李素一,张丽娟,柯翎,陈叙,林晨韬. 2018. CpG-ODN 2006对斑马鱼抗创伤弧菌感染的作用[J]. 福建农业学报,33(1):1-6. [Chen H,Li S Y,Zhang L J,Ke L,Chen X,Lin C T. 2018. Function of CpG-ODN2006 on resistance of zebrafish against Vibrio vulnificus[J]. Fujian Journal of Agricultural Sciences,33(1):1-6.] doi:10.19303/j.issn.1008-0384.2018.01.001.
冯鹏霏,肖蕊,张永德,林勇,宋漫玲,潘传燕,余艳玲,罗辉,罗洪林. 2021. 斑马鱼血管新生相关因子PTPRB的原核表达及其多克隆抗体制备[J]. 南方农业学报,52(4):1090-1097. [Feng P F,Xiao R,Zhang Y D,Lin Y,Song M L,Pan C Y,Yu Y L,Luo H,Luo H L. 2021. Prokaryo-tic expression and polyclonal antibody preparation of Danio rerio angiogenesis related factor PTPRB[J]. Journal of Southern Agriculture,52(4):1090-1097.] doi:10.3969/ j.issn.2095-1191.2021.04.028.
何乐,翟少伟,冯建军,江兴龙,肖益群,郭松林. 2019. 日本鳗鲡嗜水气单胞菌的分离鉴定与免疫相关基因变化的研究[J]. 集美大学学报(自然科学版),24(4):249-257.[He L,Zhai S W,Feng J J,Jiang X L,Xiao Y Q,Guo S L. 2019. Isolation and identification of pathogenic Aeromo-nas hydrophila from Japanese eel (Anguilla japonica) and the different expression of immune related genes after eels naturally infected by A. hydrophila[J]. Journal of Jimei University(Natural Science),24(4):249-257.]doi:10.19715/j.jmuzr.2019.04.02.
刘然然. 2018. 大鲵c-型和g-型溶菌酶基因的生物信息学分析和表达研究[D]. 杨凌:西北农林科技大学. [Liu R R. 2018. Bioinformatics analysis and expression research of c-style lysozyme gene and g-style lysozyme gene from Chinese giant salamander[D]. Yangling:Northwest A & F University.]
邱本丹. 2016. 大黃鱼溶菌酶对鳗弧菌胁迫的响应研究[D]. 舟山:浙江海洋大学. [Qiu B D. 2016. The response of c-type and g-type lysozyme in large yellow croaker(Larimichthys crocea) to Vibrio anguillarum[D]. Zhoushan:Zhejiang Ocean University.] doi:10.7666/d.Y3163145.
单颖. 2016. 单核细胞增生李斯特菌:无菌斑马鱼感染模型及Mmp-9在抗细菌感染中的作用机制[D]. 杭州:浙江大学.[Shan Y. 2016. Listeria monocytogenes:Germ-free zebrafish infection model and the antibacterial role of Mmp-9 during infection[D]. Hangzhou:Zhejiang University.]
王美娟,刘丹丹,乔丹,张红绪,孔祥会. 2014. 鱼类g型和c型溶菌酶及其在渔业生产上的应用[J]. 水产科学,33(3):195-200. [Wang M J,Liu D D,Qiao D,Zhang H X,Kong X H. 2014. The g-type and c-type lysozymes of fish and application in fisheries[J]. Fisheries Science,33(3):195-200.] doi:10.3969/j.issn.1003-1111.2014.03.013.
徐玮. 2015. 七鳃鳗g型溶菌酶和含硒谷胱甘肽过氧化物酶2分子克隆、组织表达及生物活性研究[D]. 大连:辽宁师范大学. [Xu W. 2015. Cloning,expression and function analysis of the g-type lysozyme and glutathione peroxidase 2 from Lampetra japonica[D]. Dalian:Liaoning Normal University.]
杨勇,黄贝,黄文树,段明珠,张芳芳,聂品. 2017. 日本鳗鲡的C-型和G-型溶菌酶研究[J]. 水生生物学报,41(4):807-818. [Yang Y,Huang B,Huang W S,Duan M Z,Zhang F F,Nie P. 2017. Chicken- and goose- type lysozyme genes in the Japanese eel Anguilla japonica[J]. Acta Hydrobiologica Sinica,41(4):807-818.] doi:10.7541/2017.101.
姚佳俊. 2017. 长丰鲫c型和g型溶菌酶基因的克隆及其在细菌感染条件下的表达分析[D]. 武汉:华中农业大学. [Yao J J. 2017. Molecular cloning and expression analysis of c-type and g-type lysozyme gene in Changfeng Carassiu auratuslype gibelio during bacterial infection[D]. Wuhan:Huazhong Agricultural University.]
張士璀,许娜. 2014. 动物型溶菌酶研究新进展[J]. 中国海洋大学学报,44(6):46-51. [Zhang S C,Xu N. 2014. Advance in study of animal lysozymes[J]. Periodical of Ocean University of China,44(6):46-51.] doi:10.16441/j.cnki.hdxb.2014.06.007.
章琼,孙盛明,李冰,蒋高中,朱健,戈贤平. 2015. 团头鲂g型溶菌酶基因全长cDNA的克隆与表达分析[J]. 南方水产科学,11(2):41-49. [Zhang Q,Sun S M,Li B,Jiang G Z,Zhu J,Ge X P. 2015. Molecular cloning and expression analysis of g-type lysozyme gene from blout snout bream(Megahbrama amblycephala)[J]. South China Fi-sheries Science,11(2):41-49.] doi:10.3969/j.issn.2095-0780.2015.02.006.
朱站英. 2012. 草鱼免疫细胞和免疫相关基因研究:自然杀伤细胞杀伤活性和溶菌酶mRNA的表达[D]. 上海:上海海洋大学. [Zhu Z Y. 2012. Research on immune cells and immune genes of grass carp:Natural killer cell activities and the mRNA expression of lysozyme genes[D]. Shanghai:Shanghai Ocean University.]
Chen H,Zhang L J,Ke L,Chen X,Lin C T. 2020. CpG-ODN 2007 protects zebrafish(Danio rerio) against Vibrio vulnificus infection[J]. Aquaculture Research,52(3):897-905. doi:10.1111/are.14944.
Jiménez-Cantizano R M,Infante C,Martin-Antonio B,Ponce M,Hachero I,Navas J I,Manchado M. 2008. Molecular characterization,phylogeny,and expression of c-type and g-type lysozymes in brill(Scophthalmus rhombus)[J]. Fish & Shellfish Immunology,25(1-2):57-65. doi:10.1016/j.fsi.2007.12.009.
Liu F,Wen Z L. 2015. Cloning and expression pattern of the lysozyme C gene in zebrafish[J]. Mechanisms of Deve-lopment,113(1):69-72. doi:10.1016/S0925-4773(01)00658-X.
Ponce M,Salas-Leiton E,Garcia-Cegarra A,Boglino A,Coste O,Infante C,Gisbert E,Rebordinos L,Manchado M. 2011. Genomic characterization,phylogeny and gene regulation of g-type lysozyme in sole(Solea senegalensis)[J]. Fish & Shellfish Immunology,31(6):925-937. doi:10.1016/j.fsi.2011.08.010.
Rakus K,Adamek M,Mojżesz M,Podlasz P,Chmielewska-Krzesińska M,Naumowicz K,Kasica-Jarosz N,Kłak K,Rakers S,Way K,Steinhagen D,Chadzińska M. 2019. Evaluation of zebrafish(Danio rerio) as an animal model for the viral infections of fish[J]. Journal of Fish Disea-ses,42(6):923-934. doi:10.1111/jfd.12994.
Savan R,Aman A,Sakai M. 2003. Molecular cloning of G type lysozyme cDNA in common carp(Cyprinus carpio L.)[J]. Fish & Shellfish Immunology,15(3):263-268. doi:10.1016/S1050-4648(02)00159-6.
Shakoori M,Hoseinifar S H,Paknejad H,Jafari V,Safari R,van Doan H,Mozanzadeh M T. 2019. Enrichment of rainbow trout(Oncorhynchus mykiss) fingerlings diet with microbial lysozyme:Effects on growth performance,serum and skin mucus immune parameters[J]. Fish & Shellfish Immunology,86:480-485. doi:10.1016/j.fsi.2018.11. 077.
Wang M J,Zhao X L,Kong X H,Wang L,Jiao D,Zhang H X. 2016. Molecular characterization and expressing analysis of the c-type and g-type lysozymes in Qihe crucian carp Carassius auratus[J]. Fish & Shellfish Immunology,52:210-220. doi:10.1016/j.fsi.2016.03.040.
Whang I,Lee Y,Lee S,Oh M J,Jung S J,Choi C Y,Lee W S,Kim H S,Kim S J,Lee J. 2011. Characterization and expression analysis of a goose-type lysozyme from the rock bream Oplegnathus fasciatus,and antimicrobial activity of its recombinant protein[J]. Fish & Shellfish Immunology,30(2):532-542. doi:10.1016/j.fsi.2010.11.025.
Ye X,Zhang L L,Tian Y Y,Tan A P,Bai J J,Li S J. 2010. Identification and expression analysis of the g-type and c-type lysozymes in grass carp Ctenopharyngodon idellus[J]. Developmental & Comparative Immunology,34(5):501-509. doi:10.1016/j.dci.2009.12.009.
Zhang S H,Xu Q Q,Boscari E,Du H,Qi Z T,Li Y,Huang J,Di J,Yue H M,Li C J,Congiu L,Wei Q W. 2018. Cha-racterization and expression analysis of g- and c-type lysozymes in Dabry’s sturgeon(Acipenser dabryanus)[J]. Fish & Shellfish Immunology,76:260-265. doi:10.1016/j.fsi.2018.03.006.
Zhao L,Sun J S,Sun L. 2011. The g-type lysozyme of Scophthalmus maximus has a broad substrate spectrum and is involved in the immune response against bacterial infection[J]. Fish & Shellfish Immunology,30(2):630-637. doi:10.1016/j.fsi.2010.12.012.
(責任编辑 兰宗宝)

