GSDMD-N和p-MLKL蛋白在类风湿关节炎滑膜组织中上调
卢 珊,张冰清,叶菜英,朱 蕾*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 药理学系, 北京 100005;2.中国医学科学院 北京协和医学院 北京协和医院 普通内科,北京 100730)
类风湿关节炎(rheumatoid arthritis,RA)是一种以累及周围关节为主的慢性、系统性和炎症性自身免疫性疾病。慢性增生性滑膜炎是RA的基本病理改变,是导致关节破坏的重要原因,但目前发生机制尚不十分明确[1]。细胞焦亡(pyroptosis)和程序性坏死(necroptosis)是近年发现的促炎形式的程序性细胞死亡,其触发时伴有大量细胞内容物的释放,暴露的损伤相关分子模式(damage-associated molecular patterns, DAMPs)会激活机体的免疫应答,引起炎性反应[2-3]。这两种程序性细胞死亡方式被推测是机体防止病原体大量复制并扩散,从而保护机体的有效机制。但越来越多的研究表明,其失调在多种疾病中起重要作用[2-3]。因此,本研究检测了RA关节滑膜组织中细胞焦亡和程序性坏死相关蛋白的表达水平,并分析其相应的标志性蛋白GSDMD-N和p-MLKL与患者临床特征及病理滑膜炎之间的相关性,初步探索细胞焦亡和程序性坏死与RA发病的联系。
1 材料与方法
1.1 材料
1.1.1 组织样本的来源:滑膜组织取材2017年12月至2018年12月于北京协和医院行膝关节置换术的RA患者5例,骨关节炎(osteoarthritis,OA)患者5例。RA患者符合1987年美国风湿病学会(American College of Rheumatology, ACR)修订的RA分类标准或2010年ACR与欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)联合修订的RA分类标准,并排除其他自身免疫病;OA患者符合2010年ACR膝关节OA分类标准。本研究经中国医学科学院基础医学研究所伦理审查委员会批准(批准号:003-2018)。
1.1.2 临床资料的收集:记录患者的性别、年龄、红细胞沉降率(erythrocyte sedimentation rate,ESR)和超敏C反应蛋白(hypersensitive C-reactive protein,hsCRP)水平。
1.1.3 试剂:M-PER哺乳动物蛋白质抽提液、蛋白酶及磷酸酶抑制剂Cocktail和电化学发光(electrochemiluminescence,ECL)底物(Thermo Fisher Scientific公司);BCA蛋白定量试剂盒(北京普利莱基因技术有限公司);兔抗GSDMD单抗和兔抗cleaved-GSDMD单抗(Cell Signaling Technology公司);鼠抗caspase-1单抗(Adipogen公司);兔抗混合谱系激酶结构域样蛋白(mixed-lineage kinase domain-like protein,MLKL)单抗(Invitrogen公司);兔抗p-MLKL单抗(Abcam公司);羊抗兔IgG二抗和羊抗鼠IgG二抗(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 HE染色评估滑膜病理改变:按常规HE染色方法操作,并采用Krenn评分评估病理滑膜炎程度[4],包括衬里层增生、衬里下层炎性细胞浸润和基质活化3个亚分,每个亚分根据相应病理改变的轻重程度进行半定量评分(0~3分),相加为Krenn总分(0~9分)。
1.2.2 Western blot检测蛋白表达:将滑膜组织样本按质量体积比1∶7加入预冷的组织蛋白提取液(含1%蛋白酶及磷酸酶抑制剂),用匀浆机匀浆15 s,冰上静置30 min后4 ℃ 12 000 r/min离心15 min,取上清。同样条件再次离心取上清。采用BCA法检测蛋白浓度。取蛋白样品30 μg,加上样缓冲液加热变性,经SDS-PAGE电泳分离后转至PVDF膜,用含5%脱脂奶粉的TBST室温封闭1 h,然后用一抗4 ℃孵育过夜。次日TBST洗膜后室温孵育相应的二抗1 h,再次用TBST洗膜后进行ECL化学发光并拍照,用ImageJ分析各条带吸光度值。
1.3 统计学分析
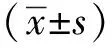
2 结果
2.1 RA组与OA组患者的临床资料
详细资料见表1。

表1 RA组与OA组患者临床资料的比较
2.2 RA和OA患者关节滑膜病理Krenn评分
与OA相比,RA的Krenn总分显著增加(P<0.05),其中衬里下层炎性细胞浸润亚分的增加最为显著(P<0.01)(图1)。
2.3 RA和OA关节滑膜组织中细胞焦亡与程序性坏死的比较
与OA滑膜组织相比,RA中pro-caspase-1的表达显著降低(P<0.01),caspase-1的表达显著升高(P<0.05);GSDMD的表达明显降低(P<0.05),而GSDMD-N的表达明显升高(P<0.05)(图2)。RA滑膜组织中p-MLKL和MLKL的表达均显著高于OA关节滑膜(P<0.05)(图3)。
2.4 细胞焦亡和程序性坏死与临床指标的相关性
GSDMD-N与ESR呈正相关(r=0.678,P<0.05),与CRP呈正相关(r=0.725,P<0.05);p-MLKL与ESR呈正相关(r=0.639,P<0.05)。
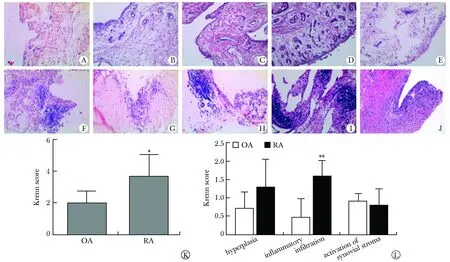
A-J.representative HE staining of synovium from OA patients No.1-5 (A-E) and RA patients No.1-5 (F-J)(×100); K.Krenn total score; L.Krenn subscore; *P<0.05,**P<0.01 compared with OA group
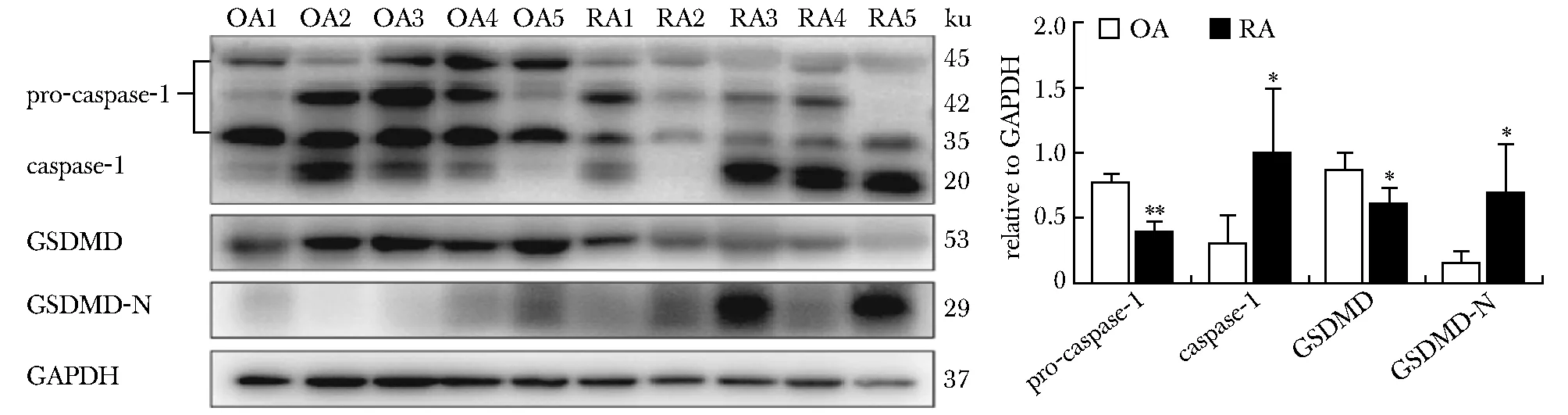
*P<0.05,**P<0.01 compared with OA group图2 RA和OA患者关节滑膜组织中细胞焦亡相关蛋白的检测Fig 2 Analysis of the related proteins of pyroptosis in synovial tissues from RA and OA patients

*P<0.05 compared with OA group图3 RA和OA患者关节滑膜组织中程序性坏死相关蛋白的检测Fig 3 Analysis of the related proteins of necroptosis in synovial tissues from OA and RA patients
2.5 GSDMD-N和p-MLKL与病理滑膜炎的相关性
GSDMD-N与Krenn总分呈正相关(r=0.680,P<0.05),与衬里下层炎性细胞浸润亚分呈正相关(r=0.784,P<0.01);p-MLKL与Krenn总分呈正相关(r=0.664,P<0.05),与衬里下层炎性细胞浸润亚分呈正相关(r=0.872,P<0.001)。
3 讨论
程序性细胞死亡包括细胞焦亡、程序性坏死、凋亡和自噬等多种细胞死亡方式[2]。其中,细胞焦亡是一种caspase家族依赖性的细胞程序性死亡。在其经典激活途径中,病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)或DAMPs活化炎性小体,使无活性的pro-caspase-1水解为有酶活性的caspase-1,活化的caspase-1将IL-1β和IL-18的前体剪切为成熟体,同时caspase-1切割GSDMD蛋白产生N端产物(GSDMD-N),后者发生寡聚化并在细胞膜上形成膜孔,使细胞肿胀破裂,释放细胞内容物和大量促炎因子,引起细胞焦亡[5-6]。关于细胞焦亡的上游通路,即炎性小体的激活可能参与RA的疾病进程已有报道。然而,RA中细胞焦亡的研究相对较少。据报道,与OA患者相比,RA患者外周血CD14+的巨噬细胞中GSDMD-N的表达明显增加,细胞呈现焦亡样改变[7]。为了明确RA关节滑膜中是否发生细胞焦亡,比较了RA和OA患者关节滑膜组织中pro-caspase-1、caspase-1、GSDMD和GSDMD-N的表达水平。结果显示,与OA相比,RA滑膜组织中pro-caspase-1的表达降低,caspase-1的表达显著升高;GSDMD的表达降低,而GSDMD-N的表达明显升高,提示,RA患者关节滑膜中可能发生细胞焦亡。进一步研究发现,细胞焦亡的标志性蛋白GSDMD-N的表达水平与临床反映RA疾病活动的ESR、CRP以及病理滑膜炎的Krenn总分、衬里下层炎性细胞浸润亚分呈显著正相关,提示RA患者关节滑膜的细胞焦亡水平在一定程度上反映了疾病活动度,并可能参与了RA滑膜炎的进程。
程序性坏死是另一种促炎形式的新的细胞程序性死亡方式,死亡细胞形态类似坏死,而其死亡过程受胞内主动机制的调节,由死亡受体介导,以caspase非依赖性方式发生[8-9]。TNF-α、Fas/CD95、LPS、干扰素、病毒DNA以及抗肿瘤药物等多种刺激可以激活死亡受体诱导程序性细胞坏死[10],其中 TNF-α诱导的途径研究最为广泛。TNF-α与TNFR1结合诱导TNFR1发生构象变化,从而募集包括受体相互作用蛋白激酶1(receptor-interacting protein kinase 1, RIPK1)在内的多种蛋白,形成复合物,并进一步形成由RIPK1、RIPK3和MLKL组成的坏死小体(necrosome),MLKL被磷酸化,p-MLKL寡聚化并转移到质膜形成孔道样结构,导致膜通透性增加,离子内流,细胞内渗透压升高,进而发生细胞死亡,细胞内容物释放,引发免疫和炎性反应[11-12]。文献报道,胶原诱导性关节炎鼠关节滑膜中p-MLKL的表达水平明显升高[13]。为进一步明确RA关节滑膜中是否发生程序性坏死,比较了RA和OA患者关节滑膜组织中MLKL和p-MLKL的表达情况。结果显示,RA关节滑膜中p-MLKL和MLKL的表达水平显著增高。而且,程序性坏死的标志性蛋白p-MLKL的表达水平与ESR、Krenn总分及衬里下层炎性细胞浸润亚分呈正相关。提示,RA患者关节滑膜中可能发生程序性坏死,且其可能参与了RA滑膜炎的病理改变。
综上,RA关节滑膜中细胞焦亡和程序性坏死均明显增强,且与疾病活动度和滑膜炎性水平呈正相关。提示,细胞焦亡和程序性坏死可能在RA滑膜炎的发病中起重要作用,这为RA的治疗提供潜在靶点。相关的体内和体外基础研究需要进一步开展以深入探讨细胞焦亡和程序性坏死在RA发病中的具体机制。

