外源5-ALA对干旱胁迫下茶树叶绿素合成和荧光特性及关键酶基因表达的影响
杨妮,李逸民,李静文,滕瑞敏,陈益,王雅慧,庄静*
外源5-ALA对干旱胁迫下茶树叶绿素合成和荧光特性及关键酶基因表达的影响
杨妮1,李逸民1,李静文1,滕瑞敏1,陈益1,王雅慧2,庄静1*
1.南京农业大学园艺学院,茶叶科学研究所,农业部华东地区园艺作物生物学与种质创制重点实验室,江苏 南京 210095;2.南京农业大学,作物遗传与种质创新国家重点实验室,江苏 南京 210095
为探究外源5-氨基乙酰丙酸(5-ALA)在茶树幼苗响应干旱胁迫时对茶树叶绿素合成和荧光特性的调控机理,以舒茶早为试验材料,PEG-6000模拟干旱胁迫环境,喷施5-ALA进行处理,检测茶树幼苗叶片的叶绿素a、叶绿素b和总叶绿素含量,进一步测定叶片叶绿素荧光参数及关键酶基因的表达。结果显示,外源5-ALA显著提高干旱胁迫下茶树叶片叶绿素a、叶绿素b、总叶绿素的含量,缓解了最大荧光()、PSⅡ实际光化学效率[()]、PSⅡ最大光化学量子产量()、光化学猝灭系数()、PSⅡ潜在活性()、PSⅡ反应中心光合电子传递效率(Electron transfer rate,)的下降,同时导致初始荧光()、非光化学猝灭系数()升高。外源5-ALA能诱导干旱胁迫下茶树编码叶绿素合成(、、)以及碳同化(、)相关酶基因的上调表达。研究表明,叶面喷施外源5-ALA能有效缓解干旱胁迫对茶树叶片叶绿素的降解及对PSⅡ反应中心的损伤,维持茶树叶片较高的光合活性,提高其光保护能力。
茶树;5-氨基乙酰丙酸;干旱胁迫;叶绿素荧光参数;基因表达
随着温室效应在全球范围内持续发生,水资源短缺、干旱、高温成为长期存在的全球性问题。干旱造成的作物损失处于非生物胁迫的首位,严重影响农业生产,制约农业发展[1]。干旱胁迫往往会导致植物新陈代谢和基因表达发生变化,影响植物的生长发育和产量[2]。如何减少干旱对作物的损害,以及如何有效提高作物用水效率已成为世界各国共同关心的问题。光合作用是植物最基本的生命活动,需要依赖叶绿体进行,叶绿素含量在一定程度上能反映植物光合性能的高低,可作为研究植物响应干旱胁迫的指标。叶绿素荧光动力学参数能够快速准确的反映植物叶片在光合作用过程中光合系统对光能的吸收、传递、耗散和分配等方面的情况[3-4],并且在测定时不需要损伤植物器官、组织或细胞,有效地保证了研究的准确性和可持续性。在植物的抗性研究中,叶绿素荧光参数能够反映胁迫对光合作用的影响,是研究植物光合能力和抗逆性的重要指标。
茶树[(L.) O.Kuntze]是多年生常绿木本作物,是我国重要的经济作物。茶树对生长环境要求较高,极端温度、干旱和高盐等非生物胁迫在其生长过程中频繁出现,严重影响了茶树的生长发育,损害茶产业的经济效益。在农业生产当中人们使用化肥、农药和植物生长调节剂等来调节作物的生长发育,以达到提高产量、改善品质、防控病虫害、提高作物抗逆能力等目的。在选择外源调节物质时,无害性和安全性是茶树首先考虑的因素。5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)是四吡咯化合物(如亚铁血红素、卟啉、叶绿素和维生素B12)共同的前体物质,也是调节四吡咯类物质生物合成的关键代谢中间物,具有调节植物生命活动的功能。5-ALA具有易降解、无残留且对人体无毒等优点,这种特性对于茶树而言十分重要。近年来的研究发现,5-ALA能够明显的提升作物光合效率[5-6],提高作物产量,通过调节作物的内含物质来改善品质[7-8],还能显著提高作物抗逆能力以抵抗逆境损伤[9-11],在提高农业生产方面具有巨大潜力。
目前外源5-ALA对茶树光合作用促进机制以及干旱胁迫对茶树光合系统的研究较少,在园艺作物领域有关5-ALA的研究也主要集中在瓜果[12-13]、蔬菜[14-16]等作物上。本研究以茶树舒茶早作为试验材料,利用5-ALA处理茶树幼苗,同时用聚乙二醇-6000(PEG-6000,Polyethylene glycol-6000)模拟干旱胁迫,观测干旱胁迫下外源5-ALA对茶树幼苗叶片叶绿素含量和叶绿素荧光参数的动态变化过程。运用荧光定量PCR技术研究叶绿素和碳同化相关基因在干旱及外源5-ALA处理下的表达模式,分析外源5-ALA对干旱胁迫下茶树光合能力的调节作用,旨在为茶树的抗旱栽培提供理论依据。
1 材料与方法
1.1 试验材料及试验设计
以两年生的茶树舒茶早(cv‘Shuchazao’)扦插幼苗为试验材料,种植于南京农业大学作物遗传与种质创新国家重点实验室植物生长室内。盆栽基质为珍珠岩、蛭石和营养土(体积比为1∶2∶3)。生长室昼夜温度为25/18℃,光照周期14/10 h·d-1、湿度(70±10)%、光强300 μmol·m-2·s-1。
选取植株健壮、无病害、无机械损伤且长势一致的茶苗进行试验。设置5-ALA浓度为50 mg·L-1,配制100 mg·mL-1PEG-6000(10%PEG)溶液模拟干旱胁迫。将茶苗分为4组处理(表1)。
先对ALA和ALA+PEG处理组茶苗连续3 d叶面喷施50 mg·L-1的5-ALA,CK和PEG处理组连续3 d叶面喷施等量蒸馏水;第4天对PEG和ALA+PEG组茶苗进行浇湿100 mg·mL-1PEG-6000溶液模拟干旱胁迫,另外两组浇湿等量蒸馏水。于PEG分别处理0、6、24 h时取健康叶片,48 h后对所有处理组浇湿等量蒸馏水,做复水处理,72 h时再次取健康叶片。所取材料均迅速放入液氮中,然后放入–80℃冰箱保存。3次生物学重复。
1.2 测定项目及方法
1.2.1 叶绿素含量的测定
采用丙酮、无水乙醇、水3种液体的混合液浸提法测定叶绿素含量[17-18]。于0、6、24、72 h取茶苗顶部第2片叶,将其剪碎,取0.10 g放入10 mL混合液(丙酮∶无水乙醇∶水=4.5∶4.5∶1.0)中,置于暗处浸提至叶片完全变白(24 h)。以混合液为对照,使用MD iD5酶标仪测定浸提液在645 nm和663 nm处的吸光值,最后计算叶绿素含量。
1.2.2 叶绿素荧光参数的测定
以PEG处理开始,于0、6、24、72 h在每组处理中选出长势较为一致的3株茶苗,将茶苗用黑色不透光塑料袋完全罩住进行30 min暗处理,然后使用德国WALZ公司生产的IMAGING-PAM调制叶绿素荧光成像系统对茶苗进行叶绿素荧光参数的测定,包括基础荧光()、最大荧光()、PSⅡ最大光化学量子产量()、PSⅡ的潜在活性()、PSⅡ实际光化学效率[]、PSⅡ反应中心光合电子传递效率(Electron transfer rate,)、光化学猝灭系数()和非光化学猝灭系数()。
1.2.3 总RNA提取和cDNA合成
叶片总RNA的提取按照北京华越洋生物科技有限公司Quick RNA Isolation Kit试剂盒说明书进行,并用上海谱元仪器有限公司NanoDrop ND 1000微量紫外检测仪测定其浓度,电泳检测其完整性。使用宝生物工程(大连)有限公司Prime Script RT Reagent Kit试剂盒合成cDNA第一链。
1.2.4 茶树叶绿素、光合作用相关基因相对表达量的测定
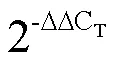
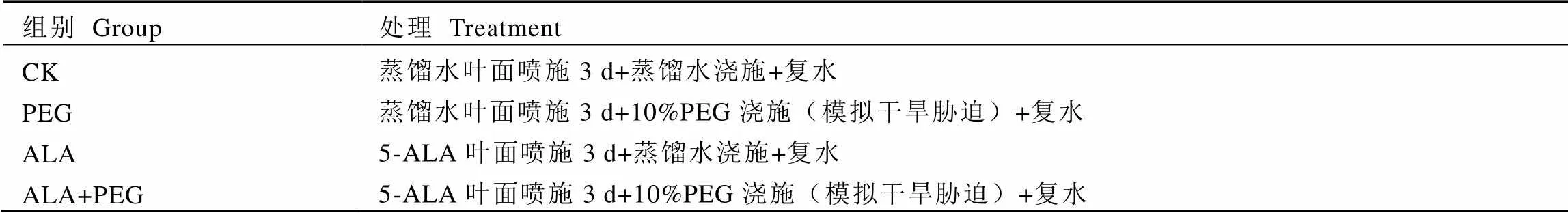
表1 茶树处理
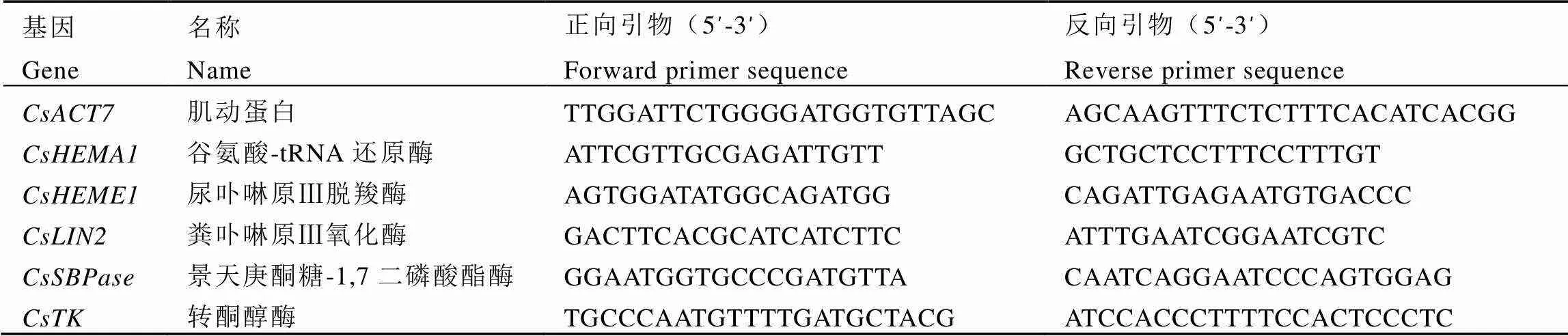
表2 RT-qPCR引物序列
1.2.5 数据处理与统计分析
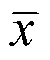
2 结果与分析
2.1 外源5-ALA对干旱胁迫下茶树叶片叶绿素含量的影响
由表3可知,PEG处理0 h时,与CK相比,ALA处理显著提高茶树的叶绿素a和总叶绿素含量,分别升高了15.18%和13.55%。
干旱胁迫6 h时,与0 h相比各组叶绿素含量都有不同程度的下降。与CK相比,PEG处理茶树叶绿素含量虽有所下降但差异不显著,ALA和ALA+PEG处理均显著提高了茶树叶绿素a、叶绿素b和总叶绿素含量。与PEG处理相比,ALA+PEG处理显著提高茶树的叶绿素a、叶绿素b和总叶绿素含量,分别提高了20.20%、24.32%、20.59%。
干旱胁迫24 h时,与6 h相比各组叶绿素含量都有不同程度的下降。与CK相比,PEG处理显著降低茶树叶绿素a、叶绿素b和总叶绿素含量,分别下降了18.87%、17.50%、18.49%;ALA处理的茶树叶绿素a和总叶绿素含量显著上升;ALA+PEG处理组茶树的叶绿素含量有所上升但差异不显著。与PEG处理相比,ALA+PEG处理显著提高茶树的叶绿素a、叶绿素b和总叶绿素含量,分别提高了25.58%、21.21%、24.37%。
与复水前相比,72 h时各组叶绿素含量都有所上升,说明及时复水有利于茶树叶绿素含量的恢复。与CK相比,PEG处理显著降低茶树的叶绿素a、叶绿素b和总叶绿素含量,分别下降了24.59%、23.08%、24.22%;ALA和ALA+PEG处理组茶树叶绿素b含量分别显著上升了12.82%、10.27%,叶绿素a和总叶绿素含量升高但差异不显著。与PEG处理相比,ALA+PEG处理显著提高茶树的叶绿素a、叶绿素b和总叶绿素含量,分别提高了38.04%、43.33%、39.34%。
2.2 外源5-ALA对干旱胁迫下茶树叶片Fo、Fm、Fv/Fm和Fv/Fo的影响
由表4可知,PEG处理0 h时,与CK相比,ALA处理组茶树的、、和有所上升但差异不显著。
干旱胁迫6 h时,与CK相比,PEG处理组茶树的显著升高,、和显著下降;ALA和ALA+PEG处理的茶树叶绿素荧光参数与CK相比差异不显著。与PEG处理相比,ALA+PEG处理组茶树的显著下降了25.00%,、和分别显著升高了11.11%、10.39%、63.96%。
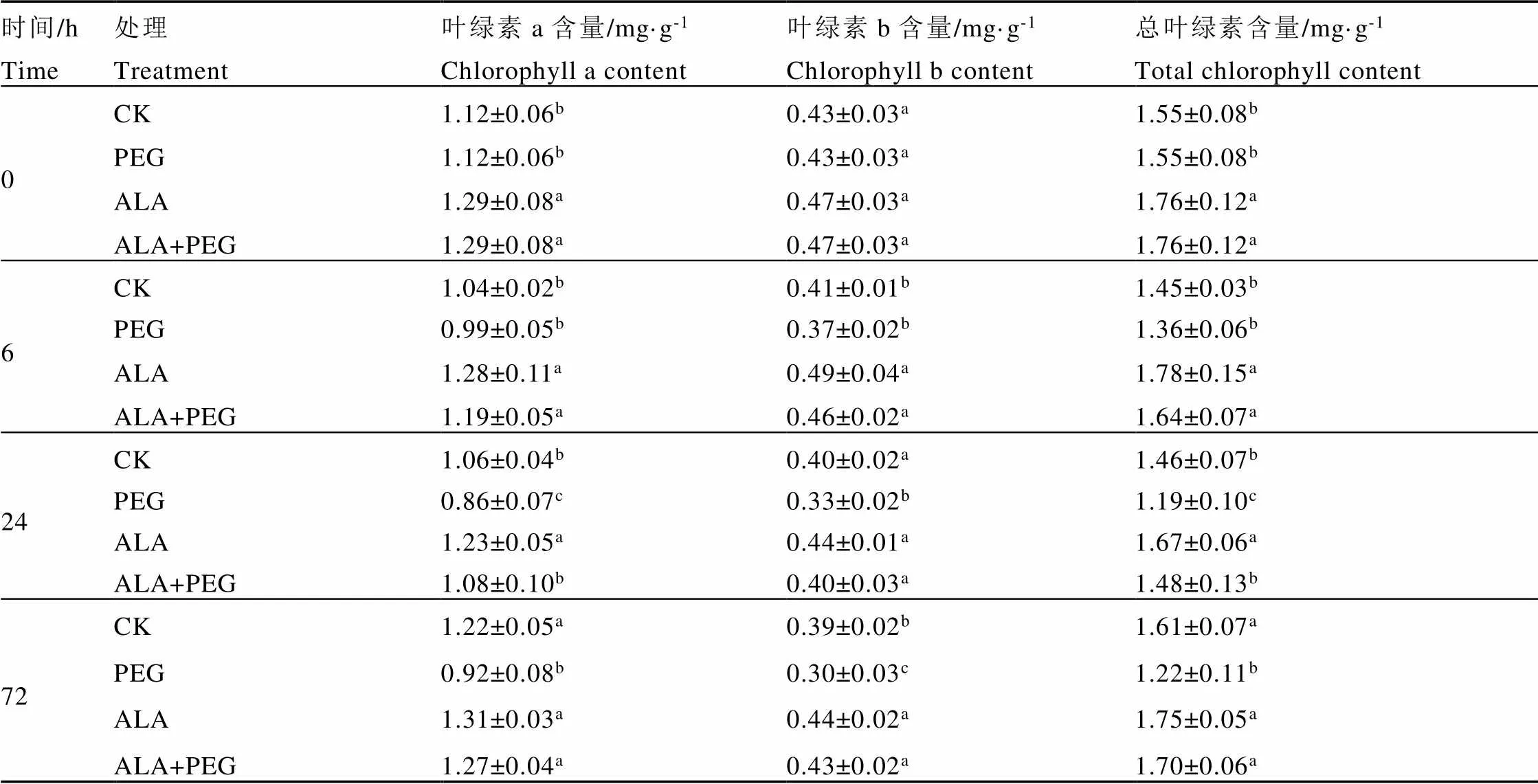
表3 外源5-ALA对干旱胁迫下茶树叶片叶绿素a和叶绿素b以及总叶绿素含量的影响
注:同一列中不同小写字母表示在0.05水平有显著差异,下同
Note: Different lowercase letters in the same column group mean significant difference at 0.05 level.The same below
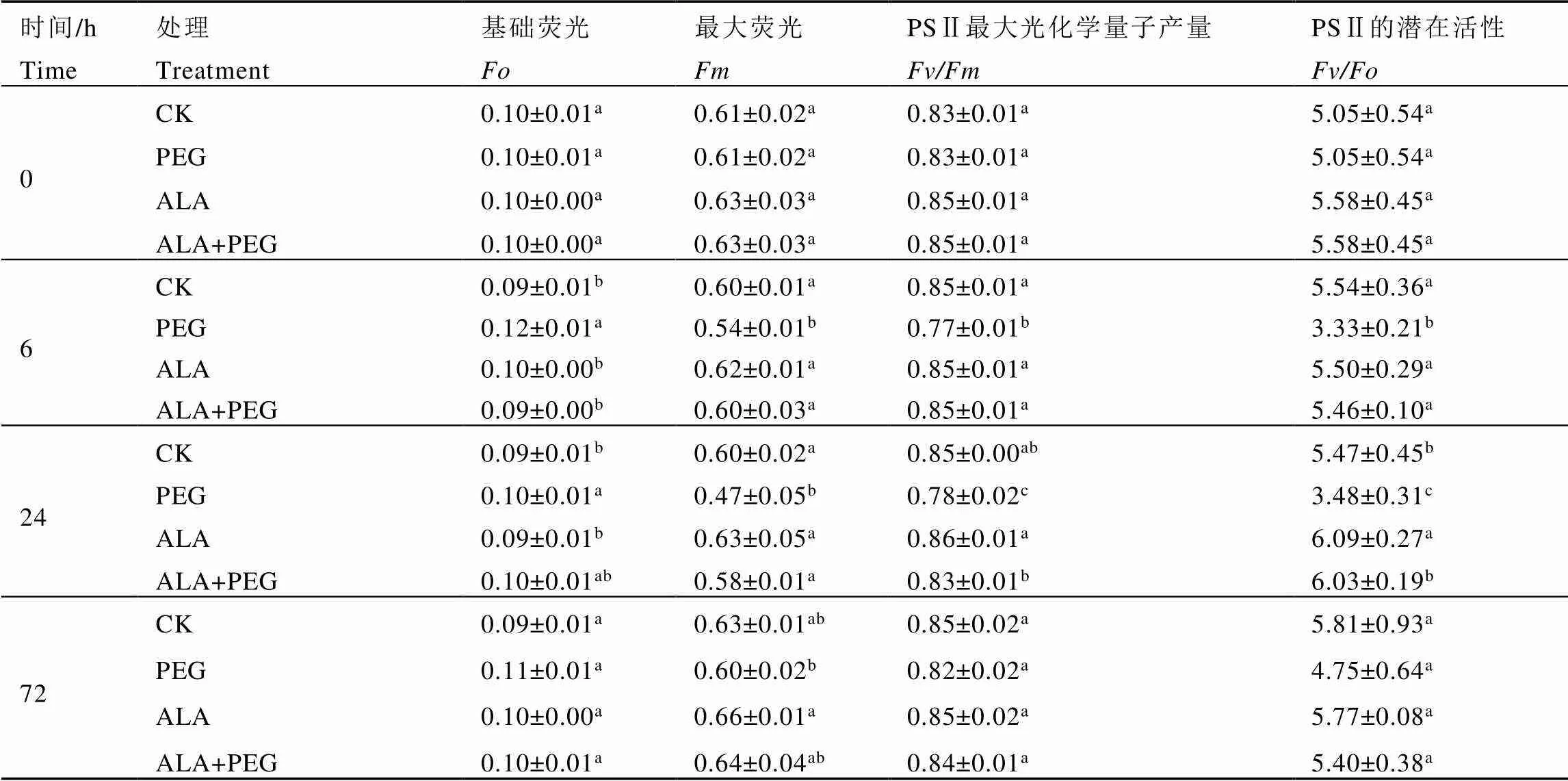
表4 外源5-ALA对干旱胁迫下茶树叶片Fo、Fm、Fv/Fm和Fv/Fo的影响
干旱胁迫24 h时,与CK相比,PEG处理组茶树的显著升高了11.11%,、和分别显著下降了21.67%、8.24%、36.38%;ALA处理组茶树的显著升高了11.33%,其他参数差异不显著;ALA+PEG处理组茶树的叶绿素荧光参数差异不显著。与PEG处理相比,ALA+PEG处理组茶树的有所上升但差异不显著,、和分别显著升高了23.40%、6.41%和73.28%。
干旱胁迫48 h后复水,72 h时测量叶绿素荧光参数,研究喷施5-ALA和模拟干旱胁迫后,复水对茶树光合系统的恢复效果。与复水前相比,PEG和ALA+PEG处理的茶树有所恢复;与CK相比,PEG处理茶树的上升,、和下降,但差异都不显著;ALA和ALA+PEG处理茶树的叶绿素荧光参数与CK相比差异不显著。与PEG处理相比,ALA+PEG处理茶树的下降,、和上升,差异都不显著。
2.3 外源5-ALA对干旱胁迫下茶树叶片Y(Ⅱ)、ETR、qP和qN的影响
由表5可知,PEG处理0 h时,与CK相比,ALA处理茶树的、、和有所升高但差异不显著。
干旱胁迫6 h时,与CK相比,PEG处理茶树的、和分别显著下降了48.28%、47.54%、30.91%,显著升高了5.00%;ALA和ALA+PEG处理茶树的叶绿素荧光参数与CK相比差异不显著。与PEG处理相比,ALA+PEG处理茶树的、和分别显著升高了80.00%、73.93%、39.47%,有所下降但差异不显著。
干旱胁迫24 h时,与CK相比,PEG处理茶树的、和分别显著下降了33.33%、33.45%、12.96%,也有所下降但差异不显著;ALA处理茶树叶绿素荧光参数与CK相比差异不显著。与PEG处理相比,ALA+PEG处理茶树的显著升高了4.76%,其他叶绿素荧光参数有所上升但差异不显著。
干旱胁迫48 h后复水,72 h时测量叶绿素荧光参数,研究喷施5-ALA和模拟干旱胁迫后,复水对茶树光合系统的恢复效果。与复水前相比,PEG和ALA+PEG处理的茶树有所恢复,与CK相比,PEG处理的茶树叶绿素荧光参数仍有所下降但差异不显著,ALA处理叶绿素荧光参数与CK相比差异不显著,ALA+PEG处理茶树显著升高了6.02%,其他参数差异不显著。与PEG处理相比,ALA+PEG处理茶树的、下降,和升高,但差异不显著。
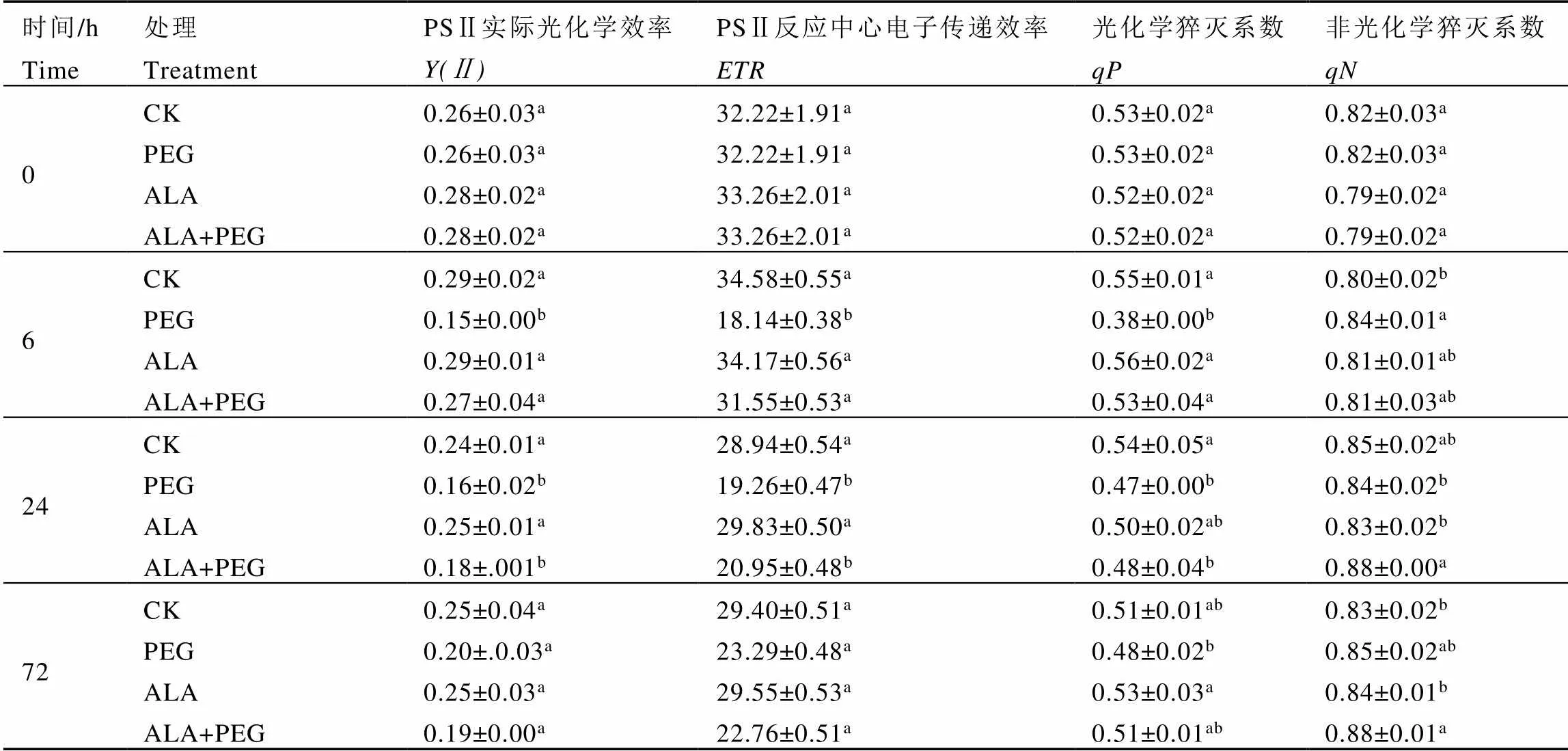
表5 外源5-ALA对干旱胁迫下茶树Y(Ⅱ)、ETR、qP和qN的影响
2.4 外源5-ALA对干旱胁迫下茶树叶绿素合成基因表达量的影响
由图1可知,PEG处理0 h时,与CK相比,ALA处理显著上调、、、、的表达,分别上调了213.59%、8.00%、71.29%、47.00%、18.00%。
干旱胁迫6 h时,与CK相比,PEG处理显著下调、、、的表达;ALA处理显著上调、、、、的表达;ALA+PEG处理显著上调、、的表达。与PEG处理相比,ALA+PEG处理显著上调、、、的表达,分别上调了75.00%、184.38%、40.48%、83.64%。
干旱胁迫24 h时,与CK相比,PEG处理显著下调、、、的表达,分别下调了35.85%、23.64%、16.00%、15.12%;ALA处理显著上调、、、的表达,的表达量有所上调但差异不显著;ALA+PEG处理显著上调、的表达,显著下调、的表达。与PEG处理相比,ALA+PEG处理显著上调、、、、的表达。
干旱胁迫48 h后复水,72 h时,与CK相比,PEG处理显著下调、、、、的表达,分别下调了43.45%、28.89%、58.02%、20.59%、31.90%;ALA处理显著上调、、的表达,分别上调了12.59%、138.27%、10.78%,的表达量差异不显著;ALA+PEG处理显著下调、、的表达,分别下调了24.83%、13.33%、22.41%,表达量有所上调但差异不显著,显著上调了130.86%。与PEG处理相比,ALA+PEG处理显著上调、、、、的表达,分别上调了32.93%、42.71%、450.00%、11.11%、13.92%。
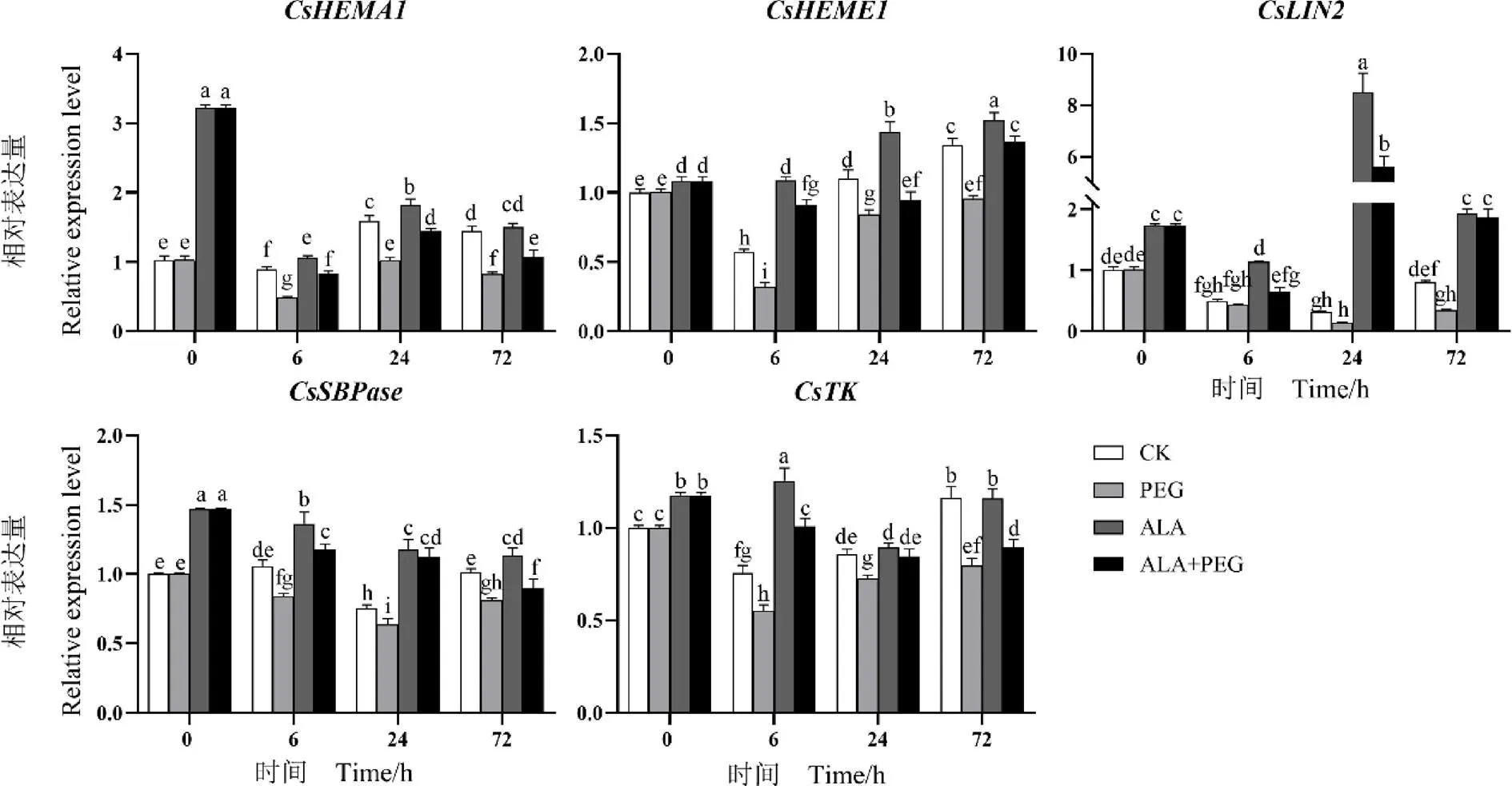
注:不同小写字母表示在0.05水平有显著差异
3 讨论
叶绿素对植物光合作用过程中光能的传递、分配和转化具有极其重要的作用,光合生物的光合速率和有机物的积累速率都与光合作用组织中叶绿素含量密切相关[22]。已有众多研究表明,外源5-ALA可提高非生物胁迫下植物叶片内叶绿素含量[23-27]。本研究中,PEG处理可明显降低茶树幼苗叶片内叶绿素a、叶绿素b和总叶绿素含量,并且随着干旱时间的延长,胁迫程度加深,叶绿素含量逐渐降低,表明PEG处理影响了茶树叶绿素合成的同时加速了已形成叶绿素的降解,这与符姿[28]发现干旱胁迫显著降低了茶树叶片叶绿素含量的研究结果相一致,也与Neisiani等[29]的研究结论相似。外源5-ALA的喷施显著提高干旱胁迫下茶树叶片叶绿素a、叶绿素b和总叶绿素含量,表明外源5-ALA可以提高茶树的光合能力,这可能是由于5-ALA是叶绿素合成的前体,可激发叶绿素合成途径一系列催化酶活性,加快叶绿素的合成,与牛奎举[6]在草地早熟禾叶片和Song等[30]在羊草上的研究结果较为一致。复水后,各处理茶树的叶绿素a、叶绿素b和总叶绿素含量都有所回升,说明轻度的干旱并没有使茶树叶片光合系统严重损坏,当茶树受到干旱胁迫时,及时补水可以使树体有所恢复,这对茶园的旱灾恢复具有指导意义。
干旱胁迫会从多个方面影响植物的光合能力,主要包括损伤光合系统的各种机构、影响光合作用中电子的传递和光合磷酸化,以及对参与暗反应有关的酶造成影响[31]。近年来,在植物领域,越来越多的学者通过利用叶绿素荧光动力学的方法对植物进行快速、灵敏、无损伤的探测,研究干旱胁迫对植物光合作用的影响[32-33]。叶绿体光系统Ⅱ(PSⅡ)反应中心处于完全开放时的荧光产量通常用o来表示[34-35],一般与叶绿素含量有关,而当反应中心出现不易逆转的破坏或失活时,通常会表现出增加的趋势[36]。植物PSⅡ反应中心处于完全关闭时的荧光产量用最大荧光表示,它能够反映出通过PSⅡ的电子传递情况[37-38]。和o分别代表PSⅡ原初光能转化效率和PSⅡ的潜在活性[31];非环境胁迫条件下叶片的荧光参数较为稳定,这一特性不会因为物种和生长条件而改变[39]。本研究中,与CK相比,PEG处理后茶树的明显升高,明显下降,说明干旱胁迫给茶树的光合机构造成了一定程度的破坏,限制了PSⅡ的电子传递,抑制了PSⅡ的光化学活性。同时,PEG处理后茶树的和明显低于CK,说明干旱胁迫由于造成叶绿素的降解导致茶树捕获光能的效率变低,进而降低了PSⅡ的原初光能转化效率及潜在活性。经5-ALA预处理的茶树与CK相比,也有所增加,可能与5-ALA促进了叶绿素合成提高其浓度有关。经5-ALA预处理的茶树在遭受干旱胁迫时其的增加程度明显低于未处理茶树,并且最大荧光显著升高,说明5-ALA对茶树光系统Ⅱ(PSⅡ)具有保护作用,能够缓解干旱对PSⅡ反应中心活性的降低,提升PSⅡ的光化学活性,这与邓哲[40]和康博文等[41]的研究相似。此时,茶树的和也明显升高,说明5-ALA可以有效抵御干旱胁迫对茶树PSⅡ反应中心的伤害,使PSⅡ天线色素吸收的能量更多地流向光化学部分,减少以荧光形式散失的能量,从而使茶树在干旱胁迫条件下保持较高的光化学效率,有利于光合作用进行,5-ALA对茶树光合机构有明显的保护作用,这与卢克欢等[13]的研究相似。复水后,各组茶树的和有所上升,这可能与茶树叶绿素含量的回升有关。PEG处理茶树的和有所回升,说明虽然干旱胁迫导致茶树显著下降,但是这种影响可以通过复水来消除,这可能与细胞吸水恢复正常生命活动有关,与李晓梅等[42]的研究结果一致。
PSⅡ实际光化学效率[]代表反映机构目前实际的光能转换效率。植物吸收的光能有3个去向,分别是进行光合作用、热耗散和荧光。反映了植物光合作用的高低,主要代表的是质体醌QA氧化还原状态和PSⅡ反应中心的开放程度,通常情况下,增加主要是由QA电子传递能力增加引起的,而当植物遭受到干旱胁迫时,其会受到胁迫的抑制而降低[43-44]。反映了植物耗散过剩光能为热的能力,即光保护能力。代表PSⅡ反应中心电子传递效率,与光合速率有较强的线性关系。本研究结果表明,与CK相比,干旱胁迫下茶树叶片的()、、受到显著抑制,推测可能与PSⅡ的光损伤有关,尤其的降低可能是损害了PSⅡ氧化侧的放氧复合体的功能,减少了向PSⅡ反应中心提供电子的数目。外源5-ALA在一定程度上缓解干旱胁迫导致的()、、降低,更高的表明外源的5-ALA预处理可减少干旱胁迫对PSⅡ反应中心的损伤,维持电子供体和受体之间电子传递的速率,阻止QA的过度还原。外源5-ALA使干旱胁迫下茶树叶片维持较高的,说明5-ALA也能缓解茶树光合作用的下降,这可能与外源5-ALA诱导了干旱胁迫下茶树叶片内编码与电子传递速率相关基因的上调表达有关。当植物遭受到干旱胁迫时,吸收过剩的光能必须通过热耗散的形式来阻止光合作用器官的光损伤。干旱胁迫下,茶树叶片的显著高于CK,说明干旱导致茶树光合器官过剩光能增加,而为了避免QA的过度还原,茶树会增加来进行热耗散,从而提高光保护能力。外源5-ALA可以提高茶树的(),在干旱进行到6 h时达到最大,而在干旱进行到24 h时也显著提高,说明外源5-ALA能够提高茶树的光保护能力,但是响应速度慢于提升茶树光化学效率,可能是通过促进光化学反应来实现的,并非促进非光化学猝灭,这与王嘉楠等[5]的研究相似。总的来说,5-ALA可以通过提高光能捕获与转化效率,促进光合作用来缓解干旱胁迫对茶树PSⅡ反应中心的损伤,从而提高茶树对干旱胁迫的耐受性。复水后,遭受干旱胁迫的茶树各项指标都有所回升,说明干旱胁迫虽然对茶树叶片PSⅡ反应中心造成一定的损伤,抑制PSⅡ反应中心的光化学活性和电子传递效率,进而破坏了茶树光合作用的原初反应过程,但是这种破坏是可以通过复水来弥补的,这与张玉玉等[45]和未晓巍等[46]的研究相似。
高等植物的叶绿素生物合成过程十分复杂,由-谷氨酰-tRNA到叶绿素a和叶绿素b共有15个步骤,涉及15种酶催化反应[47]。植物体内ALA的合成是四吡咯物质合成途径的限速步骤,决定了叶绿素合成途径的总流量,它是由谷氨酰-tRNA原酶(GluTR)和谷氨酸酯-1-半醛2,1氨基变位酶(GSA-AM)催化合成,其中由HEMA基因编码的GluTR对ALA的合成起关键作用[48]。光合碳同化中的SBPase参与RuBP的再生[49]。TK在植物叶绿体的内囊体膜上[50],参与光合作用中碳的固定,TK在卡尔文循环当中催化可逆反应,被称为“非调控酶”[51],研究表明TK的活性通常与光合碳流量密切相关[52-53],当TK活性降低时,植物光合速率显著降低,植物生长受到抑制[54-55]。本研究中叶绿素合成和碳同化相关基因的表达分析表明,PEG处理下调、、、和基因的表达,而外源5-ALA能够显著上调这5个基因的表达,5-ALA预处理的茶树在干旱胁迫下的基因表达水平显著高于未处理茶树,说明5-ALA可能从转录水平上调控茶树叶片叶绿素合成和碳同化相关酶基因表达,促进叶绿素合成,加速光合器官碳同化进程,提高干旱胁迫下茶树保持光合水平的能力。
综上所述,干旱胁迫下,外源施用5-ALA能显著提高茶树叶片的叶绿素含量,有效缓解、、、、、的下降以及、的升高,有效提高茶树对干旱胁迫的耐受性,其机制可能是外源5-ALA能够通过缓解干旱胁迫对茶树幼苗光合机构的破坏和对电子传递的抑制,提高自身对干旱的耐性,维持光合能量耗散方式的平衡。同时,外源5-ALA可能通过调控茶树叶片叶绿素合成和碳同化相关酶基因的表达,从转录水平上缓解干旱胁迫对茶树叶片叶绿素的降解以及对PSⅡ反应中心的损伤,维持茶树叶片较高的光合活性,提高茶树的光保护能力,但其在茶树生理调控过程中具体机理还待进一步探究。
[1] 张士功, 刘国栋, 刘更另.植物营养与作物抗旱性[J].植物学报, 2001, 18(1): 64-69.
Zhang S G, Liu G D, Liu G L.Plant nutrition and drought resistance of crops [J].Chinese Bulletin of Botany, 2001, 18(1): 64-69.
[2] 张云华, 张宽朝, 阮龙, 等.植物干旱适应的研究进展[J].安徽农业科学, 2005, 33(8): 1480-1481.
Zhang Y H, Zhang K C, Ruan L, et al.Research progress of plant adaptation to drought [J].Journal of Anhui Agricultural Sciences, 2005, 33(8): 1480-1481.
[3] 戴云玲, 许春辉, 赵福洪, 等.冷冻温度对冬小麦叶绿素a荧光诱导动力学和光化学活性的影响[J].生物物理学报, 1988, 4(2): 104-109, 169.
Dai Y L, Xu C H, Zhao F H, et al.The effects of freezing temperature on chlorophyll a fluorescence induction kinetics and photochemical activities of winter wheat [J].Acta Biophysica Sinica, 1988, 4(2): 104-109, 169.
[4] 许大全, 张玉忠, 张荣铣.植物光合作用的光抑制[J].植物生理学通讯, 1992, 28(4): 237-243.
Xu D Q, Zhang Y Z, Zhang R X.Photoinhibition of photosynthesis in plants [J].Plant Physiology Communications, 1992, 28(4): 237-243.
[5] 王嘉楠, 李小艳, 魏石美, 等.5-ALA对干旱胁迫下小麦幼苗光合作用及D1蛋白的调节作用[J].作物杂志, 2018(5): 121-126.
Wang J N, Li X Y, Wei S M, et al.Regulation of exogenous 5-aminolevulinicacid on photosynthesis and d1 protein of wheat seedlings under drought stress [J].Crops, 2018(5): 121-126.
[6] 牛奎举.外源5-氨基乙酰丙酸对干旱胁迫下草地早熟禾光合作用的调控机制[D].兰州: 甘肃农业大学, 2018.
Niu K J.The role of 5-aminolevulinic acid on regulation mechanism of photosynthesis in Kentucky bluegrass seedlings under drought stress [D].Lanzhou: Gansu Agricultural University, 2018.
[7] 张晓宏, 郭刚, 王著龙, 等.外源5-氨基乙酰丙酸对加工番茄叶光合色素及果实产量品质的影响[J].新疆农业科学, 2018, 55(8): 1436-1443.
Zhang X H, Guo G, Wang Z L, et al.Effect of foliar application 5-aminolevulinic acid on photosynthetic pigment and yield and quality of processing tomato in fields [J].Xinjiang Agricultural Sciences, 2018, 55(8): 1436-1443.
[8] 刘晶晶, 孙军利, 赵宝龙, 等.外源ALA对克瑞森无核葡萄果实品质的影响[J].新疆农业科学, 2019, 56(5): 817-825.
Liu J J, Sun J L, Zhao B L, et al.Effect of exogenous ALA on fruit quality of crimson seedless grape [J].Xinjiang Agricultural Sciences, 2019, 56(5): 817-825.
[9] 张群珧.外源5-氨基乙酰丙酸对假俭草抗旱性的影响[D].广州: 仲恺农业工程学院, 2019.
Zhang Q Y.Effects of exogenous 5-aminolevulinic acid on drought resistance of[D].Guangzhou: Zhongkai University of Agriculture and Engineering, 2019.
[10] 闫永庆, 季绍旭, 王贺, 等.外源ALA对盐胁迫下西伯利亚白刺光合作用的影响[J].东北农业大学学报, 2020, 51(8): 32-38.
Yan Y Q, Ji S X, Wang H, et al.Effect of exogenous ALA on photosynthesis ofPall.during salt stress [J].Journal of Northeast Agricultural University, 2020, 51(8): 32-38.
[11] 卢克欢, 郭双, 韦悦, 等.外源性5-氨基乙酰丙酸对盐胁迫下颠茄生理特性及次生代谢产物含量的影响[J].西南大学学报(自然科学版), 2018, 40(9): 13-20.
Lu K H, Guo S, Wei Y, et al.Effect of exogenous 5-Aminolevulinic acid on physiological characteristics and secondary metabolite contents ofL.seedings under NaCl stress[J].Journal of Southwest University (Natural Science Edition), 2018, 40(9): 13-20.
[12] 汪良驹, 张志平, 王中华, 等.5-氨基乙酰丙酸提高苹果等果品品质应用技术[Z].(2012-08-10).
Wang L J, Zhang Z P, Wang Z H, et al.Application technology of 5-aminolevulinic acid to improve the quality of apple and other fruits [Z].(2012-08-10).
[13] 赵雪.外源5-氨基乙酰丙酸促进苹果叶片气孔开放机理[J].中国果业信息, 2014, 31(12): 65.
Zhao X.Mechanism of exogenous 5-aminolevulinic acid promoting stomatal opening in apple leaves [J].China Fruit News, 2014, 31(12): 65.
[14] 范夕玲, 杨亚苓, 任健, 等.外源5-氨基乙酰丙酸对盐胁迫下花椰菜幼苗生理特性的影响[J].天津农业科学, 2019, 25(12): 1-4.
Fan X L, Yang Y L, Ren J, et al.Effects of exogenous 5-aminolevulinic acid on physiological characteristics of cauliflower seedlings under salt stress [J].Tianjin Agricultural Sciences, 2019, 25(12): 1-4.
[15] 邓硕真, 刘惠军, 王洪芹, 等.外源5-氨基乙酰丙酸对干旱胁迫下黄瓜种子萌发及幼苗生长的影响[J].湖北农业科学, 2021, 60(3): 70-74, 78.
Deng S Z, Liu H J, Wang H Q, et al.Effects of exogenous 5-aminolevulinic acid on seed germination and seedling growth of cucumber under drought stress [J].Hubei Agricultural Sciences, 2021, 60(3): 70-74, 78.
[16] 徐刚, 刘涛, 高文瑞, 等.5-氨基乙酰丙酸对蔬菜生理作用的研究进展[J].金陵科技学院学报, 2010, 26(4): 52-57.
Xu G, Liu T, Gao W R, et al.Physiological effects of 5-aminolevulinic acid (ALA) on vegetables [J].Journal of Jinling Institute of Technology, 2010, 26(4): 52-57.
[17] 向芬, 李维, 刘红艳, 等.茶树叶绿素测定方法的比较研究[J].茶叶通讯, 2016, 43(4): 37-40.
Xiang F, Li W, Liu H Y, et al.Comparison methods of chlorophyll extraction in[J].Journal of Tea Communication, 2016, 43(4): 37-40.
[18] 杨妮, 万绮雯, 李逸民, 等.外源亚精胺对盐胁迫下茶树光合特性及关键酶基因表达的影响[J].园艺学报, 2022, 49(2): 378-394.
Yang N, Wan Q W, Li Y M, et al.Effects of exogenous spermidine on photosynthetic characteristics and gene expression of key enzymes under salt stress in tea plant [J].Acta Horticulturae Sinica, 2022, 49(2): 378-394.
[19] Yu X L, Hu S, He C, et al.Chlorophyll metabolism in postharvest tea (L.) Leaves: variations in color values, chlorophyll derivatives, and gene expression levels under different withering treatments [J].Journal of Agricultural and Food Chemistry, 2019, 67(38): 10624-10636.
[20] Wu Z J, Tian C, Jiang Q, et al.Selection of suitable reference genes for qRT-PCR normalization during leaf development and hormonal stimuli in tea plant () [J].Scientific Reports, 2016, 6: 19748.doi: 10.1038/srep19748.
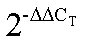
[22] Katz J J, Norris J R, Shipman L L, et al.Chlorophyll function in the photosynthetic reaction center [J].Annual Review of Biophysics & Bioengineering, 1978, 7(1): 393-434.
[23] Naeem M S, Jin Z L, Wan G L, et al.5-Aminolevulinic acid improves photosynthetic gas exchange capacity and ion uptake under salinity stress in oilseed rape (L.) [J].Plant and Soil, 2010, 332: 405-415.
[24] Memon S A, Hou X, Wang L, et al.Promotive effect of 5-aminolevulinic acid on chlorophyll, antioxidative enzymes and photosynthesis of Pakchoi (ssp.chinensis var.communis Tsen et Lee) [J].Acta Physiol Plant, 2009, 31: 51.doi: 10.1007/s11738-008-0198-7.
[25] Liu L, Nguyen N T, Ueda A, et al.Effects of 5-aminolevulinic acid on Swiss chard (L.subsp.cicla) seedling growth under saline conditions [J].Plant Growth Regulation, 2014, 74(3): 219-228.
[26] Karina B B, María L T, Alcira B, et al.The role of 5-aminolevulinic acid in the response to cold stress in soybean plants [J].Phytochemistry, 2010, 71(17/18): 2038-2045.
[27] Liang J W, Wei B J, Bao J H.Promotion of 5-aminolevulinic acid on photosynthesis of melon () seedlings under low light and chilling stress conditions [J].Physiologia Plantarum, 2010, 121(2): 258-264.
[28] 符姿.外源H2S对干旱胁迫下茶树种子萌发及幼苗生理特性的影响[D].合肥: 安徽农业大学, 2018.
Fu Z.Effects of exogenous hydrogen sulfide on seeds germination and seedlings physiological characteristics of tea () under drought stress [D].Hefei: Anhui Agricultural University, 2018.
[29] Neisiani F F, Sanavy S A M M, Faezeh G, et al.Effect of foliar application of pyridoxine on antioxidant enzyme activity, proline accumulation and lipid peroxidation of maize (L.) under water deficit [J].Not Bot Horti Agrobo, 2009, 37(1): 116-121.
[30] Song J X, Anjum S A, Zong X F, et al.Combined foliar application of nutrients and 5-aminolevulinic acid (ALA) improved drought tolerance inby modulating its morpho-physiological characteristics [J].Crop and Pasture Science, 2017, 68(5): 474-482.
[31] 鲁松.叶绿素荧光动力学在植物抗逆性研究中的应用[J].四川林业科技, 2013, 34(4): 69-71.
Lu S.Application of chlorophyll fluorescence kinetics in researches on plant stress resistance [J].Journal of Sichuan Forestry Science and Technology, 2013, 34(4): 69-71.
[32] 刘志梅, 蒋文伟, 杨广远, 等.干旱胁迫对3种金银花叶绿素荧光参数的影响[J].浙江农林大学学报, 2012, 29(4): 533-539.
Liu Z M, Jiang W W, Yang G Y, et al.Chlorophyll fluorescence parameters under drought stress in three plants of[J].Journal of Zhejiang A & F University, 2012, 29(4): 533-539.
[33] 张春平, 周慧, 何平, 等.外源5-氨基乙酰丙酸对盐胁迫下黄连幼苗光合参数及其叶绿素荧光特性的影响[J].西北植物学报, 2014, 34(12): 2515-2524.
Zhang C P, Zhou H, He P, et al.Effect of exogenous 5-aminolevulinic acid on photosynthesis and chlorophyll fluorescence characteristic ofFranch.seedlings under NaCl stress [J].Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(12): 2515-2524.
[34] 张洁, 丁志强, 李俊红, 等.水肥对大豆叶绿素荧光动力学参数及其产量的影响[J].土壤与作物, 2013, 2(3): 122-126.
Zhang J, Ding Z Q, Li J H, et al.Effect of water and fertilizer coupling on chlorophyll fluorescence characters and yield in soybean [J].Soils and Crops, 2013, 2(3): 122-126.
[35] 谢鑫, 王俊玲, 段立肖, 等.光质对番茄叶片叶绿素荧光动力学参数的影响[J].河北农业大学学报, 2013, 36(6): 48-51, 88.
Xie X, Wang J L, Duan L X, et al.Effects of light quality on chlorophyll fluorescence kinetics parameters of tomato leaves [J].Journal of Hebei Agricultural University, 2013, 36(6): 48-51, 88.
[36] 武海, 许大全.珊瑚树叶片叶绿素荧光非光化学猝灭的日变化和季节变化[J].植物生理学报, 1997, 23(2): 145-150.
Wu H, Xu D Q.Diurnal and seasonal variations of non-photochemical quenching of chlorophyll fluorescence in sweet viburnum leaves [J].Physiology and Molecular Biology of Plants, 1997, 23(2): 145-150.
[37] 徐盼盼.红富士苹果虎皮病发生与叶绿素荧光参数关系的研究[J].现代农业科技, 2018(19): 267-269.
Xu P P.Study on the relationship between the occurrence of tiger skin disease and chlorophyll fluorescence parameters of apple [J].Modern Agricultural Science and Technology, 2018(19): 267-269.
[38] 李治鑫, 李鑫, 范利超, 等.高温胁迫对茶树叶片光合系统的影响[J].茶叶科学, 2015, 35(5): 415-422.
Li Z X, Li X, Fan L C, et al.Effect of heat stress on the photosynthesis system of tea leaves [J].Journal of Tea Science, 2015, 35(5): 415-422.
[39] 赵丽英, 邓西平, 山仑.渗透胁迫对小麦幼苗叶绿素荧光参数的影响[J].应用生态学报, 2005, 16(7): 1261-1264.
Zhao L P, Deng X P, Shan L.Effects of osmotic stress on chlorophyll fluorescence parameters of wheat seedling [J].Chinese Journal of Applied Ecology, 2005, 16(7): 1261-1264.
[40] 邓哲.5-ALA对太行红豆杉和南方红豆杉生长,光合及黄酮和多糖影响的比较研究[D].新乡: 河南科技学院, 2020.
Deng Z.Comparative study on the effects of 5-ala on growth, photosynthesis, flavonoids and polysaccharides of Taihang taxus and taxus chinensis [D].Xinxiang: Henan Institute of Science and Technology, 2020.
[41] 康博文, 李文华, 刘建军, 等.ALA对红掌叶片光合作用及叶绿素荧光参数的影响[J].西北农林科技大学学报(自然科学版), 2009, 37(4): 97-102.
Kang B W, Li W H, Liu J J, et al.Effects of ALA treatment on photosynthetic and chlorophyII fluorescence dynamics of[J].Journal of Northwest A & F University (Natural Science Edition), 2009, 37(4): 97-102.
[42] 李晓梅, 盛积贵.干旱和复水对2种辣椒叶绿素荧光参数的影响[J].西南农业学报, 2016, 29(11): 2567-2572.
Li X M, Sheng J G.Effect of drought stress and rehydration on chlorophyll fluorescence characteristics of two species of capsicum [J].Southwest China Journal of Agricultural Sciences, 2016, 29(11): 2567-2572.
[43] Ramalho J C, Zlatev Z S, Leitão A E, et al.Moderate water stress causes different stomatal and non-stomatal changes in the photosynthetic functioning ofL.genotypes [J].Plant Biology, 2014, 16(1): 133-146.
[44] Lu C, Qiu N, Wang B, et al.Salinity treatment shows no effects on photosystemII photochemistry, but increases the resistance of photosystem II to heat stress in halophyte[J].Journal of Experimental Botany, 2003(383): 851-860.
[45] 张玉玉, 王进鑫, 马戌, 等.土壤干旱及复水对侧柏叶绿素荧光参数的影响[J].水土保持研究, 2021, 28(2): 242-247, 255.
Zhang Y Y, Wang J X, Ma X, et al.Effects of drought and rewatering on chlorophyll fluorescence parameters of[J].Research of Soil and Water Conservation, 2021, 28(2): 242-247, 255.
[46] 未晓巍, 张祖衔, 谈韫, 等.玉米毛状根再生植株光系统Ⅱ对干旱胁迫和复水处理的不同响应[J].吉林师范大学学报(自然科学版), 2020, 41(4): 86-92.
Wei X W, Zhang Z X, Tan Y, et al.Response of photosystem II of maize regenerative plants from hairy root under drought stress and re-watering [J].Journal of Jilin Normal University (Natural Science Edition), 2020, 41(4): 86-92.
[47] 李佳佳, 于旭东, 蔡泽坪, 等.高等植物叶绿素生物合成研究进展[J].分子植物育种, 2019, 17(18): 6013-6019.
Li J J, Yu X D, Cai Z P, et al.An overview of chlorophyll biosynthesis in higher plants [J].Molecular Plant Breeding, 2019, 17(18): 6013-6019.
[48] 王平荣, 张帆涛, 高家旭, 等.高等植物叶绿素生物合成的研究进展[J].西北植物学报, 2009, 29(3): 629-636.
Wang P R, Zhang F T, Gao J X, et al.An overview of chlorophyll biosynthesis in higher plants [J].Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(3): 629-636.
[49] 何晓玲.外源硒对NaCl胁迫下加工番茄幼苗光合碳同化的影响[D].石河子: 石河子大学, 2015.
He X L.Effect of exogenous Se on photosynthetic carbon assimilation in tomato seedlings under NaCl stress [D].Shihezi: Shihezi University, 2015.
[50] Teige M, Melzer M, Süss K H.Purification, properties and in situ localization of the amphibolic enzymes D-ribulose 5-phosphate 3-epimerase and transketolase from spinach chloroplasts [J].European Journal of Biochemistry, 2010, 252(2): 237-244.
[51] Raines C A.The Calvin cycle revisited [J].Photosynthesis Research, 2003, 75(1): 1-10.
[52] Haake V, Zrenner R, Sonnewald U, et al.A moderate decrease of plastid aldolase activity inhibits photosynthesis, alters the levels of sugars and starch, and inhibits growth of potato plants [J].Plant Journal, 1998, 14(2): 147-157.
[53] Henkes S, Sonnewald U, Badur R, et al.A small decrease of plastid transketolase activity in antisense tobacco transformants has dramatic effects on photosynthesis and phenylpropanoid metabolism [J].The Plant Cell Online, 2001, 13(3): 535-551.
[54] Ma W, Wei L, Wang Q, et al.Increased activity of the non-regulated enzymes fructose-1,6-bisphosphate aldolase and triosephosphate isomerase insp.strain PCC 7120 increases photosynthetic yield [J].Journal of Applied Phycology, 2007, 19(3): 207-213.
[55] 靳静晨, 马东媛, 靳永胜, 等.烟草转酮醇酶基因()的克隆与表达[J].河南农业大学学报, 2008, 149(5): 479-482.
Jin J C, Ma D Y, Jin Y S, et al.Cloning and expression of transketolase gene (in tobacco [J].Journal of Henan Agricultural University, 2008, 149(5): 479-482.
Effects of Exogenous 5-ALA on the Chlorophyll Synthesis and Fluorescence Characteristics and Gene Expression of Key Enzymes in Tea Plants under Drought Stress
YANG Ni1, LI Yimin1, Li Jingwen1, TENG Ruimin1, CHEN Yi1, WANG Yahui2, ZHUANG Jing1*
1.Ministry of Agriculture Key Laboratory of Biology and Germplasm Enhancement of Horticultural Crops in East China, Tea Research Institute, College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China; 2.State Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing Agricultural University, Nanjing 210095, China
In order to study the regulation mechanism of exogenous 5-aminolevulinic acid (5-ALA) on the chlorophyll synthesis and fluorescence characteristics of tea plants in response to drought stress, tea cultivar 'Shuchazao' was used as the experimental material in this study.Under PEG-6000 simulated drought stress environment and 5-ALA spraying pretreatment, the contents of chlorophyll a, chlorophyll b and total chlorophyll in tea seedling leaves were detected, and the chlorophyll fluorescence parameters and the expressions of key enzyme genes in tea leaves were further determined.The results show that exogenous 5-ALA significantly increased the contents of chlorophyll a, chlorophyll b and total chlorophyll in tea leaves under drought stress.Exogenous 5-ALA alleviated the decreases of maximum fluorescence (), actual photochemical efficiency of PSⅡ [()], maximum photochemical quantum yield of PSⅡ (), photochemical quenching coefficient (), potential activity of PSⅡ(), photosynthetic electron transfer rate () of PSⅡ reaction center, and the increases of initial fluorescence () and nonphotochemical quenching coefficient ().At the same time, exogenous 5-ALA induced the expressions of chlorophyll synthesis (,,) and carbon assimilation-related enzymes (,) in tea plant under drought stress.The study demonstrates that spraying exogenous 5-ALA can effectively alleviate the degradation of chlorophyll and damage to PSⅡ reaction center of tea leaves under drought stress, maintain the higher photosynthetic activity, and improve the photoprotection ability of tea leaves.
tea plant, 5-aminolevulinic acid, drought stress, chlorophyll fluorescence parameters, gene expression
S571.1
A
1000-369X(2022)02-187-13
2021-11-11
2021-12-23
江苏省农业科技自主创新资金项目(CX(20)3114)、江苏高校优势学科建设项目(PAPD)
杨妮,女,博士研究生,主要从事茶树分子生物学研究,2021204040@stu.njau.edu.cn。*通信作者:zhuangjing@njau.edu.cn
(责任编辑:黄晨)

