山茶CjMYB1基因的克隆及表达分析
黄 虎,马先进,李思佳,李辛雷,李纪元,殷恒福*
(1 中国林业科学研究院 亚热带林业研究所,杭州 311400;2 南京林业大学,南京 210037)
山茶(CamelliajaponicaLinn.)是山茶科(Theaceae)山茶属(Camellia)植物,是以观赏为主要栽培目的的种、变种、品种等植物种质资源的统称[1]。山茶在中国栽培历史非常悠久,是中国十大名花之一,也是世界名贵花卉之一,其花团锦簇,色彩艳丽,具有较高的观赏价值。山茶品种一般是在冬春季开花,其花期较长,花色、花型等变异丰富[2]。花色是其重要的观赏性状,现有的山茶品种花色主要为红色、粉色,少量为白色、黄色、复色,例如金花茶组[Sect.ChrysanthaChang]中的金花茶(C.nitidssima),其金黄色的花色独特,形态美观,观赏价值极高,被誉为“植物界中的大熊猫”[3-4]。
花色的呈现与花瓣细胞中的色素种类和含量息息相关,目前研究发现类黄酮、类胡萝卜素、甜菜色素和生物碱及其衍生物等是形成花色的主要因素[5]。在山茶花中,类黄酮化合物是主要的呈色因子,红色山茶品种中主要是含有矢车菊素花色苷,黄色山茶品种中则主要是含有槲皮素,而白色山茶品种中不含有花色苷[2,6]。目前对山茶花色调控的分子机制研究报道比较少,姜丽娜、周兴文对金花茶花色基因查尔酮合成酶基因(CnCHS)、二氢黄酮醇还原酶基因(CnDFR)、类黄酮糖基转移酶基因(CnUFGT)、黄酮醇合酶基因(CnFLS)等研究发现,金花茶的黄酮醇类物质槲皮素-7-O-葡萄糖苷(Qu7G)、槲皮素-3-O-葡萄糖苷(Qu3G)增加,可能是形成黄色花瓣的原因之一[7-8]。
MYB(Myeloblastosis)蛋白是植物转录因子中最大的家族之一,也是花色素生物合成中最广泛的调节因子。MYB转录因子是一类DNA结合蛋白,有一段保守、可结合DNA的MYB结构域,该结构域约由52个氨基酸组成并含有一系列高度保守的氨基酸和间隔序列,这些保守的氨基酸可以使MYB蛋白结构域折叠成螺旋-螺旋-转角-螺旋(helix-helix-turn-helix)结构[9]。MYB转录因子一般可以分为4类:单一结构域(R1/2、R3)蛋白、2个重复结构域(R2R3)蛋白、3个重复结构域(R1R2R3)蛋白和4个重复结构域(R1R2R2R1/2)蛋白。其中R1/2、R3蛋白成员主要参与植物的形态发生、次生代谢、生物钟控制及花和果实的发育等生理过程。R2R3-MYB蛋白成员是植物MYB家族中数量最多的一类,广泛参与植物初生和次生代谢、细胞分化、激素信号传导、生长发育调控、生物及非生物逆境响应等生命过程。R1R2R3蛋白成员则在细胞周期控制方面起到重要的调控作用。而4R蛋白在植物中的功能知之甚少[10-12]。转录因子通过调控下游花色苷合成途径基因影响花色苷的合成,进而调控花色的形成。最早报道的调控花色苷生物合成的MYB转录因子——玉米ZmC1基因,也是植物中首次报道的转录增强因子;与玉米中bHLH蛋白类ZmB或ZmR基因互作,进而激活花色苷合成途径的二氢黄酮醇还原酶(DFR)启动子和类黄酮3-O-葡萄糖基转移酶(3GT)基因[13]。Schwinn等[14]在金鱼草花瓣中克隆到3个R2R3-MYB转录因子Venosa、Rosea1和Rosea2,发现它们通过激活花色苷合成过程中不同关键酶基因的表达,进而影响花色素的积累。Li等[15]在观赏植物红掌中分离出2个R2R3-MYB转录因子AaMYB4和AaMYB5,他们在烟草中的异位表达导致T1代转基因植株花色素的积累,并诱导烟草花色苷生物合成途径关键酶基因表达上调。
目前对山茶中的MYB转录因子研究少见报道,本研究根据山茶花芽转录组数据库进行序列比对分析,发现并克隆了1个MYB基因CjMYB1,对其进行了生物信息学分析,通过荧光定量PCR研究其在不同组织、不同花色品种中的表达模式,并开展亚细胞定位实验,为后期深入了解山茶CjMYB1基因参与调控花色形成、花发育过程提供一定的理论基础。
1 材料和方法
1.1 试验材料与采样
选用4个色系7个品种的山茶花为试验材料,包括花瓣为红色的‘赤丹’、‘金碧辉煌’和野生红山茶,花瓣为淡黄色的‘新世纪’、‘黄旋律’,花瓣为粉色的‘粉丹’,花瓣为白色的‘玉丹’。所有材料均来自于中国林业科学研究院亚热带林业研究所山茶种质资源圃(119°95′E,30°07′N)。于2021年3月初选取生长态势一致、健康茁壮的植株,并采集野生红山茶花芽、嫩叶、花器官组织以及不同品种盛开期的花瓣鲜样于液氮中速冻、研磨,置于-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 RNA提取及反转录合成cDNA称取每个备用样品100 mg,采用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根,北京)说明书进行总RNA的提取,用1.5%的琼脂糖凝胶电泳检测RNA完整性。采用PrimeScript II 1st Strand cDNA Synthesis Kit 试剂(TaKaRa,北京)说明书反转录合成cDNA。cDNA第1条链合成需要1~2 μg的总RNA,1 μL Oligo dT Primer(50 μmol·L-1)引物,1 μL dNTP,4 μL 5×Buffer,0.5 μL RNase抑制剂(40 U·μL-1),1 μL PrimerScriptⅡ反转录酶(200 U·μL-1),最后加入去离子水至总体积20 μL。反应程序为:65 ℃ 5 min,42 ℃ 60 min,95 ℃ 5 min,冰上冷却2 min。
1.2.2 目的基因克隆选取拟南芥、金鱼草、矮牵牛中报道的花色相关MYB转录因子,通过本地Blastp(E=10-10)比对,在山茶花芽转录组数据库[16]中,查找与MYB同源的cDNA序列,根据基因编码区在Primer3 Plus网站(http://www.primer3plus.com/)上设计特异性引物(表1),进而扩增cDNA片段。PCR扩增反应参照Premix Taq试剂(RR003A,TaKaRa,北京)说明书,体系为25 μL;扩增程序如下:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环,72 ℃延伸7 min。PCR产物用1%琼脂糖凝胶电泳检测,将条带正确的扩增产物回收,连接至T-vector pMD20载体上(TaKaRa,北京),转化大肠杆菌E.coliDH5α感受态细胞(TaKaRa,北京),筛选阳性单克隆进行测序验证,得到正确的目的基因序列。
1.2.3 目的基因的生物信息学分析对获得的序列使用NCBI ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)来预测开放阅读框(ORF);使用ExPASy软件(https://web.expasy.org/protparam/)分析其蛋白的理化性质;使用SOPMA在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白的二级结构;使用SWISS-MODEL软件(https://swissmodel.expasy.org/interactive)分析蛋白的三级结构;使用SMART(http://smart.embl-heidelberg.de/)在线软件预测蛋白质的保守结构域;应用BioEdit软件进行蛋白多序列比对;使用MEGA X软件进行系统发育进化树的构建和分析;通过WoLF PSORT II(https://www.genscript.com/wolf-psort.html?src=leftbar)在线网站进行CjMYB1蛋白的亚细胞定位预测。
1.2.4CjMYB1基因表达模式分析使用1.2.1的方法提取不同花色品种和野生红山茶不同组织部位的总RNA,并用PrimeScript RT Master Mix(Perfect Real Time)试剂(TaKaRa,北京)反转录合成cDNA第1条链,根据克隆获得的CjMYB1基因序列,设计荧光定量PCR引物(表1),以GAPDH基因作为内参基因,使用TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)试剂(TaKaRa,北京)进行荧光定量PCR反应,仪器为ABI 7300 Real-time PCR(美国),反应体系为TB GreenⅡ 10 μL,ROX Reference Dye(50×)0.4 μL,正向引物、反向引物(10 μmol·L-1)各0.8 μL,稀释10倍的cDNA模板1 μL,ddH2O 7 μL,共20 μL。反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。每个试验和样品均进行3次重复,采用2-ΔΔCt方法计算相对表达量,再使用SPSS 22.0统计分析软件对结果进行差异显著性分析。

表1 引物序列
1.2.5 亚细胞定位参照EXclone试剂盒(百格生物,江苏)说明书将CjMYB1基因构建到含有35S启动子的pCambia1300-GFP/C表达载体上,转化大肠杆菌感受态细胞,筛选阳性单克隆菌落,经测序验证后转化至GV3101农杆菌感受态细胞(唯地生物,上海)中,于28 ℃培养2~3 d,挑取单菌落进行PCR鉴定。之后挑取鉴定过的阳性菌落,在含有50 mg/L卡那霉素的LB液体培养基中,于28 ℃、200 r/min摇床振荡培养,使其OD600为1.0左右;4 ℃、5 000 r/min离心10 min,收集菌体。用10 mmol/L MgCl2、10 mmol/L MES-KOH、100 μmol/L乙酰丁香酮(As)制成侵染液重悬,室温放置2~3 h,注射侵染本氏烟草叶片下表皮部位,放置于暗环境中培养2~3 d,通过激光共聚焦荧光显微镜观察。
2 结果与分析
2.1 CjMYB1基因的同源克隆
通过本地Blast比对,在山茶花芽转录组数据库中找到一个同源的MYB基因并克隆,PCR扩增结果(图1)显示,扩增产物在1 000 bp左右,经测序该目标序列全长为998 bp。该基因的cDNA全长序列为1 314 bp,开放阅读框(ORF)长为879 bp,编码292个氨基酸(图2);将其命名为CjMYB1。该序列已经上传提交至NCBI GenBank数据库,登录号为OL347930。
M. DL5000

图2 CjMYB1基因的核苷酸序列及推导氨基酸序列
2.2 CjMYB1基因的序列特征分析
通过ExPASy软件在线分析了CjMYB1转录因子的理化性质。结果表明CjMYB1编码蛋白292个氨基酸,分子式为C1449H2315N437O437S10,原子总数为4 648,相对分子质量为33.17 kD,理论等电点为9.17,偏碱性;蛋白的不稳定系数为46.69,为不稳定蛋白,脂肪系数为78.77,总平均亲水性(GRAVY)为-0.794,推测其为亲水性蛋白。应用SMART在线软件对CjMYB1基因所编码的氨基酸序列进行保守结构域分析(图3),发现其具有MYB转录因子的典型保守结构域——SANT结构域,且含有2个,属于MYB转录因子家族的R2R3家族;2个SANT结构域分别在第13~63和66~114个氨基酸处,在第262~276个氨基酸处有1个成分复杂度较低的区域。

图3 山茶CjMYB1蛋白的保守结构域
通过SOPMA在线软件预测了CjMYB1蛋白的二级结构,结果显示,CjMYB1基因编码的蛋白质由无规则卷曲、α-螺旋、延伸链和β-折叠组成,其中无规则卷曲占54.45%,α-螺旋占27.05%,延伸链占11.64%,β-折叠占6.85%,其中以α-螺旋、无规则卷曲为主;进一步通过SWISS-MODEL在线软件对CjMYB1蛋白的三维结构进行了分析,结果显示(图4)以6kks.1.A为建模模板,序列一致性为62.96%,CjMYB1在空间上具有MYB转录因子家族螺旋-螺旋-转角-螺旋(helix-helix-turn-helix)的典型结构,与其对应的二级结构预测结果基本一致。
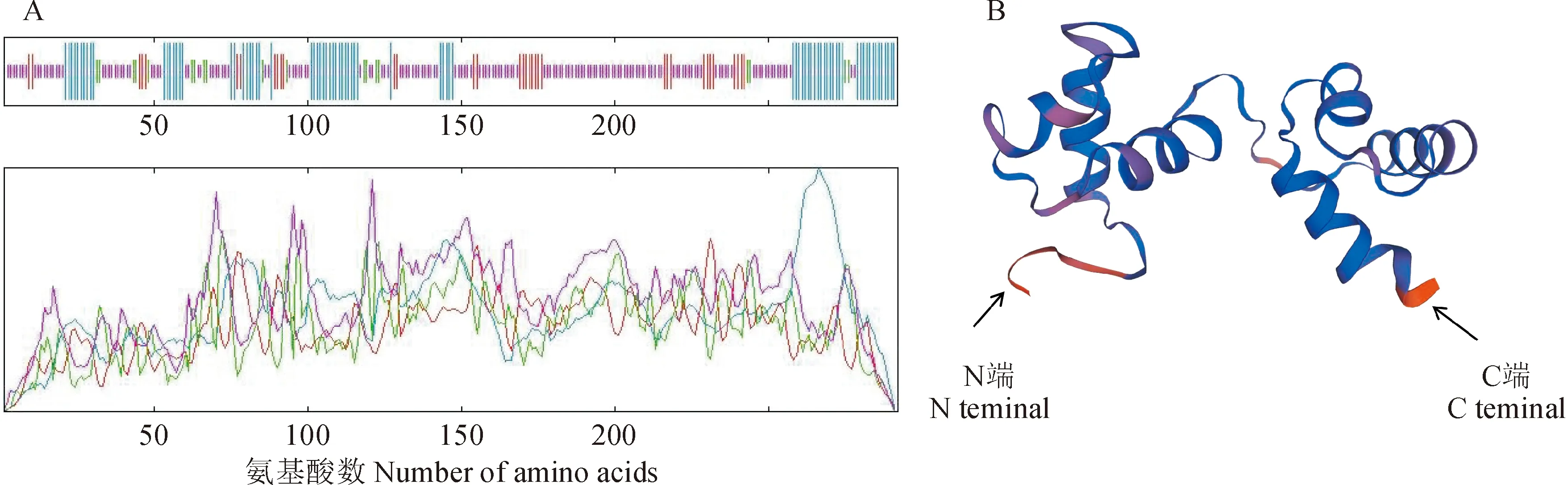
A. 蛋白二级结构预测:蓝色. α螺旋;红色. 延伸链;紫色.无规则卷曲;绿色.β折叠;B. 蛋白三维结构预测
2.3 CjMYB1蛋白多序列比对及系统进化分析
为了研究CjMYB1蛋白的功能与其他物种之间的进化关系,选择了拟南芥、金鱼草、矮牵牛、玉米等7个物种,发现他们均含有保守的R2R3-MYB结构域,且在R2、R3结构域里含有一段保守的motif,分别是RC[G/R]KSCRLRWxNYL[K/R]和LPGRT[A/D]N[D/E][I/V]KNxWN[S/T](图5)。利用MEGA X构建NJ邻接法系统进化树(图6),发现CjMYB1和拟南芥R2R3-MYB家族第7亚组处于同一个分支,说明其与第7亚组进化关系最近;根据Dubos[10]报道,拟南芥第5、6、7亚组分别是与原花青素、花色素以及黄酮醇合成有关,表明CjMYB1可能参与调控植物次生代谢途径黄酮醇物质的合成。
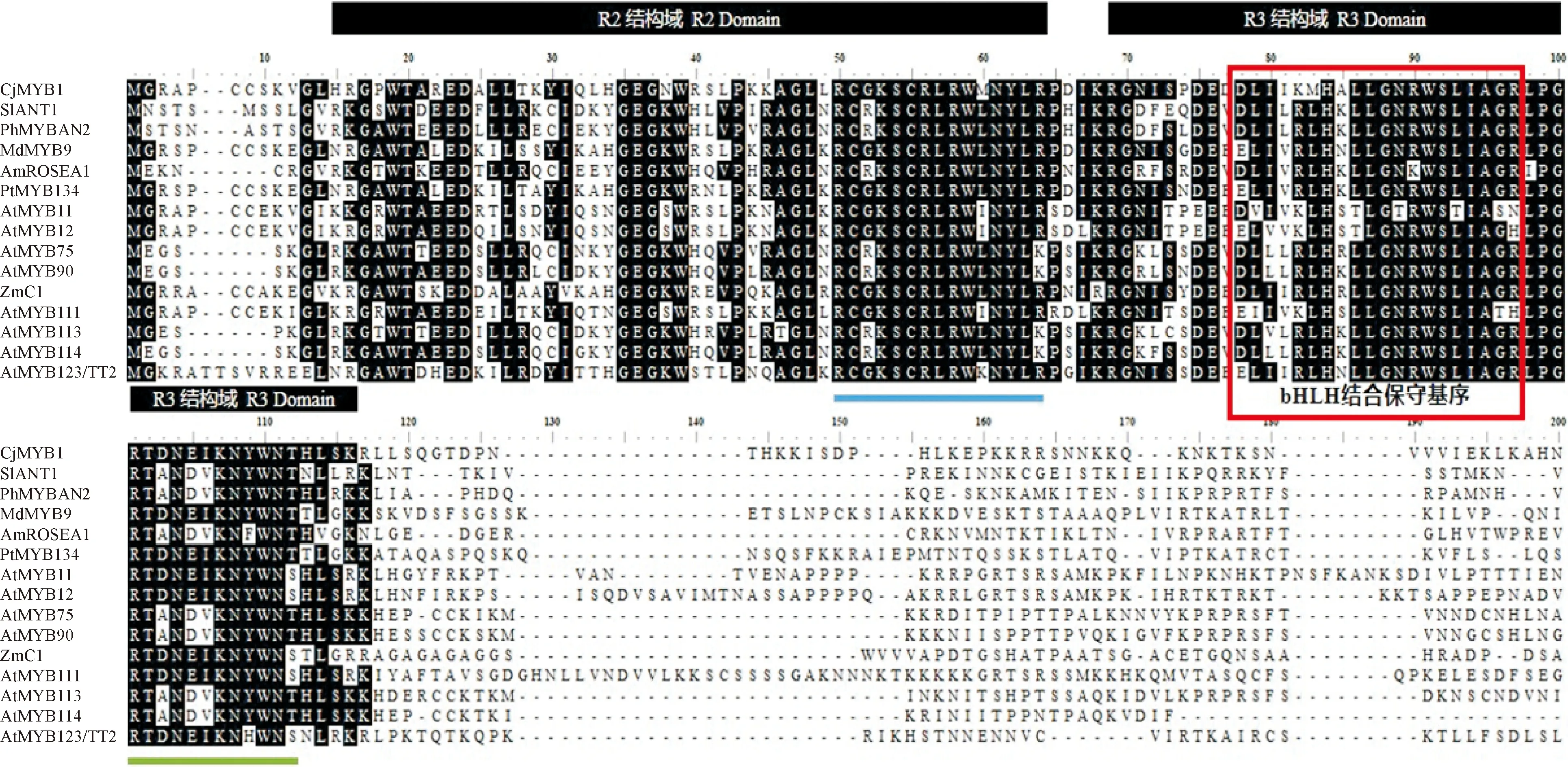
Cj. 山茶;Sl. 番茄;Ph. 矮牵牛;Md. 苹果;Am. 金鱼草;Pt. 杨树;At. 拟南芥;Zm. 玉米;蓝色. R2保守基序;绿色. R3保守基序;红色方框. bHLH结合保守基序
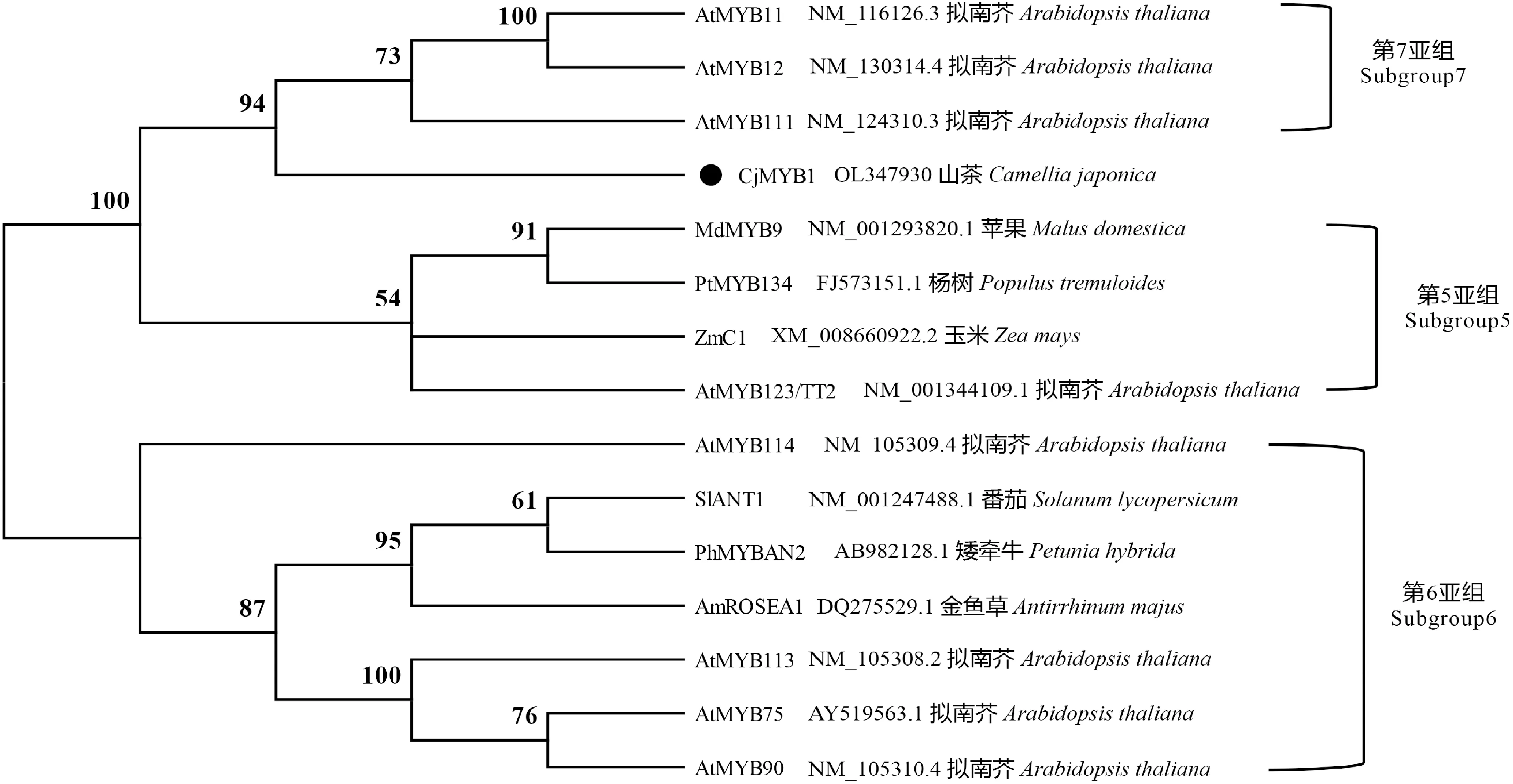
图6 山茶CjMYB1蛋白序列系统进化树分析
2.4 CjMYB1基因组织特异性表达分析
采用荧光定量PCR方法,以GAPDH为内参基因,分析CjMYB1基因在野生红山茶的花芽、花瓣、雄蕊、心皮、萼片和嫩叶中的相对表达量。结果(图7)显示,其在野生红山茶各个组织均有表达,且在不同组织中呈现不同的表达模式。在嫩叶中表达量较低,在萼片、花瓣、心皮和雄蕊中表达量较高,而在花芽中表达量达到最高。推测CjMYB1基因在山茶花器官组织中发挥着很重要的作用。

FB. 花芽;PE. 花瓣;STA. 雄蕊;CA. 心皮;YL. 嫩叶;SE. 萼片;不同小写字母表示在不同组织中基因表达差异显著(P<0.05)
2.5 CjMYB1基因在不同花色品种的表达模式
为了研究CjMYB1基因在不同花色品种中的表达模式,选取了红、黄、粉、白4个色系6个品种,采用荧光定量PCR方法进行检测(同上)。结果(图8)显示,CjMYB1在野生红山茶、红色山茶品种‘赤丹’、‘金碧辉煌’中表达量较高,在野生红山茶中表达量最高;在粉色品种‘粉丹’中表达量较低,而在淡黄色品种‘黄旋律’、‘新世纪’,白色品种‘玉丹’中几乎不表达。由此可以看出,CjMYB1基因可能在红色山茶品种的花色苷合成途径中起到了关键作用。
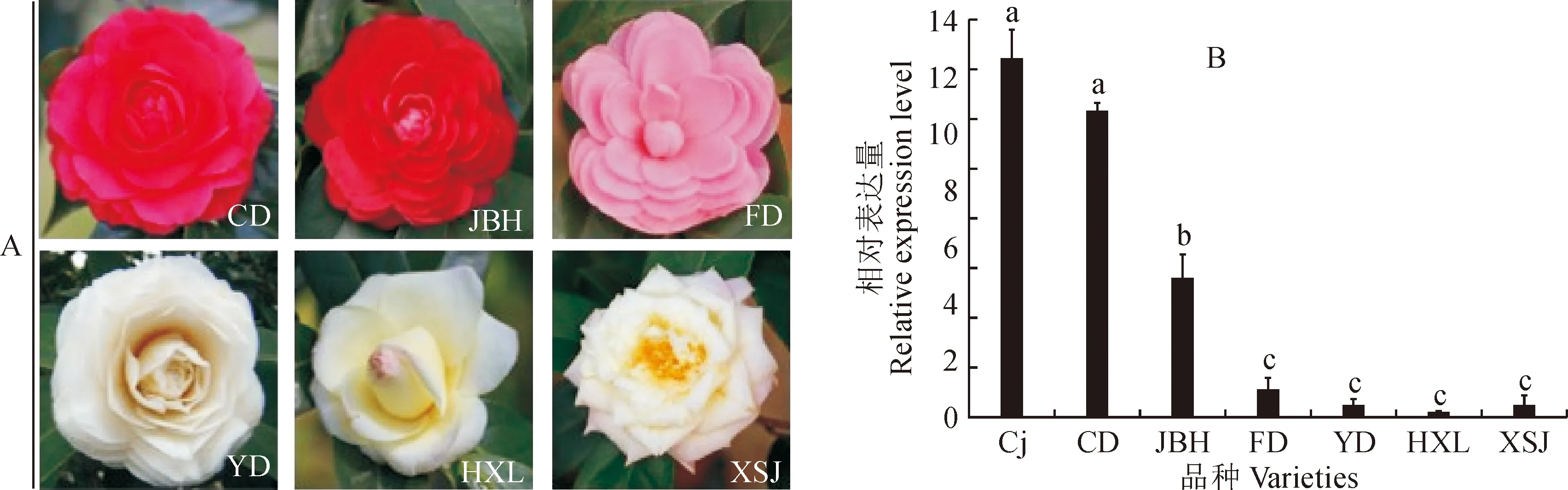
Cj. 野生红山茶;CD. 赤丹;JBH. 金碧辉煌;FD. 粉丹;YD. 玉丹;HXL. 黄旋律;XSJ. 新世纪;不同小写字母表示在不同花色品种中基因表达差异显著(P<0.05)
2.6 CjMYB1蛋白的亚细胞定位
通过WOLF PSORT II网站在线预测,CjMYB1蛋白定位在细胞核中。将CjMYB1基因构建到含有35s启动子的pCambia1300-GFP/C表达载体上,与绿色荧光蛋白(EGFP)融合,通过烟草瞬时转化,使用农杆菌介导,注射侵染本氏烟草的叶片下表皮细胞;同时用只含有EGFP的空载体做为对照。在激光共聚焦显微镜488 nm波长下观察到,空载体的荧光信号在细胞核和质膜上都有分布,含有CjMYB1-EGFP的绿色荧光信号只在细胞核中观察到,结果证实了CjMYB1蛋白定位在细胞核(图9)。
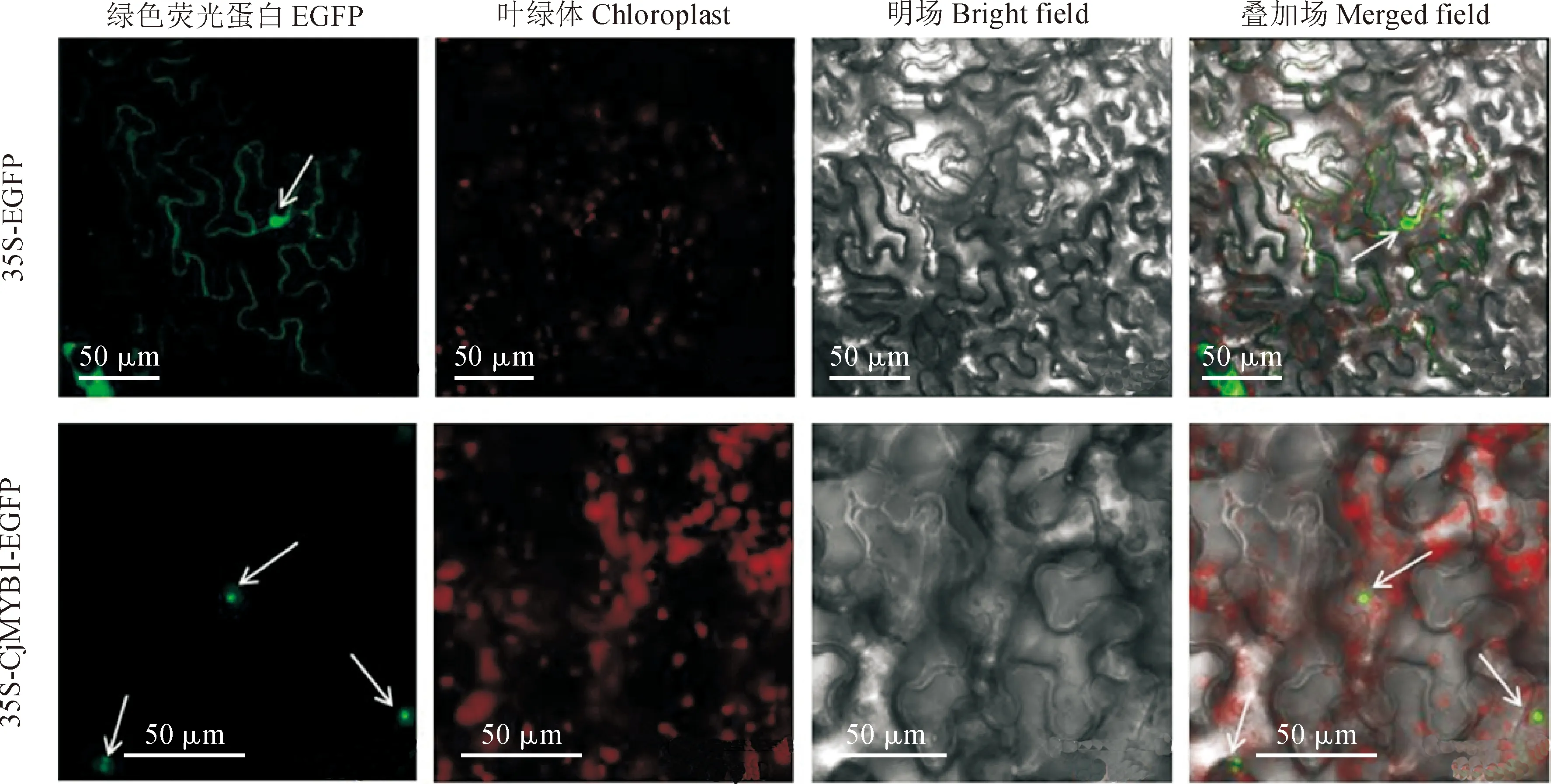
图9 CjMYB1蛋白的亚细胞定位(白色箭头为细胞核)
3 讨 论
R2R3-MYB转录因子是MYB转录因子家族中最多的一类,广泛参与植物次生代谢、细胞分化、激素信号传导、生长发育调控等生命过程[10]。目前在山茶中未见相关MYB转录因子研究报道,本研究则是以野生红山茶和不同花色品种山茶为材料,采用PCR方法克隆了山茶CjMYB1基因,并对其进行了初步探索研究。该基因编码292个氨基酸,且在N端含有两个保守的SANT结构域,属于典型的R2R3-MYB转录因子结构特征。
在拟南芥中,R2R3-MYB转录因子是包含100多个成员的MYB亚家族[17],其中AtMYB123为第5亚组,参与种皮中原花青素的生物合成;AtMYB75、AtMYB90、AtMYB113和AtMYB114为第6亚组,参与拟南芥营养组织中花色素的生物合成;AtMYB11、AtMYB12和AtMYB111为第7亚组,参与黄酮醇的生物合成,且三者均参与调控查尔酮合成酶(CHS)、黄酮醇合成酶(FLS)、UDPG葡萄糖基转移酶(UGT)等结构基因的表达[18-20]。MYB转录因子一般与bHLH、WD40转录因子互相作用形成MBW复合体来调控下游基因[21],TT2-TT8-TTG1形成的MBW复合物(R2R3-MYB-bHLH-WD40)促进拟南芥种子原花青素的合成[22],草莓的FaMYB9/FaMYB11,FabHLH3和FaTTG1的功能也与拟南芥AtTT2,AtTT8和AtTTG1相似,将这些基因转到拟南芥tt2-1,tt8-3和ttg1突变体中,发现也能够促进拟南芥合成花色素[23]。Gu等在牡丹中发现PsMYB12与bHLH和WD40蛋白之间相互作用形成转录调节复合物,直接激活了牡丹查尔酮合成酶基因(PsCHS)的表达并对牡丹花瓣斑产生影响[24]。本研究中发现CjMYB1与拟南芥R2R3-MYB家族第7亚组更为接近,但是AtMYB11、AtMYB12和AtMYB111并没有bHLH转录因子结合保守基序[D/E]Lx2[R/K]x3Lx6Lx3R[25];推测CjMYB1可能是与山茶bHLH转录因子结合形成MBW复合体,参与调控植物次生代谢途径类黄酮物质合成。
在山茶花色研究中,红色和粉色花瓣中主要花色苷成分为矢车菊素-3-O-β-葡萄糖苷(Cy3G)和矢车菊素-3-O-[6-O-(E)-p-香豆酰]-β-葡萄糖苷(Cy3GEpC),黄色花瓣中主要成分为Qu3G和槲皮素-3-O-芸香糖苷(Qu3R),白色花瓣中则不含有花色苷成分[2,6]。本研究通过荧光定量PCR检测,分析了CjMYB1基因在野生红山茶不同组织、不同花色品种中的表达模式,发现其在野生红山茶不同组织的表达量差异显著,在花器官组织中表达量较高,在叶片中表达量较低,说明其可能参与调控了山茶花器官组织次生代谢途径;在红色山茶品种中表达量较高,而在粉、淡黄、白色品种中表达量较低;表明其可能参与了山茶矢车菊素花色苷的合成。后续还需要通过功能验证进一步探索CjMYB1基因是如何参与调控山茶花色、花器官发育的分子机制。

