外周血T淋巴细胞亚群变化对乳腺癌新辅助化疗疗效的预测价值
刘刚,薛孝斌,任冬莉
西安市长安区医院肿瘤科1、普通外科2、麻醉科3,陕西 西安 710100
乳腺癌是世界上女性常发癌症之一,其发病率和病死率都较高,尤其在40~50 岁女性患者中占多数。全球中每年约140 万人被确诊为乳腺癌,其中50 万人会死于乳腺癌[1-2]。有数据显示,大约有20%的患者在首次就诊时就已被确诊为局部晚期乳腺癌[3],故此类患者只能先通过新辅助化疗控制肿瘤,然后再进行保乳根除手术。但是,由于局部晚期乳腺癌的体积较大,需要随时根据患者情况调整治疗方案,故若能早期并及时地评估新辅助化疗对乳腺癌患者的疗效,这对患者后续治疗和预后有至关重要的意义[4-5]。T淋巴细胞亚群在机体抗肿瘤的免疫监视功能中发挥重要作用,相关研究报道T 淋巴细胞亚群与肿瘤患者的年龄、肿瘤分期等病理学资料有一定的关系,以及治疗前后T淋巴细胞亚群也会有一定的变化[6-7]。目前,对于外周血T淋巴细胞亚群和乳腺癌新辅助化疗疗效之间关系的研究还尚少。因此,本研究通过检测乳腺癌患者外周血的不同T 淋巴细胞亚群水平,旨在探究外周血T淋巴细胞亚群变化与乳腺癌新辅助化疗疗效的关系,同时分析外周血T 淋巴细胞亚群对新辅助化疗疗效的预测价值,现报道如下:
1 资料与方法
1.1 一般资料 前瞻性选取2018 年1 月至2019年1月在西安市长安区医院进行新辅助化疗治疗且符合以下纳入和排除标准85 例乳腺癌患者为研究对象。纳入标准:(1)经空芯针穿刺活检确诊为乳腺癌;(2)年龄≥18 岁;(3)均为单侧、单发性肿瘤;(4)病理分型为Luminal-A 阳性、Luminal-B 型、HER2-阳性型、TNBC 型等;(5)无化疗禁忌者;(6)女性患者。排除标准:(1)妊娠期或哺乳期;(2)有严重的肺部感染或全身感染者;(3)入院前进行包块切除活检;(4)对化疗药物过敏者。85例患者年龄34~73岁,平均(51.26±8.14)岁;TNM 分期Ⅱ期46 例,Ⅲ期39 例;右侧40 例,左侧45 例;有淋巴结转移者36 例,无淋巴结转移者49 例;Luminal-A 阳性31 例,Luminal-B 型29 例,HER2-阳性型19 例,TNBC 型6 例。另选同期在我院体检的健康人群44 例作为对照组,年龄30~72 岁,平均(52.22±8.62)岁。两组受检者的年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有患者知情并经本人和家属签署知情同意书。
1.2 治疗方法 观察组患者均接受新辅助化疗。在使用多西他赛1 d前口服地塞米松片(广东华南药业集团有限公司,批准文号:国药准字H44024469)16 mg/d,连续服用3 d;静脉推入10 mg 地塞米松磷酸注射液(浙江泰康药业集团有限公司,批准文号:国药准字H33021922);肌肉注射25 mg 的盐酸异丙嗪注射液(天津金耀药业有限公司,批准文号:国药准字H12020969),防止过敏。HER2-阳性型患者化疗方案:静脉滴注表柔比星(辉瑞制药(无锡)有限公司,批准文号:国药准字H20000496)80 mg/m2,d1;静脉滴注氟尿嘧啶(精华制药集团南通有限公司,批准文号:国药准字H32025153)500 mg/m2,d1;静脉滴注环磷酰胺(江苏恒瑞医药股份有限公司,批准文号:国药准字H32020857)600 mg/m2,d1。其他病理分型患者按以下化疗方案进行。静脉滴注多西他赛(江苏奥赛康药业有限公司,批准文号:国药准字H20080444)75 mg/m2,d1;静脉滴注表柔比星75 mg/m2,d2;静脉滴注环磷酰胺500 mg/m2,d2。一个周期21 d,治疗两个周期评估一次临床疗效,疗效好或有效的则继续进行化疗,若出现无效或是肿瘤进展则需更换化疗方案或直接进行手术。新辅助化疗共进行6 个周期,化疗完成后三周进行乳腺癌改良根除术。
1.3 观察指标与检测方法
1.3.1 T淋巴细胞 治疗前及治疗后抽取患者外周血5 mL,同时抽取对照组受检者外周血5 mL,所有样本均在当天检测完成。首先用微量移液枪将混合均匀的抗凝血加入样管底部,要避免沾到样管壁上,然后加入20 μL 的单克隆抗体,低速震荡3 s 混匀,室温避光标记30 min;加入2 mL 的裂解液,低温震荡摇匀,室温避光静置10~12 min,溶血时间也避免过长,以免破坏白细胞,静置后离心,吸去上清液,加入2 mL的磷酸盐缓冲液(PBS)低温震荡混匀,重复上述洗涤和离心过程2~3次,加入1%多聚甲醛固定,摇匀,避光保持于2℃~8℃环境下待测。采用流式细胞仪检测CD3+、CD4+、CD8+T淋巴细胞水平,并计算CD4+/CD8+比值。CD3+正常范围:50%~84%;CD4+正常范围:27%~51%;CD8+正常范围:15%~44%;CD4+/CD8+比值正常范围:0.71~2.87。
1.3.2 临床疗效 采用RECIST 标准[8]评估乳腺癌患者新辅助化疗后的疗效,以超声或核磁共振等影像学手段为指导,测量实体肿瘤最大径线。完全缓解(complete remission,CR):所有目标病灶消失;部分缓解(partial remission,PR):基线病灶长径总和缩小≥30%;疾病进展(progressive disease,PD):基线病灶长径总和增加≥20%或出现新病灶;疾病稳定(stable disease,SD):基线病灶长径总和缩小但未达到PR,或增加未达到PD。疾病控制率(disease control rate,DCR)(%)=(CR+PR+SD)/总例数×100%。
1.4 统计学方法 应用SPSS22.0 统计学软件进行数据分析。计量资料符合正态分布,以均数±标准差(±s)表示,两组组间比较采用独立样本t检验,组内比较采用配对样本t 检验,多组间比较采用单因素方差分析;根据CD3+、CD4+、CD4+/CD8+比值变化情况采用MedCalc软件绘制受试者特征操作曲线(receiver operator characteristic,ROC),计算曲线下面积(area under curve,AUC)。均以P<0.05为差异有统计学意义。
2 结果
2.1 化疗前观察组和对照组受检者的T 淋巴细胞亚群变化比较 化疗前观察组患者的CD3+、CD4+、CD4+/CD8+比值明显低于对照组,CD8+明显高于对照组,差异均有统计学意义(P<0.05),见表1。
表1 化疗前观察组和对照组T淋巴细胞亚群变化比较(±s)

表1 化疗前观察组和对照组T淋巴细胞亚群变化比较(±s)
组别观察组对照组t值P值例数8544 CD3+(%)62.68±5.0668.72±5.186.3760.001 CD4+(%)28.55±4.3936.66±4.629.7710.001 CD8+(%)32.77±4.3226.76±4.727.2570.001 CD4+/CD8+0.87±0.281.37±0.339.0380.001
2.2 外周血T 淋巴细胞亚群与乳腺癌临床病理特征的关系 不同年龄、部位、病理分型的乳腺癌患者的免疫功能比较差异均无统计学意义(P>0.05);TNM分期Ⅱ期患者CD4+T淋巴细胞和CD4+/CD8+比值明显高于Ⅲ期患者,有淋巴结转移患者CD4+T淋巴细胞和CD4+/CD8+比值明显高于无淋巴结转移患者,差异均有统计学意义(P<0.05),见表2。
表2 外周血T淋巴细胞亚群与乳腺癌临床病理特征的关系(±s)
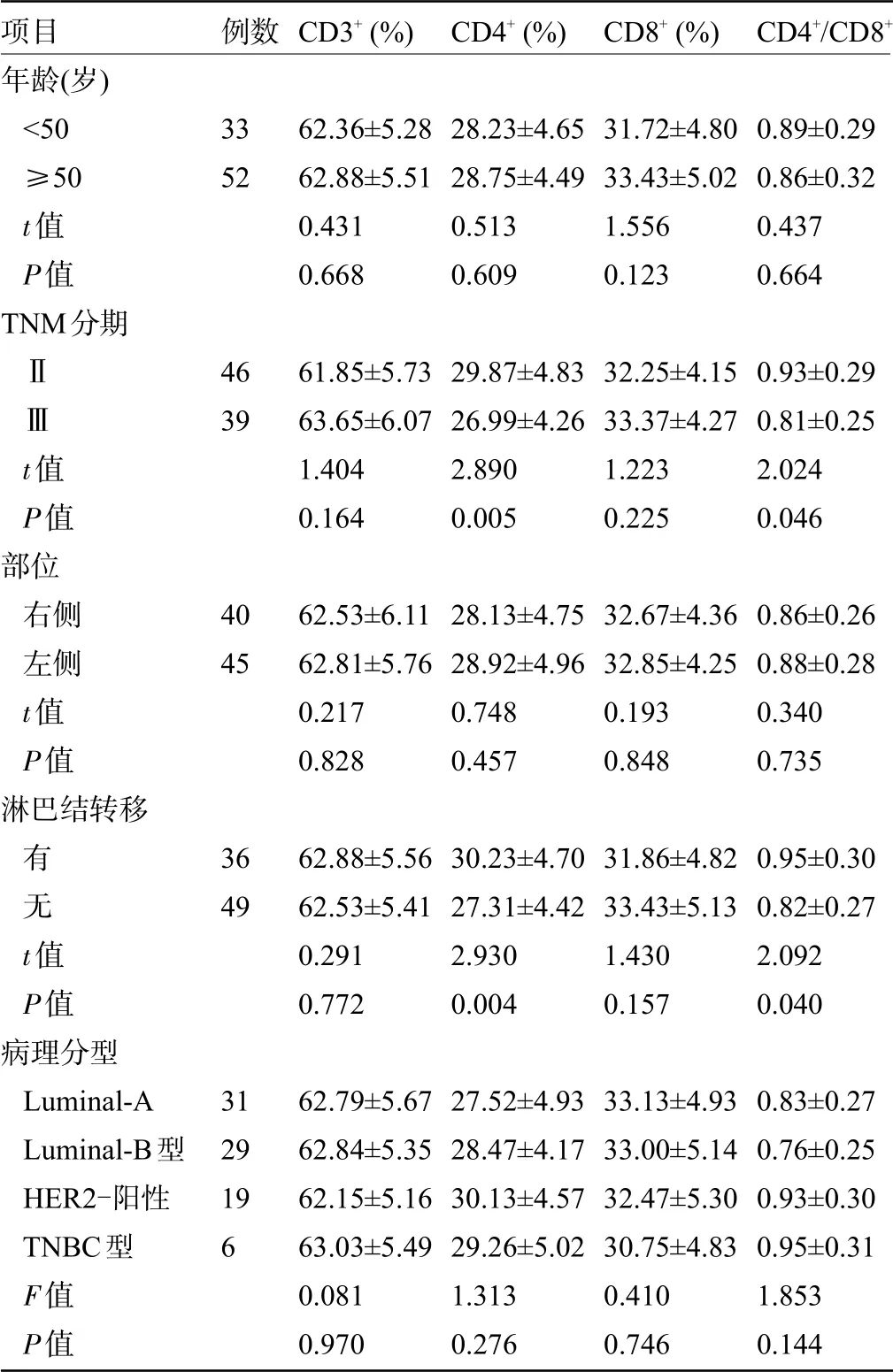
表2 外周血T淋巴细胞亚群与乳腺癌临床病理特征的关系(±s)
项目年龄(岁)<50≥50 t值P值TNM分期ⅡⅢt值P值部位右侧左侧t值P值淋巴结转移有无t值P值病理分型Luminal-A Luminal-B型HER2-阳性TNBC型F值P值例数33524639404536493129196 CD3+(%)62.36±5.2862.88±5.510.4310.66861.85±5.7363.65±6.071.4040.16462.53±6.1162.81±5.760.2170.82862.88±5.5662.53±5.410.2910.77262.79±5.6762.84±5.3562.15±5.1663.03±5.490.0810.970 CD4+(%)28.23±4.6528.75±4.490.5130.60929.87±4.8326.99±4.262.8900.00528.13±4.7528.92±4.960.7480.45730.23±4.7027.31±4.422.9300.00427.52±4.9328.47±4.1730.13±4.5729.26±5.021.3130.276 CD8+(%)31.72±4.8033.43±5.021.5560.12332.25±4.1533.37±4.271.2230.22532.67±4.3632.85±4.250.1930.84831.86±4.8233.43±5.131.4300.15733.13±4.9333.00±5.1432.47±5.3030.75±4.830.4100.746 CD4+/CD8+0.89±0.290.86±0.320.4370.6640.93±0.290.81±0.252.0240.0460.86±0.260.88±0.280.3400.7350.95±0.300.82±0.272.0920.0400.83±0.270.76±0.250.93±0.300.95±0.311.8530.144
2.3 乳腺癌患者新辅助化疗前后的T 淋巴细胞亚群变化比较 乳腺癌患者化疗后的CD3+、CD4+、CD4+/CD8+比值明显高于治疗前,CD8+明显低于治疗前,差异均有统计学意义(P<0.05),见表3。
表3 乳腺癌患者新辅助化疗前后的T淋巴细胞亚群变化比较(±s)

表3 乳腺癌患者新辅助化疗前后的T淋巴细胞亚群变化比较(±s)
时间化疗前化疗后t值P值CD3+(%)62.68±5.0666.54±5.506.7400.001 CD4+(%)28.55±4.3932.30±4.617.6830.001 CD8+(%)32.77±4.3228.74±4.058.8780.001 CD4+/CD8+0.87±0.281.15±0.318.7510.001
2.4 不同治疗效果乳腺癌患者的T 淋巴细胞亚群变化比较 新辅助化疗后,DC共57例(DC组),其中CR 0例,PR 20例,SD 37例。PD 28例(PD组)。DC组患者的CD3+、CD4+、CD4+/CD8+比值明显高于PD 组,差异均有统计学意义(P<0.05),而CD8+略低于PD组患者,但差异无统计学意义(P>0.05),见表4。
表4 不同治疗效果乳腺癌患者的T淋巴细胞亚群变化比较(±s)
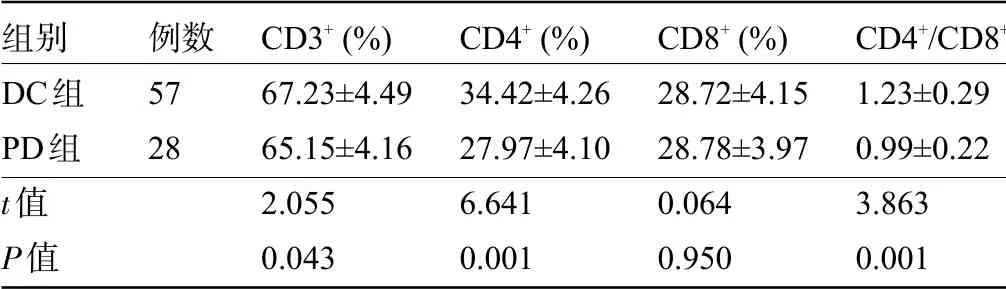
表4 不同治疗效果乳腺癌患者的T淋巴细胞亚群变化比较(±s)
组别DC组PD组t值P值例数5728 CD3+(%)67.23±4.4965.15±4.162.0550.043 CD4+(%)34.42±4.2627.97±4.106.6410.001 CD4+/CD8+1.23±0.290.99±0.223.8630.001 CD8+(%)28.72±4.1528.78±3.970.0640.950
2.5 T 淋巴细胞亚群对乳腺癌患者新辅助化疗疗效的预测价值 ROC曲线分析结果显示,CD4+的预测价值最高,然后依次是CD4+/CD8+、CD3+、CD8+,见表5和图1。

图1 T淋巴细胞亚群对乳腺癌患者新辅助化疗疗效预测价值的ROC曲线分析
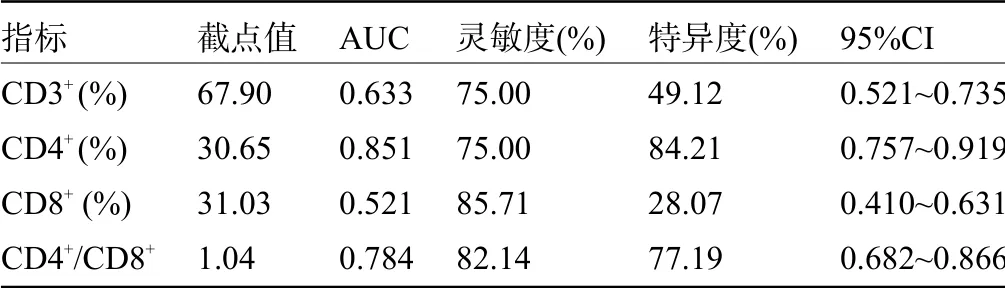
表5 T淋巴细胞亚群对乳腺癌患者新辅助化疗疗效的预测价值
3 讨论
乳腺癌是危害女性健康的恶性肿瘤之一,发病率居所有女性癌症中第一位[9]。早期乳腺癌通过根除术就可控制其临床症状,而对于局部晚期乳腺癌患者来说,术前还需要进行化疗,这样不仅能够控制原发病灶,还能抑制微小转移灶的生长[10]。新辅助化疗的疗效对评估药物敏感性、制定后续手术计划及预后有非常重要的影响。随着肿瘤免疫学相关研究的逐渐深入,越来越多的研究已经证实机体的免疫功能在多种肿瘤的发展过程占据重要地位,尤其是T淋巴细胞,当T 淋巴细胞亚群水平失衡时,往往预示着患者的免疫系统处于紊乱状态[11-12]。这主要是因为淋巴细胞会参与机体的细胞免疫和体液免疫。在免疫应答中发挥重要作用,可抑制肿瘤细胞的增殖和转移,因而较低水平的淋巴细胞会严重影响患者的免疫应答,从而促进肿瘤发展[13]。在正常情况下,T 淋巴细胞各亚群的数量和比例均在一定范围内,CD3+、CD4+、CD8+是调控和辅助其它淋巴细胞发挥功能的淋巴细胞[14]。CD3+T 淋巴细胞是机体总T淋巴细胞水平,CD3+的下降表示机体免疫功能降低,水平越低,免疫功能越差;CD4+T 淋巴细胞水平的降低表示机体淋巴因子的减少,CD8+T 淋巴细胞水平的降低表示细胞免疫受到抑制[15-16];此外,在正常生理状态下,CD4+/CD8+比值是处于动态平衡中,其水平的下降表示机体T 淋巴细胞均处于失衡状态[17-18]。因此,本研究旨在探究外周血T淋巴细胞水平与乳腺癌新辅助化疗疗效的关系,从而为乳腺癌患者的治疗提供一定的参考。
本研究结果显示,化疗前观察组患者的CD3+、CD4+、CD4+/CD8+比值均明显低于对照组,CD8+明显高于对照组,提示乳腺癌患者的免疫功能比健康人群低,此研究结果与刘超等[19]研究结果一致。此外,本研究根据年龄、TNM分期、部位、淋巴结转移分析了外周血T淋巴细胞的表达水平,结果显示:不同年龄、部位、病理分型的乳腺癌患者的免疫功能无明显差异,TNM分期Ⅱ期患者CD4+T淋巴细胞和CD4+/CD8+比值明显高于Ⅲ期患者,有淋巴结转移患者CD4+T淋巴细胞和CD4+/CD8+比值明显高于无淋巴结转移患者,提示疾病的进展和有无淋巴结转移会对免疫功能有一定的影响,淋巴结转移结果与曾繁余等[20]研究结果一致,TNM 分期结果与严明基等[21]研究结果一致。乳腺癌患者化疗后的CD3+、CD4+、CD4+/CD8+比值均明显高于治疗前,CD8+明显低于治疗前,提示当肿瘤得到较好的控制时,会使免疫功能恢复至相对正常的水平。本研究还显示,DCR患者CD3+、CD4+、CD4+/CD8+比值均明显高于PD患者,提示患者化疗的效果越佳,免疫功能越好,这可能是由于化疗效果佳的患者其机体肿瘤的增殖、进展、转移受到了抑制。鉴于以上研究,本研究进一步分析了CD3+、CD4+、CD4+/CD8+比值对乳腺癌新辅助化疗疗效的预测价值,ROC曲线显示,CD4+的预测价值最高,然后依次是CD4+/CD8+、CD3+、CD8+。
综上所述,在癌细胞的影响下,乳腺癌患者的免疫功能处于抑制状态,这与TNM 分期和淋巴结转移有一定的关系。患者在进行新辅助化疗后,细胞免疫功能有明显改善,尤其是化疗疗效好的患者,其免疫功能改善效果更显著,这为临床上乳腺癌患者进行合理治疗提供了理论依据,避免因盲目用药而导致错失治疗时机;此外,CD4+和CD4+/CD8+比值在评估新辅助化疗疗效方面具有较高的价值。本研究的局限在于样本量较少,因此为得到确切结论,仍需要开展大样本量、多中心研究以进一步验证。

