基于TLR4信号通路黄芪多糖促树突状细胞抗肿瘤作用的研究*
贾贝田 ,王丽 ,崔换天 ,金昱彤 ,曹敏 ,刘海朝 ,边育红
(1.天津中医药大学,天津 301617;2.天津市第二人民医院,天津 300192;3.山东大学,青岛 266237)
细胞免疫应答是抗肿瘤免疫的主要方式[1]。有效的抗原递呈是激活CD8+T细胞并触发细胞毒性T淋巴细胞(CTL)反应的关键。树突状细胞(DCs)作为最强大的抗原呈递细胞(APC),可以通过识别肿瘤相关抗原,激活CTL特异性杀灭肿瘤细胞,在抗肿瘤过程中发挥着重要的作用[2]。临床研究发现,肿瘤患者的DCs功能缺陷与肿瘤的发生、发展密切相关[3]。患者的肿瘤组织、淋巴结和外周血中成熟DCs的数量显著减少,抗原呈递和CTL激活的能力低下[4]。因此,促进DCs成熟,进而激活CTL已成为国内外研究热点[5]。
黄芪多糖(APS)是扶正中药黄芪的主要活性成分,已被公认为是一种抗肿瘤免疫调节剂,并在临床上得到广泛应用[6-7]。研究发现:APS抗肿瘤作用与DCs密切相关[8]。APS可促进DCs表面分子CD80、CD86的表达,促进DCs成熟,并激活CTL发挥抗肿瘤作用[9-11]。
Toll样受体4(TLR4)是DCs的核心模式识别受体,通过TLR4介导的DCs活化是启动CD8+T细胞反应的重要步骤。研究发现DCs可通过TLR4介导的髓样分化因子(MyD88)依赖的信号转导通路被LPS/中药多糖活化,分泌肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-12等多种细胞因子[12-13]。TLR4被配体激活后,MyD88蛋白的TIR域与TLR的TIR域结合,而后通过其死亡区域与IL-1受体相关激酶(IRAKs)的N-末端死亡区域相互作用,其中IRAK1被IRAK4磷酸化而活化,超磷酸化的IRAK1与TRAF6结合并使其活化,激活下游通路进而导致细胞质内核转录因子(NF-κB)活化,促使 NF-κB 进入细胞核,激活相关基因发生转录,诱导DC成熟,分泌共刺激分子及相关细胞因子。通过TLR4中和抗体抑制TLR4信号传导或干扰TLR4可以导致细胞炎性因子产生的减少[14]。Priyank等[15]发现TLR4可以通过My D88依赖性途径促进DCs诱导的CTL活化。但是,尚不清楚TLR4信号通路是否介导APS诱导的DCs活化并发挥抗肿瘤作用。因此,本实验将以小鼠树突状细胞DC2.4为受试细胞,研究基于TLR4通路APS对DCs活化及发挥抗肿瘤作用影响。
1 材料与方法
1.1 材料 小鼠树突状细胞DCs 2.4购于赛百慷(上海)生物技术股份有限公司;小鼠结肠癌细胞CT26购于上海北纳创联生物技术有限公司;雄性BALB/c小鼠购于北京华阜康生物科技股份有限公司;APS粉末购于天津赛诺制药有限公司;青霉素链霉素混合液、RPMI-1640培养基、FITC标记的CD80抗体、PE标记的CD86抗体、肿瘤坏死因子(TNF)-α、0.25%胰蛋白酶、细胞总RNA提取试剂盒、cDNA反转试剂盒、Q-PCR扩增试剂盒(SYBR Green)以及ELISA相关试剂盒购于天津贝尔格莱科技有限公司;TLR4通路抑制剂ST2825、TAK-242购于MedChem Express;胎牛血清购于天津华立科技有限公司。
1.2 方法
1.2.1 细胞培养及分组 小鼠树突状细胞DC2.4用DMEM高糖培养基(含10%胎牛血清、100 U/m L青霉素、100 μg/mL链霉素)进行培养;小鼠结肠癌CT26细胞用RPMI1640培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)进行培养。细胞培养箱设置条件:5% CO2、恒温37℃、饱和湿度,每2日更换培养液,观察并记录细胞的生长状态。
取对数生长期的DC2.4细胞,调整密度为4×105个细胞/mL,接种于6孔板,每孔2 mL,于37℃、5% CO2培养箱中培养,具体分组如下:控制(Control) 组、APS 组、TNF-α 组、APS+TNF-α 组、TAK-242+TNF-α 组、TAK-242+APS+TNF-α 组、ST2825+TNF-α 组及 ST2825+APS+TNF-α 组。
1.2.2 APS对DC2.4细胞成熟及活化的影响 各分组细胞培养72 h后,分别收集细胞及上清,细胞流式技术检测DC2.4细胞表面标记CD80、CD86的表达水平,ELISA试剂盒检测上清中细胞因子IL-12p-70的分泌情况。
1.2.3 APS干预的DC2.4对T细胞活化及杀伤肿瘤的影响 1)小鼠脾脏淋巴细胞分离及染色:颈椎脱臼处死健康的BALB/c小鼠,75%的乙醇浸泡消毒,无菌取小鼠脾脏,研磨脾脏,用200目细胞筛过滤除去组织块,收集脾脏细胞,用D-Hanks平衡盐溶液清洗2次,加入红细胞裂解液处理5 min,2 000 r/min离心20 min(离心半径为17.3 cm,下同),用1mL完全培养基重悬,接种于T25培养瓶中。12 h后,收集非贴壁细胞即为脾脏淋巴细胞,1500rmp离心5min,弃上清,用PBS溶液洗两次,每次1500rmp离心5 min,弃上清,加入已配好的CTG染液,37℃避光孵育30 min。1 500 rmp离心5 min,弃上清,用PBS溶液清洗一次,1 500 rmp离心5 min,弃上清,用1 mL完全培养液重悬沉淀细胞,细胞计数板进行计数,调细胞浓度为 5×105个/mL。
2)肿瘤抗原致敏DCs:将小鼠结肠癌细胞CT26反复冻融,制备成肿瘤抗原。加入到已加药培养72 h的各分组的DCs中(上清液已取出),使DCs和肿瘤抗原的比例为1∶10。
3)ELISA法检测APS干预的DCs对T细胞分泌细胞因子的影响:加抗原致敏的DCs于5% CO2,37℃培养 24 h后,每孔加入 5×105个/mL T 细胞100 μL,使DCs和脾脏淋巴细胞的比为1∶10。培养24 h后,收集各组上清液,按试剂盒操作说明操作检测IL-2的含量。
4)脾脏淋巴细胞增殖检测:小鼠DC与脾脏淋巴细胞共培养24 h后用全视野细胞成像分析仪检测脾脏淋巴细胞增殖情况。
5)APS促DCs活化CTL发挥抗肿瘤作用的研究:将各组致敏DCs与T细胞按1∶10比例共同培养,2 d后收集悬浮细胞,进行细胞计数,调整T细胞浓度为1×106个/mL,制成CTL细胞悬液。取对数生长期肿瘤细胞,调整细胞浓度分别为1×105。取96孔板,加入CTL细胞和肿瘤细胞各100 μL,使其效靶比分别为10∶1。96孔板置于5% CO2、37℃培养箱培养24 h后,吸出培养基,吖啶橙(AO)和碘化丙啶(PI)双荧光染色,通过全视野细胞成像分析,观察死亡率。
2 统计分析
采用SPSS 22对实验数据进行统计分析,首先进行正态性检验和方差齐性检验,若总体均满足正态性和方差齐性,计量资料用均数±标准差(±s)表示,两组数据比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
3 结果
3.1 APS对DC2.4细胞成熟及活化的影响 为了研究APS对DC2.4成熟的影响,课题组检测了APS对DC2.4表面标记物CD80和CD86表达的影响。由图1A-B所示,与Control组比较,APS组和TNF-α组均可上调DCs表面标记分子CD80和CD86的表达,且两者合用时效果最优,差异有统计学意义(P<0.01)。该实验说明了APS和TNF-α合用可显著促进DCs的成熟。
DC成熟后分泌的细胞因子IL-12p-70是诱导T细胞应答的必要条件,故本实验检测了APS对DC分泌细胞因IL-12p-70的影响。由图1C所示,与Control组比较,APS和TNF-α均可促进DC分泌细胞因子IL-12p-70,且两者合用时效果最优,差异有统计学意义(P<0.01)。该实验进一步说明了APS和TNF-α合用可显著促进DCs的成熟和活化。
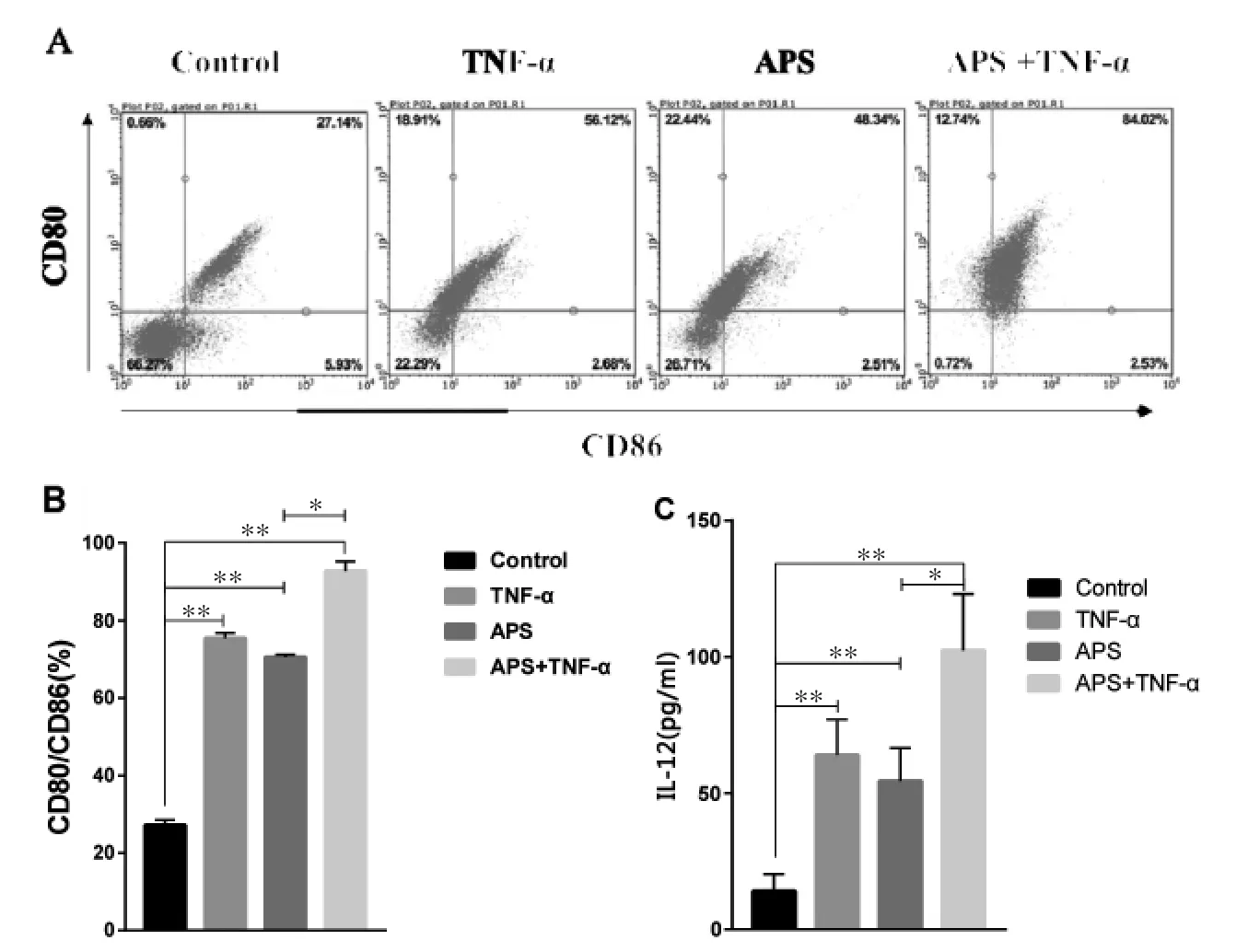
图1 APS对DC2.4细胞成熟及活化的影响
3.2 APS干预的DC2.4细胞对T细胞活化及杀伤肿瘤的影响 T细胞介导的免疫杀伤是机体对肿瘤的重要免疫应答,因此该实验首先检测了APS干预后的DC对T细胞活化的影响。如图2A-B所示,与Control组相比,各加药组对T细胞增殖及分泌IL-2的水平均显著提高,差异有统计学意义(P<0.05),且与APS组相比,APS+TNF-α组DCs对T细胞增殖及分泌IL-2水平的促进作用最强(P<0.05)。该实验说明APS干预后的DC2.4细胞促进了T细胞的活化,且与TNF-α合用时效果最优。
本实验将APS干预的DC刺激后的T细胞与CT26细胞共培养,检测APS干预的DC对T细胞杀伤肿瘤的影响。如图2C-D所示,与Control组相比,TNF-α组、APS组以及APS+TNF-α组肿瘤细胞的杀伤率均显著增高,分别为 56.79、57.92和69.56%,差异均有统计学意义(P<0.01),其中 APS+TNF-α组肿瘤细胞死亡率最高。该实验表明APS干预后的DC2.4细胞增强了T细胞对肿瘤的杀伤。

图2 APS干预的DC2.4对T细胞活化及杀伤肿瘤的影响
3.3 基于TLR4通路APS对DC2.4细胞成熟及活化的影响 为了进一步明确APS促DC2.4细胞成熟及活化的机制,本实验使用TAK-242(TLR4抑制剂)和ST2825(MyD88抑制剂)阻断TLR4介导的MyD88通路,观察APS对DC2.4成熟及活化的影响。
如图3所示,与TNF-α组相比,加入TLR4通路阻断剂TAK-242或ST2825后,TNF-α组CD80/CD86的表达以及IL-12p-70的分泌均无显著差异,说明阻断剂TAK-242和ST2825对TNF-α作用效果无影响,差异无统计学意义(P>0.05);与TNF-α组相比,加入TLR4通路阻断剂TAK-242或ST2825后,APS+TNF-α组 DC2.4细胞表面分子CD80/CD86的表达以及IL-12p-70的分泌水平也均无显著差异(P>0.05)。本实验说明加入TLR4通路阻断剂TAK-242或ST2825后,APS不能诱导DC2.4的成熟及活化,初步证明APS可能是通过TLR4介导的MyD88通路促DC2.4成熟及活化的。
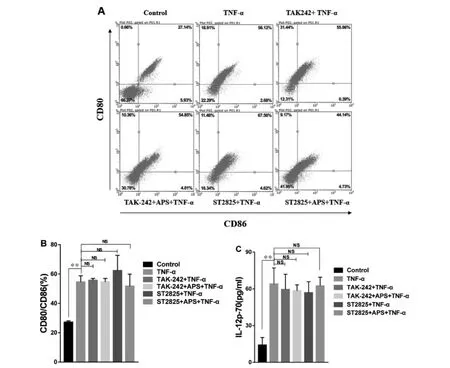
图3 基于TLR4通路APS对DC2.4成熟及活化的影响
3.4 基于TLR4通路APS干预的DC2.4细胞对T细胞活化及杀伤肿瘤的影响 阻断TLR4介导的MyD88通路后,本实验检测了APS干预的DC2.4是否对T细胞的活化及杀伤肿瘤产生影响。如图4所示,与TNF-α组相比,加入TLR4通路阻断剂TAK-242和ST2825抑制剂后,各组T细胞增殖及分泌的IL-2水平差异均无统计学意义(P>0.05),对肿瘤细胞CT26的杀伤水平也均无明显差异(P>0.05)。说明阻断TLR4介导的MyD88通路后,APS干预的DC2.4细胞无法诱导T细胞产生应答并发挥杀伤肿瘤的作用。
4 讨论
正常情况下,DCs在维持机体免疫平衡中起着重大的调节作用。但是在肿瘤微环境中存在着大量细胞因子抑制DCs功能,如PGE-2、IL-10和TGF-β等,从而导致肿瘤逃逸[16-17]。研究表明APS能增强人体免疫功能,提高免疫细胞的免疫活性,是理想的机体免疫增强剂[18]。如APS可增强巨噬细胞的吞噬作用[19]。CD80和CD86属于免疫球蛋白超家族,其配体均是CD28和CD152,主要表达于活化的DCs表面,是DCs成熟的主要标志,也是DCs活化T细胞启动机体免疫应答的重要信号[20-22]。TNF-α可促进DCs成熟,增强DCs对初始T细胞的刺激。因此本课题加入了TNF-α刺激DC,并考察APS与TNF-α合用对DC功能的影响。本研究发现DCs经APS刺激后,CD80、CD86的表达均增高,提示APS诱导DCs的成熟,且与细胞因子TNF-α协同使用时效果最好。IL-12p-70是IL-12的活化状态,具有促进Th0细胞向Th1细胞的分化,诱导T细胞活化,并增强IL-2、TNF-α的分泌等功能。本研究发现APS可促进DCs分泌IL-12p-70,说明APS可提高DCs的免疫活性,且与细胞因子TNF-α协同使用时效果最优。
T细胞介导的免疫杀伤是机体抗肿瘤的重要免疫应答,IL-2是T细胞活化的标志。本实验将APS活化的DCs与T细胞共培养,发现细胞上清中IL-2分泌水平增高,且活化的CTL细胞对肿瘤细胞的杀伤作用增强,说明APS可促进DCs活化T细胞,从而发挥抗肿瘤的作用。尽管这些研究结果揭示了APS具有提高DCs免疫功能,促进T细胞对肿瘤的杀伤,但其分子生物学机制有待阐明。
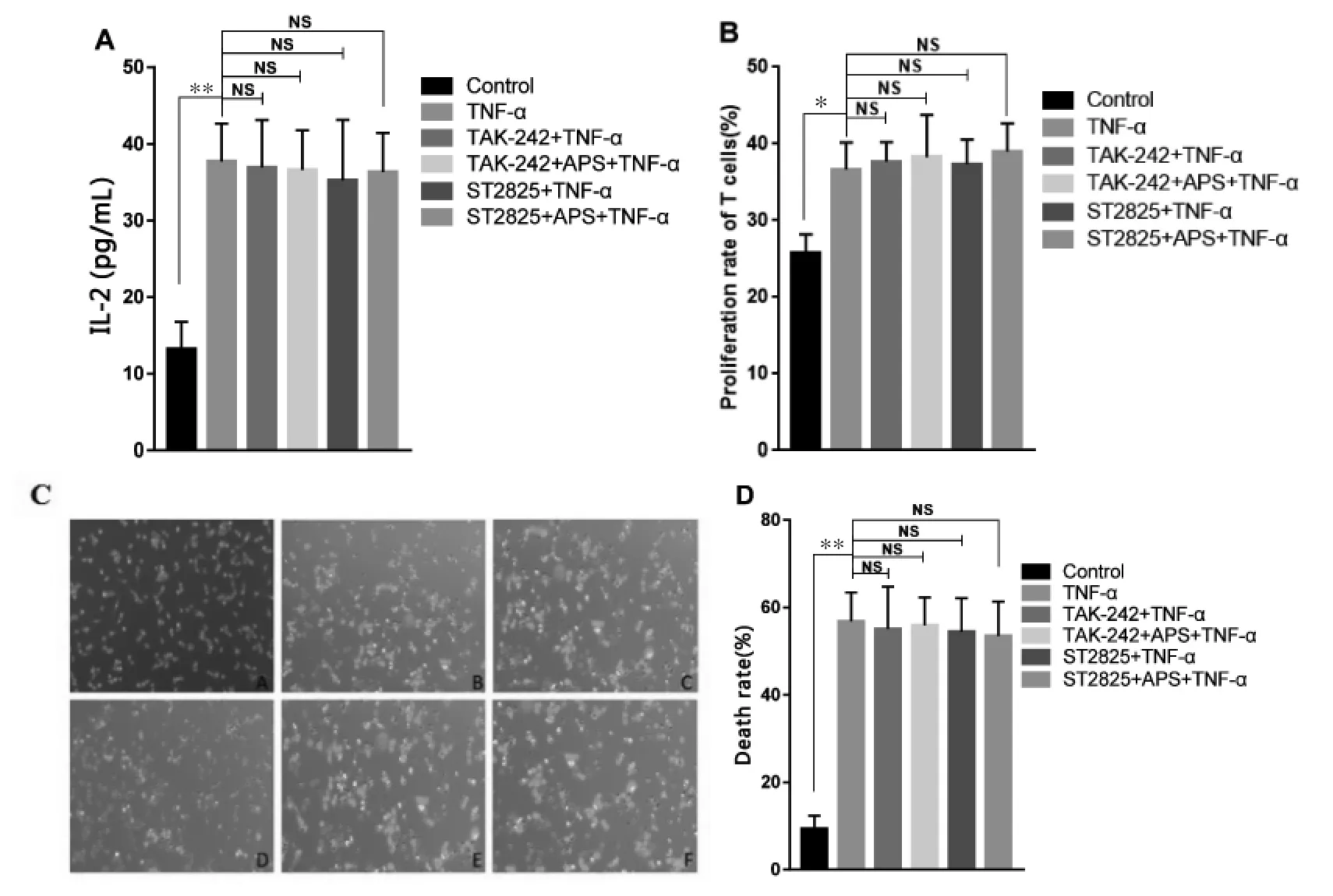
图4 基于TLR4通路APS干预的DC2.4细胞对T细胞活化及杀伤肿瘤的影响
研究发现TLR4一旦识别了病原体中特定的分子结构,就会激活细胞内TLR下游一系列的信号通路,活化免疫细胞产生细胞因子。TLR4可通过MYD88通路,活化IKK2-TRAF6复合物,激活NF-κB,促进促炎因子的转录。为验证APS是否通过TLR4信号通路影响DCs,本实验加入TLR4关键节点抑制剂TAK-242和ST2825抑制剂,结果显示经TAK-242和ST2825阻断通路后,与TNF-α组比较,抑制剂组对DCs表面分子CD80、CD86的表达、细胞因子IL-12 p-70的分泌以及对T细胞活化杀伤肿瘤作用均无显著差异。本研究通过体外实验初步阐明了APS通过TLR4信号通路促进DCs发挥抗肿瘤作用的机制。
综上所述,本课题说明了基于TLR4通路,APS可促进DCs表面分子CD80、CD86的表达及细胞因子IL-12 p-70的分泌,进而活化T细胞,分泌IL-2,发挥抗肿瘤的作用,且与细胞因子TNF-α协同使用时效果最优,为APS在临床的应用提供理论基础,为新药的研制和开发提供新的视角。

