利用放射性碳和稳定性碳同位素技术估算抚仙湖北部近岸湖区消费者的碳源贡献
甘颖欣, 苏雅玲, 胡恩
利用放射性碳和稳定性碳同位素技术估算抚仙湖北部近岸湖区消费者的碳源贡献
甘颖欣1,2,5, 苏雅玲1, 胡恩3,4,*
1. 中国科学院南京地理与湖泊所湖泊与环境国家重点实验室, 南京 210008 2. 中国科学院大学, 北京 100043 3. 长安大学, 西安 710069 4. 陕西省环境科学研究院, 西安 710069 5. 中国电建集团城市规划设计研究院有限公司, 广州 511457
碳同位素技术可用于辨析湖泊消费者的食物来源。基于抚仙湖北部近岸湖区主要消费者及其各食物来源的放射性同位素特征(Δ14C)与稳定同位素特征(13C), 运用IsoSource混合同位素模型估算了不同碳源对湖泊消费者的贡献。抚仙湖各食物来源浮游植物、沉水植物和陆源碎屑的13C比值分别为-31‰、-13.5‰和-29.4‰, ∆14C比值分别为101.5‰、42.9‰和19.8‰.两种消费者舌状叶镖水蚤和太湖新银鱼的13C比值分别为-27‰和-23.5‰, 而∆14C比值分别为52‰和44.2‰, 表明抚仙湖的消费者依赖于现代碳的初级生产。IsoSource混合同位素模型估算结果显示: 抚仙湖浮游植物对浮游动物和鱼类的贡献比例分别为34.7%和19.6%, 沉水植物贡献为16.4%和36.4%, 陆源碎屑为48.9%和44%, 表明浮游动物的碳源主要是湖泊浮游植物与陆源碎屑, 而鱼类的碳源则主要以沉水植物和陆源碎屑为主。
抚仙湖北部湖区; 食物网; 碳源贡献; 同位素
0 前言
传统湖沼学理论认为, 支撑湖泊食物网的碳源主要来自于湖泊系统内部的初级生产, 如浮游藻类、底栖藻类、水生植物等[1]。然而, 湖沼学家已经认识到来自流域的陆源有机碳的重要性: 它们同样可以被湖泊消费者利用, 补贴湖泊食物网碳源[2–3]。因此, 估算湖泊中各类碳源对消费者的贡献比例, 有助于深入研究湖泊食物网的功能和机制。
稳定同位素技术是揭示生态系统物质循环、能量流动以及探索食物网中消费者和生产者之间营养关系的重要手段和工具, 目前在水生态学应用最为广泛、最为成熟的是碳、氮稳定同位素[4]。13C比值常被用来追溯消费者的食物来源, 而15N比值常被用来确定水生生物之间的营养关系[5]。近年来氘(2H)、硫(34S)等稳定同位素也为水域生态学研究提供了新的视角[6–7]。稳定碳同位素技术(13C)虽然被广泛应用于水生态系统食物网的研究, 但仍有其局限性, 而放射性碳同位素技术则能克服这些难题。一方面,14C拥有更为宽广的同位素范围(碳源可测试∆14C比值范围达-1000‰到+200‰), 解决了食物网中有机碳稳定同位素部分重叠而导致的食物来源难以区分的问题[8]; 另一方面,14C的衰变特性能够区分消费者所利用有机质的新老年代, 反映有机物在水体和流域内的时空变化[9]。14C方法可用于追踪不同年代有机碳在水生食物网中的流动[8]。根据测定天然放射性碳同位素丰度建立的高精度年代标尺, 按照14C的半衰期(5730年)即可计算出各消费者和碳源的确切年代, 进而推断流域利用是否导致“古代”的碳流失[10]。且∆14C比值在当地生境中非常稳定, 几乎不受同位素分馏的影响[11], 还可用来确定生态系统中的碳周转时间[12]。目前,13C联合14C的方法已被用于研究冰川融水补给的水生态系统食物网的碳循环[13–14]。
抚仙湖是一个高原贫营养湖泊, 属于高原断陷型湖泊, 是我国已知第三深水湖泊, 淡水储量排名中国湖泊第一[15]。然而, 从上世纪80年代以来, 流域内的工农业生产、旅游业的发展和森林砍伐已经对抚仙湖生态环境产生了严重影响[16], 尽管抚仙湖目前仍为贫营养状态, 但其营养水平在过去的20年仍然呈现出明显的增长趋势[17]。北部入湖河流携带了较多的外源物质进入湖泊, 对食物网结构产生了一定的影响, 且该区沿岸带分布有较多的沉水植物, 故加强北部湖区的研究将对预测未来抚仙湖食物网结构的变化趋势具有重要意义。目前, 对抚仙湖食物网碳源的研究报道较少, 本研究通过放射性碳同位素技术确定了抚仙湖北部湖区主要消费者所利用有机碳源的新老年代, 并基于抚仙湖主要消费者浮游动物与新银鱼及各碳源的放射性同位素特征(∆14C)与稳定同位素特征(13C), 运用IsoSource混合同位素模型估算不同碳源对两种消费者的贡献。
1 材料与方法
1.1 湖泊背景介绍
抚仙湖位于云南省中部的玉溪市, 距昆明市东约60 km, 地处北纬24°21′28″—24°38′00″, 东经102° 49′12″—102°57′26″(图1), 包含星云湖和抚仙湖两个天然湖泊, 流域总面积超过1000 km2。抚仙湖北宽南窄, 外形似葫芦状, 南北长31.5 km, 东西宽11.5 km, 湖泊面积212 km2, 平均水深87 m, 最大水深近155 m。抚仙湖属于贫营养型深水湖泊(相关理化参数见表1)。抚仙湖鱼类种类较多, 其中太湖新银鱼()、云南倒刺鲃()和抚仙鲇()等为抚仙湖的优势鱼种[18]。浮游动物群落中, 桡足类舌状叶镖水蚤()和枝角类象鼻蚤属()为优势种[17]。绿藻门种类在抚仙湖浮游植物群落中占优势, 其次为甲藻门和金藻门[19]。抚仙湖的高等植被主要以大型沉水植物为主, 其中黑藻()、穗状狐尾藻(L.)和马来眼子菜()等为优势种[20]。
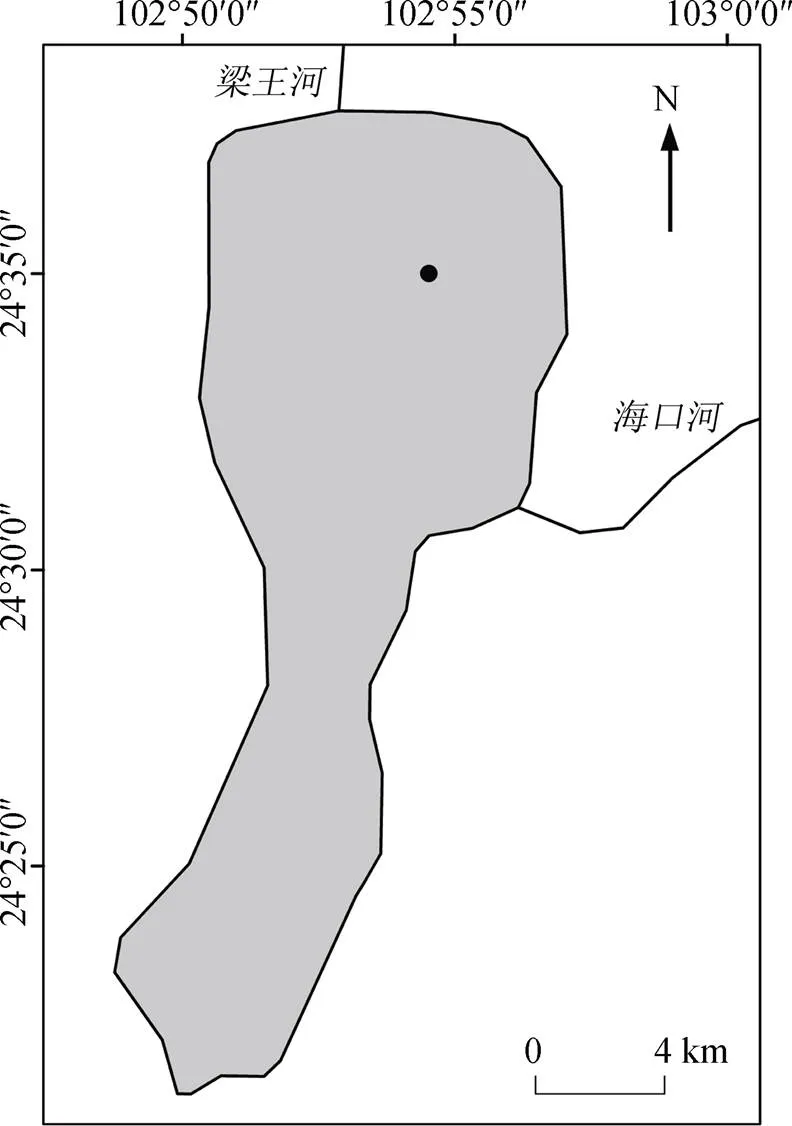
图1 抚仙湖北部湖区采样点分布示意图
Figure 1 Map of sampling sites in northern Lake Fuxian
1.2 样品采集
采样工作于2015年5月在抚仙湖北部湖区开展, 采样点见图1。本研究采样在北部湖区选取了点位采样, 结合了14C与13C技术共同对消费者及其碳源进行测定。在北部沿岸带湖区, 同级消费者如浮游动物, 不同种属之间的∆14C比值极为相近。本研究人员于青藏高原湖泊的调查分析中, 测定过浮游动物枝角类和桡足类的∆14C比值, 二者极为相近, 并无显著差异。
湖泊采样指标主要包含消费者的各种潜在食物来源: 浮游植物, 沉水植物和陆源碎屑, 其中沉水植物选取抚仙湖优势种之一马来眼子菜(), 陆源碎屑选择流域优势陆生植被的落叶凋零物。浮游植物优势种为转板藻(sp.), 飞燕角甲藻()和锥囊藻(spp.)[19]。消费者主要采集了浮游动物和鱼类, 浮游动物选取优势种桡足类舌状叶镖水蚤(), 鱼类选取优势种太湖新银鱼()。太湖新银鱼为小型鱼类, 栖息于水体中上层[21], 于春秋两季生长迅速[22], 以大型浮游动物为主食[23], 在抚仙湖食物链中属于次级消费者。此外还采集了湖泊颗粒有机碳(Particulate Organic Carbon, POC)的样品用于脂肪酸提取, 以测定浮游植物的13C比值[24]; 采集了溶解无机碳(Dissolved Inorganic Carbon, DIC)的样品以指征浮游植物的∆14C比值[25–26]; 同时还对潜在的“老碳”来源—湖泊表层沉积物进行取样。
鱼类数量随机选择三条, 取足量背部肌肉组织, 混合后储存在事先10%盐酸浸润的离心管中, 冻干并冷冻保存以备同位素的分析。用140 μm或者64 μm等不同规格的浮游生物网在采样点拖取足量的甲壳类浮游动物, 在实验室转移到装有蒸馏水或者Whatman GF/F石英玻璃纤维膜过滤后湖水的烧杯中, 放置3到5小时清空浮游动物肠道内含物。之后在解剖镜下手工将浮游动物分类并挑选足够数量(干重50 mg)的舌状叶镖水蚤()样品于锡囊中, 冻干之后冷冻保存以备同位素分析。
手工直接采取马来眼子菜的茎、叶部位, 用去离子水冲洗干净, 带回实验室冷冻干燥以备同位素分析。在湖泊周边手工采取足量的落叶凋零物, 用去离子水冲洗干净, 冻干并冷冻保存, 以备陆源碎屑的同位素分析。用抓斗取湖泊表层1到2厘米沉积物样品, 除去大型枝叶根茎等杂物, 实验室加入盐酸去除无机碳, 冻干并冷冻保存以备沉积物有机碳的同位素分析。

表1 抚仙湖湖泊特征参数
用采水器采集10 L湖泊水样, 用预烧(450 ℃, 4 h)的Whatman GF/F石英纤维过滤器过滤, 分离用来测定有机碳、无机碳同位素的样品。将1 L滤液收集到预酸化和灼烧(450 ℃, 4 h)的琥珀色玻璃瓶中, 立即注入100 μL氯化汞溶液以去除微生物对样品的影响, 随即密封, 室温下黑暗环境存储用于DIC样品同位素分析。将过滤所得含有颗粒有机碳(POC)的Whatman GF/F滤膜, 保存于事前灼烧好的铝箔, 实验室冻干并冷冻保存以备POC的同位素分析。浮游植物的磷脂脂肪酸(Phospholipid Fatty Acid, PLFAs)可以从悬浮颗粒有机碳(POC)中提取[24]: 取3到5张富集有总POC样品的滤膜, 冷冻干燥后, 采用Bligh-Dyer方法提取浮游植物的PLFAs[27], 用于测定各组分的稳定碳同位素比值, 其中20:5ω3 PLFA代表硅藻群落、18:3ω3 PLFA代表绿藻群落、18:4ω3 PLFA代表鞭毛藻群落, 通过加权计算样品中藻类生物标志物13C比值的贡献以估算总的浮游植物13C比值。
1.3 分析方法
1.3.1 放射性14C同位素分析
本研究中所有样品的∆14C比值测试都是在美国佛罗里达州迈阿密BETA实验室通过加速器质谱仪(Accelerator Mass Spectrometry, AMS)完成。POC、浮游动物等固态样品冷冻干燥至恒重, 以12 (mol·L-1)的HCl酸熏24小时除去碳酸盐, 重新干燥随后燃烧生成CO2, 低温捕获, 还原为石墨以备∆14C比值测试.子样品用来测试13C比值。DIC样品直接利用H3PO4水解, 生成的CO2利用N2剥离后捕获, 低温净化还原为石墨, 以备∆14C比值测试, 子样品用来测试DIC的13C比值。∆14C比值的分析误差为±3.73‰。
1.3.2 稳定13C同位素分析
将处理好的样品根据样品含碳量的情况放入锡囊中称重, 以备同位素比值测定.所有的稳定同位素样品都采用稳定同位素质谱仪进行测试。本研究中DIC的13C比值在美国佛罗里达州迈阿密BETA实验室测试完成。其余样品全部在中国科学院南京地理与湖泊研究所国家重点实验室稳定同位素质谱仪完成。13C比值的分析误差为±0.01‰。
1.3.3 消费者食源的相对贡献比例计算
本研究采用Phillips和Gregg设计的多元线性混合模型IsoSource估算消费者食源的相对贡献比例, 通过13C和14C两种同位素构建质量守恒模型求解多种食源的贡献比例, 公式如下:
∆C = f ∆C + f ∆C+ f ∆C
1 = f + f + f
式中∆C为消费者的放射性14C同位素比值;∆C—∆C分别为浮游植物, 沉水植物和陆源碎屑的放射性同位素比值;f—f分别为浮游植物, 沉水植物和陆源碎屑贡献比例, 其和为1。稳定13C同位素比值的求取同样适用于该公式。模型运行时设置增量(Increment)为1%, 容差参数(Tolerance Parameters)为1‰—2‰[28]。
2 结果与分析
稳定同位素和放射性同位素特征测试结果如表2所示。抚仙湖北湖区浮游植物、沉水植物和陆源碎屑的13C比值分别为-31‰、-13.5‰和-29.4‰, 两种消费者舌状叶镖水蚤()和太湖新银鱼()的13C比值分别为-27‰和-23.5‰。消费者的13C比值位于各潜在食物来源的13C比值之间, 表明抚仙湖消费者拥有多种食物来源, 但是由于陆源输入物质和湖泊内源初级生产者存在食源13C比值重叠的现象, 不能仅依靠稳定同位素来简单判定消费者的主要食物来源, 因此结合放射性14C同位素技术可以更好的理清消费者的食物来源组成。
浮游植物、沉水植被、陆源植被的∆14C比值分别为101.5‰、42.9‰和19.8‰, 皆表现出明显的现代14C特征。抚仙湖沉积物有机碳的∆14C比值为-117.4‰, 是唯一表现为古代14C特征的碳源, 其对应的放射性14C年代为940 yr。抚仙湖两种消费者浮游动物和鱼类的∆14C比值分别为52‰和44.2‰, 同样皆表现为现代14C特征, 表明抚仙湖的消费者依赖于现代碳的初级生产; 抚仙湖流域利用还没有导致“古代”的碳流失。抚仙湖DIC的∆14C比值为101.5‰, 说明湖泊中DIC主要是流域输入以及湖水与大气二氧化碳(现代大气的∆14C比值约为42.7‰)交换的结果。湖泊POC的∆14C比值为13.4‰, 和陆源碎屑的∆14C比值接近, 表明现代的陆源碎屑可能是抚仙湖POC库的重要来源之一。
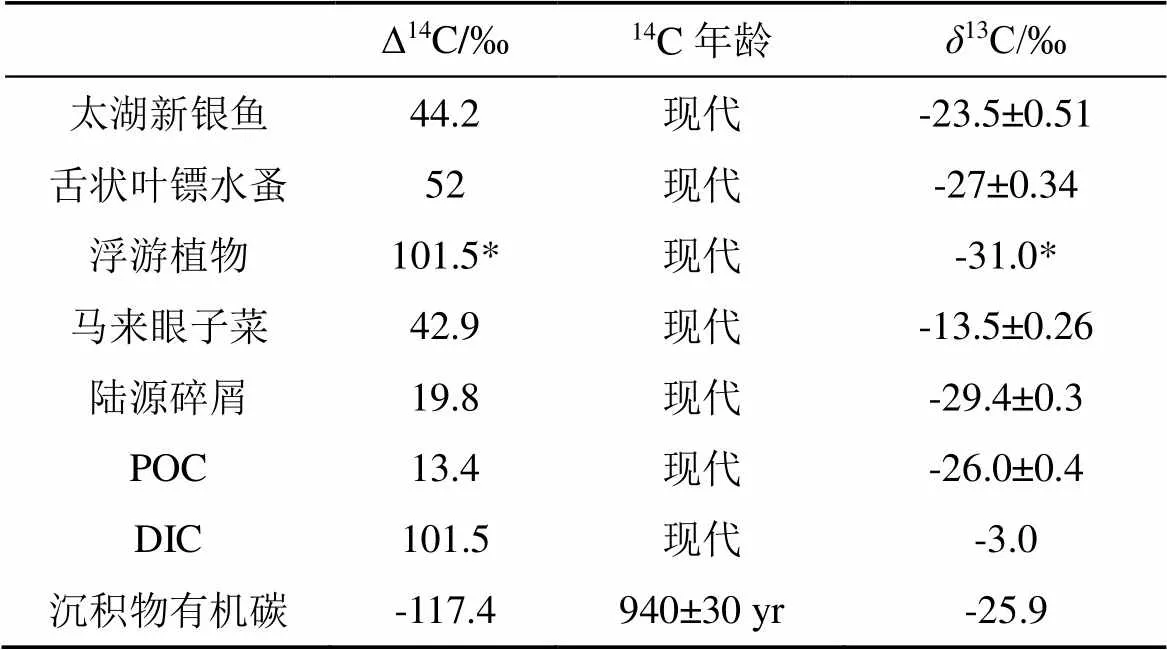
表2 抚仙湖消费者及潜在食物来源的∆14C比值和δ13C比值
基于放射性同位素特征(∆14C)与稳定同位素特征(13C)的 IsoSource混合同位素模型计算结果(图2)显示: 抚仙湖中, 初级生产者浮游植物对浮游动物舌状叶镖水蚤()和太湖新银鱼()贡献比例分别为34.7%和19.6%; 沉水植物的贡献比例分别为16.4%和36.4%; 陆源碎屑的贡献比例分别为48.9%和44%。这一结果表明, 支持抚仙湖浮游动物的碳源主要为陆源碎屑与湖泊内部初级生产者, 而鱼类的碳源主要为陆源碎屑和沉水植物。
3 讨论
抚仙湖是半封闭外流湖泊, 流域内包含星云湖和抚仙湖两个天然湖泊, 除了接纳来自星云湖的部分水量外, 其余大部分水量是由分布在湖泊周围的数十条小型入湖河道以及坡面径流所汇入。流域内的工农业生产、旅游业的发展和森林砍伐已经对抚仙湖生态环境造成了严重影响, 由隔河相通的星云湖也有污水进入抚仙湖。进入湖泊生态系统的外源碳主要有两种形态: 颗粒有机碳(POC)和溶解有机碳(DOC)。这两类有机碳都可以为湖泊食物网提供碳源, 但是参与湖泊食物网碳循环的方式和途径各有不同。

图2 基于∆14C比值和δ13C比值运用IsoSource模型估算各碳源对抚仙湖消费者的贡献比例(均值及范围)
Figure 2 IsoSource modeling results based on the ∆14C and13C values, showing the proportional contribution % of each food source to consumers in lake Fuxian as mean and (1-99) percentiles
对于浮游动物而言, POC可以直接被浮游动物摄取[29, 30], 而DOC可以通过微生物利用转化为POC再被浮游动物所摄取[31]。一般而言, 细菌更偏向于利用低碳氮比(C:N)、易分解的内源有机碳, 因其食物质量较高; 同时外源性有机碳也是细菌生长、代谢的重要碳源。有研究发现, 低分子量的外源有机碳对细菌、原生动物和后生动物二级生产力的贡献率分别达到了80%、54%和23%, 这部分碳源通过浮游细菌能被传递至浮游动物和更高的营养级[32]。Pace等(2004)通过13C同位素标记实验对威斯康星州北部几个小型湖泊进行了研究, 发现22—50%的浮游动物碳源来自外源[33]。Cole等(2006)发现浮游动物利用外源有机碳的比例可达73%[30]。本研究所选浮游动物属桡足类, 可从水中滤食细小的食物如细菌、藻类和碎屑等, 可有效获取进入生态系统的外源碳。
进入系统的陆源DOC是细菌呼吸的主要补贴, 而陆源POC则能极大地补贴浮游动物和底栖无脊椎动物的生产, 陆地猎物也能为水生生态系统提供少量的碳源[30], 然后通过食物网传递到鱼类。Wang等(2012)发现, 在鄱阳湖春季低水位时, 陆源植物碎屑对鱼类的贡献率能达到33—93%[34]。在Karlsson等(2012)对小型腐殖质湖泊食物网的研究中, 发现陆源有机质支持了鱼类57%的生物量[7]。陆源植物碎屑对河流中鱼类的贡献率也可达44.4%—62.5%[35]。本研究中所选取的鱼类为优势种太湖新银鱼(), 通常认为其以大型浮游动物为主食[23], 能够通过摄食有效获取被浮游动物同化的外源有机碳。
尽管以解剖学为基础的研究表明太湖新银鱼以水蚤等浮游动物为食, 舌叶状镖水蚤主要以各类浮游生物为食。然而, 湖泊食物网存在营养传递效应, 浮游动物如舌叶状镖水蚤尽管主要以各类浮游生物为食, 而陆源输入的有机碳经过细菌分解后, 能够以DOC或POC的形式继续被原生动物利用并合成饱和与不饱和脂肪酸, 提高其食物营养价值。这些原生动物能够被后生浮游动物进一步摄食, 进入到浮游动物与鱼类食物当中。Kritzberg等在寡营养湖泊中的研究结果表明, 该湖40%—80%的细菌生物量的碳源来自于外源性有机碳[36]。与此同时, 细菌又是吞噬性微生物(如鞭毛虫和纤毛虫)和滤食性浮游动物(如大型枝角类)的良好食物, 而桡足类则可以选择性摄食纤毛虫和鞭毛虫。由此, 外源性DOC可通过被细菌转化为其生物量进入食物链, 并不断向更高营养级传递。这一广泛存在的现象构成了湖泊食物网碳循环的基础。同位素技术在食物网中的研究价值就在于能够揭示消费者碳源的初始端元碳, 因此是对消费者解剖结果的有力补充。此外, 我们在抚仙湖进行的13C同位素标记葡萄糖实验也表明, DOC进入湖泊后首先被细菌吸收利用, 而细菌吸收DOC后通过自身代谢作用形成细胞颗粒, 浮游甲壳类动物通过摄食细胞颗粒来获得外源DOC[37]。陈敬安等利用13C和14C方法示踪抚仙湖POC来源, 外源POC对湖泊POC贡献量比较可观, 特别是在北部湖区表层水体, 浮游藻类和沉水植物共计贡献湖泊POC的43%, 陆源POC贡献量达29%[38]。上述证据表明抚仙湖消费者食物来源显然并非仅限于浮游藻类。解剖学证据虽可以判断消费者主要食性, 但是也存在一定局限性, 例如原生动物等虽然能够被浮游动物摄食, 但在浮游动物的肠道内很难鉴别出原生动物, 因此解剖学证据与同位素技术研究结果可互为补充。
不同水体对外源性有机碳的依赖有明显差异.水体的营养状态是影响外源有机碳对水生态系统食物网的贡献大小的决定性因素之一。在贫营养和含腐殖质丰富的小型水体中, 初级生产力极低, 外源性有机碳对于食物网的物质循环和能量流动具有重要的影响; 然而在富营养化水体中, 较高的初级生产力会削弱消费者对外源有机碳的依赖。本研究中陆源碎屑对浮游动物和鱼类的贡献率相比其他碳源都高, 这与其它贫营养湖泊的研究结果相符[30, 33], 表明外源有机碳对贫营养湖泊中消费者生产力的贡献可能相对较高。
湖泊生态系统中的沉水植物可通过被浮游细菌与微生物食物网消耗, 或释放植物碎屑等途径来成为支持消费者生产的重要力量[39]。在修复后的五里湖中, 成年杂食性鱼类主要以大型沉水植物为食[40]。在鄱阳湖夏季高水位时, 沉水植物对鱼类的贡献率最低可达到34%—88%[34]。抚仙湖为高原断陷湖泊, 沿岸浅滩不发育, 挺水植物稀少, 高等植被以大型沉水植物为主。沉水植物主要生长在抚仙湖北岸, 分布区的平均水深为4.3 m, 分布面积约为3.2 km2, 共计12种, 隶属5科7属, 其中黑藻()、穗状狐尾藻(L.)和马来眼子菜()等为优势种[20], 这些沉水植物可以为鱼类提供重要碳源。抚仙湖鱼类资源丰富, 其中常见的云南倒刺鲃()、黄颡鱼()和鲫()等为杂食性鱼类[18], 可同时以浮游动物和水生植物为食, 有效获取沉水植物碳源。本研究所选取浮游动物的优势种舌状叶镖水蚤()作为滤食性浮游动物[41], 能从水中滤食沉水植物碎屑, 而鱼类优势种太湖新银鱼()则以大型浮游动物为主食[23], 从而获取被浮游动物同化的沉水植物碳源。
沉水植物对浮游动物与鱼类的贡献率存在差异, 原因可能与二者的食性和营养级的差异有关[23]。在贫营养的抚仙湖中, 外源碎屑的营养价值相对较低, 而浮游植物的生物量又不足以支撑浮游动物的食物需。抚仙湖禁渔期(4至8月)期间, 太湖新银鱼()较高的产量对浮游动物造成了较强的捕食压力, 使得浮游动物丰度在禁渔期呈现持续下降的趋势[42]。考虑到浮游动物的生物量不能够满足新银鱼的食物需求, 因此沉水植物作为初级生产者之一, 其腐烂分解后产生的有机物也能够对鱼类的碳源进行补贴。此外, 由于同位素的生物分馏作用, 生态系统中各营养级生物的13C比值通常有沿着食物链递增的趋势。这是因为偏重的同位素形成的化学键强、运动速度慢, 所以生物对轻碳同位素选择性优先利用[43], 当偏轻的同位素被优先代谢后, 偏重的同位素将更多地停留在生物体内, 随着营养级逐级富集, 因此消费者的13C比值通常比其食物来源高。由抚仙湖消费者和各食物来源的同位素特征关系(表2)可以看出, 鱼类比浮游动物拥有更高的13C比值, 说明鱼类比浮游动物富集了更多的13C, 而在3种食物来源中, 沉水植物的碳同位素值较高, 故表现出对鱼类更高的贡献。
沉积物可以作为湖泊浮游食物网的一个潜在营养源, 特别是通过微生物群落降解沉积物有机质, 这种营养释放可强烈影响生态系统的功能。湖泊“老碳”主要来源于冰川系统、冻土土壤以及湖泊沉积物, 通过再悬浮作用输送至水体中, 释放一部分“老碳”参与食物网碳循环。但对于深水湖泊而言, 尽管表层沉积物中的有机碳可以进入表层水体, 对上层湖水中悬浮 POC 贡献的额度十分有限(约3%)[25, 44]。抚仙湖中存在的唯一的“老碳”来源是沉积物中的有机碳, 但是这部分“老碳”并未参于湖泊浮游食物网碳循环。由此可知非冰川作用地区的湖泊即使有“老碳”存在, 相比较湖泊自身的初级生产, “老碳”对湖泊食物网的贡献微乎其微。抚仙湖位处于非冰冻圈区域, 一方面缺乏像冰川、冻土等“老碳”潜在输入渠道; 另一方面, 非冰川地区人类活动影响显著, 湖泊营养水平和初级生产力相对比较高。此外, 抚仙湖面积大、湖水深, 流域深层土壤中的年代老的有机碳很难进入湖泊, 入湖溪流携带的外源碳基本以现代陆源碎屑为主。相比之下, 在处于冰川作用区域的纳木错湖中, 浮游植物、沉水植物和外源有机碳等潜在食物来源和作为消费者的浮游动物均表现出古代14C特征, 表明有“老碳”进入湖泊食物网被消费者所利用[45]。
尽管抚仙湖目前仍为贫营养状态, 但由于人类活动影响, 其营养水平在过去20年呈现出明显的增长趋势[17]。随着人类活动和污染的加剧, 外源碳对抚仙湖食物网的影响也将日益显著。然而, 相比较外源有机碳, 湖内初级生产者含有更多的不饱和脂肪酸, 因而其食物质量更高[46]。可以预测未来若抚仙湖营养水平持续上升, 浮游动物的碳源组成将由更多的湖内初级生产者构成。随着气候变暖与人类活动加剧, 气温升高、流域内水文与植被特征的改变、陆表与水生生态系统之间营养盐、有机碳循环之间的相互作用都将对水生生态系统生物多样性和稳定性、食物网结构以及未来演化方向带来一系列重大影响, 因此深入了解水生态系统对气候与环境变化的响应需要我们未来长期的关注和探索。结合使用稳定碳同位素技术和放射性碳同位素技术, 已为湖泊食物网碳源追踪和水生态系统食物网的碳循环等方面的研究提供有效手段[11, 13], 未来也必将在研究各种水生态系统食物网时空背景下能量流动和生物体之间的相互关系上发挥关键作用。
4 结论
放射性14C同位素研究结果显示, 抚仙湖北湖区食物网14C组成呈现明显的现代碳特征。基于放射性同位素特征(∆14C)与稳定同位素特征(13C), 运用IsoSource混合同位素模型估算不同碳源对湖泊消费者的贡献的结果显示, 浮游动物的碳源主要是湖泊内部初级生产力以及陆源碎屑; 而鱼类的碳源则以沉水植物和陆源碎屑为主, 这与抚仙湖为贫营养湖泊, 具有较低的浮游植物生物量和丰富的沉水植物资源以及北部入湖河流携带了较多的外源物质进入湖泊等特征有关。湖泊沉积物虽然存在“老碳”, 但是这部分“老碳”目前并未参与到湖泊浮游食物网碳循环。
[1] VANDER ZANDEN M J, VADEBONCOEUR Y. Fishes as integrators of benthic and pelagic food webs in lakes[J]. Ecology, 2002, 83(8): 2152–2161.
[2] BERGGREN M, ZIEGLER S E, ST-GELAIS N F, et al. Contrasting patterns of allochthony among three major groups of crustacean zooplankton in boreal and temperate lakes[J]. Ecology, 2014, 95(7): 1947–1959.
[3] COOKE S L, FISCHER J M, KESSLER K, et al. Direct and indirect effects of additions of chromophoric dissolved organic matter on zooplankton during large-scale mesocosm experiments in an oligotrophic lake[J]. Freshwater Biology, 2015, 60(11): 2362–2378.
[4] VANDER ZANDEN M J, RASMUSSEN J B. Variation in delta N-15 and delta C-13 trophic fractionation: Implications for aquatic food web studies[J]. Limnology and Oceanography, 2001, 46(8): 2061–2066.
[5] POST D M. Using stable isotopes to estimate trophic position: Models, methods, and assumptions[J]. Ecology, 2002, 83(3): 703–718.
[6] SOLOMON C T, CARPENTER S R, CLAYTON M K, et al. Terrestrial, benthic, and pelagic resource use in lakes: Results from a three-isotope bayesian mixing model[J]. Ecology, 2011, 92(5): 1115–1125.
[7] KARLSSON J, BERGGREN M, ASK J, et al. Terrestrial organic matter support of lake food webs: Evidence from lake metabolism and stable hydrogen isotopes of consumers[J]. Limnology and Oceanography, 2012, 57(4): 1042–1048.
[8] MCCALLISTER S L, BAUER J E, CHERRIER J E, et al. Assessing sources and ages of organic matter supporting river and estuarine bacterial production: A multiple-isotope (delta C-14, delta C-13, and delta N-15) approach[J]. Limnology and Oceanography, 2004, 49(5): 1687–1702.
[9] ISHIKAWA N F, UCHIDA M, SHIBATA Y, et al. A new application of radiocarbon (C-14) concentrations to stream food web analysis[J]. Nuclear Instruments & Methods in Physics Research Section B-Beam Interactions with Materials and Atoms, 2010, 268(7-8): 1175–1178.
[10] 胡恩, 张振文, 王文科, 等. 老碳对水生态系统食物网的贡献[J]. 湖泊科学, 2018, 30(5): 1187–1195.
[11] ISHIKAWA N F, UCHIDA M, SHIBATA Y, et al. Natural C-14 provides new data for stream food-web studies: A comparison with C-13 in multiple stream habitats[J]. Marine and Freshwater Research, 2012, 63(3): 210–217.
[12] MAYORGA E, AUFDENKAMPE A K, MASIELLO C A, et al. Young organic matter as a source of carbon dioxide outgassing from amazonian rivers[J]. Nature, 2005, 436(7050): 538–541.
[13] HOOD E, FELLMAN J, SPENCER R G M, et al. Glaciers as a source of ancient and labile organic matter to the marine environment[J]. Nature, 2009, 462(7276): 1044– U1100.
[14] WANG Yang, GU Binhe, LEE Mingkuo, et al. Isotopic evidence for anthropogenic impacts on aquatic food web dynamics and mercury cycling in a subtropical wetland ecosystem in the us[J]. Science of the Total Environment, 2014, 487(2014): 557–564.
[15] 王苏民, 窦鸿身, 陈克造, 等. 中国湖泊志[M]. 北京: 科学出版社, 1998.
[16] 曾海鳌, 吴敬禄. 近50年来抚仙湖重金属污染的沉积记录[J]. 第四纪研究, 2007,27( 1): 128–132.
[17] 覃剑晖. 太湖新银鱼入侵高原深水贫营养湖泊-抚仙湖的生态学效应[D]. 武汉: 中国科学院水生生物研究所, 2005.
[18] 熊飞, 李文朝, 潘继征, 等. 云南抚仙湖鱼类资源现状与变化[J]. 湖泊科学, 2006, 18(3): 305–311.
[19] 刘晓曦, 陈丽, 蒋伊能, 等. 抚仙湖浮游植物群落时空变化特征及其与环境因子的关系[J]. 湖泊科学, 2020, 32(3): 793–803.
[20] 熊飞, 李文朝, 潘继征, 等. 云南抚仙湖沉水植物分布及群落结构特征[J]. 云南植物研究, 2006, 28(3): 277–282.
[21] 龚世园, 吴敏生, 金顶玄, 等. 富水水库太湖新银鱼食性的初步研究[J]. 水利渔业, 1999, 19(3): 9–11.
[22] 覃剑晖, 谢平, 徐军. 抚仙湖太湖新银鱼的生长特性及其渔业利用[J]. 水生生物学报, 2009, 33(2): 352–354.
[23] 刘正文, 朱松泉. 滇池产太湖新银鱼食性与摄食行为的初步研究[J]. 动物学报, 1994, 40(3): 253–261.
[24] BOSCHKER H T S, KROMKAMP J C, MIDDELBURG J J. Biomarker and carbon isotopic constraints on bacterial and algal community structure and functioning in a turbid, tidal estuary[J]. Limnology and Oceanography, 2005, 50(1): 70–80.
[25] ZIGAH P K, MINOR E C, WERNE J P, et al. An isotopic (delta C-14, delta C-13, and delta N-15) investigation of the composition of particulate organic matter and zooplankton food sources in lake superior and across a size-gradient of aquatic systems[J]. Biogeosciences, 2012, 9(9): 3663– 3678.
[26] ISHIKAWA N F, UCHIDA M, SHIBATA Y, et al. Carbon storage reservoirs in watersheds support stream food webs via periphyton production[J]. Ecology, 2014, 95(5): 1264– 1271.
[27] DICKSON L, BULL I D, GATES P J, et al. A simple modification of a silicic acid lipid fractionation protocol to eliminate free fatty acids from glycolipid and phospholipid fractions[J]. Journal of Microbiological Methods, 2009, 78(3): 249–254.
[28] PHILLIPS D L, GREGG J W. Source partitioning using stable isotopes: Coping with too many sources[J]. Oecologia, 2003, 136(2): 261–269.
[29] BRETT M T, KAINZ M J, TAIPALE S J, et al. Phytoplankton, not allochthonous carbon, sustains herbivorous zooplankton production[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(50): 21197–21201.
[30] COLE J J, CARPENTER S R, KITCHELL J, et al. Strong evidence for terrestrial support of zooplankton in small lakes based on stable isotopes of carbon, nitrogen, and hydrogen[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(5): 1975–1980.
[31] BERGGREN M, STROM L, LAUDON H, et al. Lake secondary production fueled by rapid transfer of low molecular weight organic carbon from terrestrial sources to aquatic consumers[J]. Ecology Letters, 2010, 13(7): 870– 880.
[32] 叶琳琳, 孔繁翔, 史小丽, 等. 富营养化湖泊溶解性有机碳生物可利用性研究进展[J]. 生态学报, 2014, 34(4): 779–788.
[33] PACE M L, COLE J J, CARPENTER S R, et al. Whole- lake carbon-13 additions reveal terrestrial support of aquatic food webs[J]. Nature, 2004, 427(6971): 240–243.
[34] WANG Yuyu, YU Xiubo, XU Jun, et al. Temporal variation of energy sources in a floodplain lake fish community[J]. Journal of Freshwater Ecology, 2012, 27(2): 295–303.
[35] SOTO D X, DECRU E, SNOEKS J, et al. Terrestrial contributions to afrotropical aquatic food webs: The congo river case[J]. Ecology and Evolution, 2019, 9(18): 10746– 10757.
[36] KRITZBERG E S, COLE J J, PACE M L, et al. Autochthonous versus allochthonous carbon sources of bacteria: Results from whole‐lake 13c addition experiments[J]. Limnology and Oceanography, 2004, 49(2): 588– 596.
[37] 孙欢, 张永东, 于谨磊, 等. 外源溶解性有机碳对抚仙湖甲壳类浮游动物碳源的贡献[J]. 湖泊科学, 2017, 29(4): 887–895.
[38] CHEN Jingan, YANG Haiquan, ZENG Yan, et al. Combined use of radiocarbon and stable carbon isotope to constrain the sources and cycling of particulate organic carbon in a large freshwater lake, china[J]. Science of the Total Environment, 2018, 625(2018): 27–38.
[39] DE KLUIJVER A, NING J, LIU Z, et al. Macrophytes and periphyton carbon subsidies to bacterioplankton and zooplankton in a shallow eutrophic lake in tropical china[J]. Limnology and Oceanography, 2015, 60(2): 375–385.
[40] YU Jinlei, LIU Zhengwen, HE Hu, et al. Submerged macrophytes facilitate dominance of omnivorous fish in a subtropical shallow lake: Implications for lake restoration[J]. Hydrobiologia, 2016, 775(1): 97–107.
[41] 肖利娟, 望甜, 韩博平. 流溪河水库的盔形溞和舌状叶镖水蚤对浮游植物的牧食影响研究[J]. 生态科学, 2008, 27(5): 362–367.
[42] 冯钟, 赵帅营, 陈丽, 等. 抚仙湖浮游动物群落分布特征及其影响因子分析[J]. 云南师范大学学报(自然科学版), 2018, 38(5): 56–65.
[43] PITT K A, CONNOLLY R M, MEZIANE T. Stable isotope and fatty acid tracers in energy and nutrient studies of jellyfish: A review[J]. Hydrobiologia, 2009, 616(1): 119–132.
[44] KEAVENEY E M, REIMER P J, FOY R H. Young, old, and weathered carbon-part 1: Using radiocarbon and stable isotopes to identify carbon sources in an alkaline, humic lake[J]. Radiocarbon, 2015, 57(3): 407–423.
[45] 高坛光, 康世昌, 张强弓,等. 青藏高原纳木错流域河水主要离子化学特征及来源[J]. 环境科学, 2008, 29(11): 3009–3016.
[46] CASHMAN M J, PILOTTO F, HARVEY G L, et al. Combined stable-isotope and fatty-acid analyses demonstrate that large wood increases the autochthonous trophic base of a macroinvertebrate assemblage[J]. Freshwater Biology, 2016, 61(4): 549–564.
Assessing carbon sources and their contributions to consumers in northern Lake Fuxian using radiocarbon and stable carbon isotope techniques
GAN Yingxin1,2,5, SU Yaling1, HU En3,4,*
1. State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China 2. University of Chinese Academy of Sciences, Beijing 100043, China 3. Chang'an University, Xi'an 710069, China 4. Shaanxi Academy of Environmental Sciences, Xi'an 710069, China 5. Power China Urban Planning and Design Research Institute Co., Ltd., Guangzhou 511457, Chin
Carbon isotopes can be used to identify food sources for aquatic consumers. Based on the signatures of radiocarbon isotopes (∆14C) and stable carbon isotopes (δ13C) of select consumers and their food sources in northern Lake Fuxian, the contribution of different carbon sources to these consumers was estimated using IsoSource modeling. The average δ13C value of phytoplankton, submerged plants and terrestrial detritus, the major food sources for consumers in Lake Fuxian, was -31‰, -13.5‰ and -29.4‰, and the Δ14C value was 101.5‰, 42.9‰ and 19.8‰, respectively. The average δ13C value of Phyllodiaptomus tunguidus and Neosalanx taihuensis, two major consumers of Lake Fuxian, was -27‰ and -23.5‰, while the Δ14C value of them was 52‰ and 44.2‰, respectively, indicating that the consumers in Lake Fuxian relied on primary production derived from modern carbon. The results of IsoSource modeling revealed that the contribution of phytoplankton to zooplankton and fish in Lake Fuxian was 34.7% and 19.6%, respectively. The contribution from submerged plants was 16.4% and 36.4%, and the contribution from terrestrial detritus was 48.9% and 44%, respectively. These findings indicated that the major carbon sources of zooplankton in Lake Fuxian were phytoplankton and terrestrial detritus, while those of fish were submerged plants and terrestrial detritus.
northern Lake Fuxian; food web; carbon source contribution; radiocarbon and stable carbon isotopes
10.14108/j.cnki.1008-8873.2022.02.002
Q148
A
1008-8873(2022)02-011-09
*注: 浮游植物的13C比值和∆14C比值分别由PLFAs的13C比值和DIC的∆14C比值指征。
2020-06-19;
2020-09-09
国家自然科学基金项目(31971475, 31670461)
甘颖欣(1995—), 女, 广东韶关人, 硕士研究生, 从事湖泊生物与生态学研究, E-mail: 742975689@QQ.com
通信作者:胡恩, 男, 博士, 高级工程师, 从事水域生态学研究, E-mail: huen777@163.com
甘颖欣, 苏雅玲, 胡恩. 利用放射性碳和稳定性碳同位素技术估算抚仙湖北部近岸湖区消费者的碳源贡献[J]. 生态科学, 2022, 41(2): 11–19.
GAN Yingxin, SU Yaling, HU En. Assessing carbon sources and their contributions to consumers in northern Lake Fuxian using radiocarbon and stable carbon isotope techniques[J]. Ecological Science, 2022, 41(2): 11–19.
——以武汉紫阳湖为例

