3D打印用纯钛粉末表面化学镀铜工艺研究
杨美晨,罗 豪,宋晶晶,刘成龙
(1.重庆理工大学 材料科学与工程学院, 重庆 400054; 2.重庆市计量质量检测研究院, 重庆 401123)
近年来,利用激光作为热源的3D打印技术制造轻质高性能钛合金零部件成为研究热点,尤其在航空航天、生物医学等领域。研究发现,由于激光固有的技术特点,打印过程中会产生较大的温度梯度、较高的凝固速率和反复的加热和冷却,最终成型的钛合金零部件微观结构为沿晶格特定方向生长的尺寸较大的柱状晶,柱状晶导致的各向异性降低了零部件的韧性和疲劳性能[1-2]。有效控制激光3D打印过程中柱状晶的形成成为一项重大的挑战。
3D打印过程中获得等轴晶的能力取决于驱动晶核形成与长大的因素,比如热条件与合金成分。对此,通过优化加工参数、后期热处理、金属或非金属元素掺杂等,研究人员积极探索实现3D打印钛合金零部件微观结构由粗大的柱状晶转变为细小的等轴晶,提升打印件的机械性能[1,3-6]。
研究发现,由于激光加工过程中固有的快速升温与快速冷却特点,仅通过优化加工参数或者后期热处理获得钛合金打印件的细小等轴晶较为困难。目前,基于温度梯度降低、液固界面生长速度下降有利于等轴晶形成的原理,更多研究关注添加有利于形核的金属或非金属元素实现等轴晶的形成,比如B、N、Si、Zr、Mo、La2O3、Y2O5等[4-8]。上述针对添加金属元素的研究,大多采用在打印粉末中掺杂金属粉末的方式实现。Zhang等[4]在3D打印纯钛粉末中引入8.5%质量分数的Cu,铜的加入不仅实现了柱状晶完全转变为等轴晶,而且实现了1~2个数量级的晶粒细化。Martin等[6]发现在7075铝合金打印粉末引入TiB2,在TC4打印粉末引入ZrH2等纳米颗粒形核剂进行表面修饰,可有效抑制3D打印过程中的粗大柱状晶生长,促进细小等轴晶的形成。Martin等[6]提出利用静电组装的方式,可实现纳米形核剂在3D打印金属粉末表面的均匀分布,为凝固进程提供高密度的异质形核点,更有利于等轴晶的形成。遗憾的是,作为一个技术秘密,在该团队发表的论文与专利中,对如何实现纳米形核剂在金属打印粉末表面的静电组装未作介绍。现有研究对钛合金块体材料表面化学镀铜开展了较多探索,与块体材料相比,粉末材料具有较大的比表面积。如何使纯钛粉末在镀液中均匀分散以及使镀液在高装载量条件下保持稳定性与一定的沉积速度,是重点关注的问题。
本文中重点研究了3D打印用纯钛粉表面化学镀铜,制备Ti-Cu复合粉末,通过对复合粉末表面形貌、成分等分析,探究了纯钛粉表面化学镀铜的优化工艺,以期对选区激光熔化打印钛及钛合金零部件提供有价值的参考。
1 实验材料及方法
1.1 实验材料
实验用原材料为中航迈特生产的TA0纯钛球形粉末,粉末形貌如图1所示,粒度范围为45~100 μm,主要成分详见表1。实验用试剂购于阿拉丁试剂网,纯度均为AR级。

图1 用于化学镀的 TA0粉末

表1 TA0纯钛粉末化学成分
1.2 化学镀铜
参考现有化学镀铜工艺[9-10],主要工艺如下:前处理包括除油、粗化、敏化、活化等步骤,利用NaOH,NaCO3混合溶液对纯钛粉进行超声分散清洗15 min,用去离子水清洗至中性。利用1∶3的HF与HNO3混合液对纯钛粉进行粗化,清洗至中性。使用胶体钯溶液一步法对纯钛粉末进行敏化活化处理,将适量氯化钯、氯化钠、氯化亚锡分别溶解为浓溶液,将氯化钯和氯化钠溶液混合均匀后,再加入氯化亚锡,搅拌至充分溶解,得到墨绿色的胶体钯敏化活化溶液,放入粗化处理后的纯钛粉,磁力搅拌一定时间后静置、过滤并清洗至中性。采用30 g/L的次亚磷酸钠溶液对敏化活化后的钛粉进行解胶处理,磁力搅拌一定时间后静置,过滤并清洗至中性。
采用次亚磷酸钠化学镀铜体系,设置合适的磁力搅拌转速,保持硫酸铜(6 g/L)、次亚磷酸钠(30 g/L)、柠檬酸钠(10 g/L)、硼酸(30 g/L)、硫酸镍的浓度不变,以装载量、亚铁氰化钾、温度和pH值作为变量,采用单一因素的控制变量法,以反应时间和镀层质量作为实验结果指标,探究TA0纯钛粉末表面化学镀铜的关键工艺参数。参数设置如表2所示。
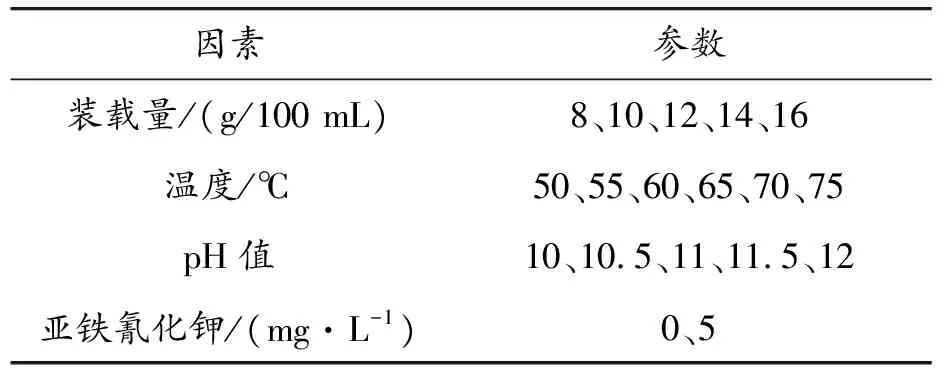
表2 化学镀铜各因素工艺参数设置
1.3 粉末表面形貌、成分及物相分析
利用带有能谱仪(EDS)的德国蔡司Oxford场发射扫描电镜(EBSD)分析粉末镀铜前后的成分和形貌变化;利用PA Nalytical Empyrean Series 2 型DX-2500 X射线衍射仪分析镀铜层的物相。
2 结果与分析
2.1 稳定剂的影响
保持镀液pH值为10.5,TA0粉末装载量为10 g/100 mL,考察未添加与添加5 mg/L亚铁氰化钾的化学镀铜效果。图2为Ti-Cu复合粉末的表面形貌与反应时间图。当镀液温度为60 ℃时,无稳定剂样品镀层表面呈灰棕色,如图2(a)所示;镀层中存在明显的大颗粒团聚,裂缝和孔洞较多,如图2(b)所示;加入稳定剂后镀层表面为红铜色,如图2(c)所示;镀层颗粒较小,表面较平整,无明显裂纹和孔洞,如图2(d)所示。此外,镀液中加入稳定剂后,在同一温度下反应各阶段所需时间大幅度增加。未使用稳定剂时,温度升高对各阶段反应时长影响较小;加入稳定剂后,各阶段反应时长总体增加,但随着温度的升高而降低。

图2 稳定剂对镀层表面形貌与反应时间图
2.2 TA0粉末装载量的影响
图3为TA0粉末装载量变化情况下镀铜层的表面形貌图及镀层厚度。随着装载量的增加,粉末表面的镀层质量越来越差,镀层越来越薄,由192.58±50 nm降至22.30±3 nm。当装载量为8~12 g/100 mL时,所制钛铜复合粉末表面颜色也多为粉色偏红铜色,镀层致密,包覆较为均匀,表面有大颗粒团聚;当装载量为14~16 g/100 mL时,镀层颜色开始发灰发暗,镀层出现不均匀、漏镀现象,并有裂缝出现,镀层结合力较差,存在脱落现象。
图4为TA0粉末装载量分别为12 g/100 mL和14g/100 mL时镀层的EDS结果,其中绿色表示铜元素分布,红色表示钛元素分布,表3为镀层元素原子百分比。可见,随着装载量的增加,镀铜层中包含的铜元素含量逐渐减少。分析认为,纯钛粉末装载量的增加使得待镀区域急剧增加,而溶液中铜含量有限,因此粉末表面镀层越来越薄,最终出现漏镀现象。

图3 装载量变化情况下铜镀层的表面形貌与厚度

图4 TA0粉末表面铜镀层形貌及元素分析结果

表3 TA0粉末装载量为12 g/100 mL和14 g/100 mL时形成的铜镀层元素含量
2.3 镀液pH值的影响
研究发现,当镀液pH值较低时,次磷酸钠体系反应较难发生,当pH值过高时,镀液不稳定易分解,副反应消耗溶液中的铜元素,导致粉末表面镀覆不均匀,合适的pH值既能提供反应所必需的OH-,又能提高反应速度[11]。因此合适的pH值对于次亚磷酸钠化学镀铜体系至关重要。
图5为镀液pH值变化情况下所制备的Ti-Cu复合粉末表面形貌。

图5 镀液pH值变化时的表面形貌与厚度
在制备过程中,观察发现,随着pH值的升高,镀层颜色逐渐发黑变暗。当pH值为10时,粉末表面为淡粉色,镀层整体镀覆不均匀,存在团聚与脱落现象,镀层厚度为76.31±9 nm;当pH值为10.5时,粉末表面为粉红色,镀层较均匀,但存在明显的孔洞与裂缝,镀层厚度为77.53±5 nm;当pH值为11时,粉末表面为粉红色,镀层致密,镀层厚度为81.31±13 nm;当pH值为11.5时,粉末表面为红铜色,镀层致密,镀层厚度为79.07±3 nm;当pH值为12时,粉末呈棕黑色,镀层存在明显孔洞、镀层剥离现象。
可见,TA0粉末表面化学镀铜的镀液pH值的临界值为11。分析认为,随着pH值增大,表面镀层质量逐渐变差。pH值较低时,镀液中次亚磷酸钠的还原能力有限,镀液中部分铜离子不能及时被置换出来而随镀液一起流失;随着pH值升高,镀液中的OH- 含量逐渐增加,镀层厚度略微增加。当pH值过高时,溶液中副反应加剧,铜离子易形成Cu2O而消耗掉;同时Cu2O可作为新的形核中心点,吸附游离的铜离子并将其还原为铜单质,或沾附于复合粉末表面,或随镀液流失[11]。
2.4 镀液温度的影响
如图6所示,在制备过程中,观察发现,当温度为60 ℃时,粉末表面镀层颜色最接近红铜色。当反应温度为50 ℃时,镀层表面呈淡粉色,镀层中存在大量的孔洞。当反应温度为55 ℃时,粉末呈粉色,镀层中孔洞减少,但表面有明显的凸起。随着温度的升高,物质传递加快,镀铜反应越来越快。当温度达到60 ℃时,粉末呈铜色,镀层变得相对平滑,无明显孔洞。当温度达到65 ℃时,粉末呈灰粉色,镀层开始出现团聚现象。当温度继续升高到70 ℃时,粉末表面开始发暗,镀层中出现团聚颗粒与脱落;当温度为75 ℃时,粉末呈黑棕色,镀层较完整但整体粗糙疏松,致密性较差,包覆效果较差并伴有脱落现象。

图6 溶液温度变化时的镀层形貌
由图7可知,当温度为50 ℃时,反应的发育期约110 min,总反应时间约490 min。当温度为60 ℃时,反应时间已大幅度降低,发育期缩短至50 min,总反应时长约151 min。随着温度的进一步升高,发育期时长与总时长持续缩短,当温度到达70 ℃以后,温度对镀铜反应的促进作用减小,各阶段反应时长略有缩短。分析认为,次亚磷酸钠化学镀铜体系反应受温度影响较大。在低温下能量低,传质慢,整体反应速度低,镀铜速率也明显较慢,所需反应时间较长。在高温下能量高,金属离子活动性强,传质迅速,反应快速,所需反应时间较少,但是在高温下镀液的不稳定性也将加剧,镀液的不稳定将导致镀层质量受到影响[12]。当温度低于55 ℃时,反应速度较慢,镀层颜色偏粉色,但因为存在漏镀现象,呈现较为暗淡的粉色。随着温度升高,反应速率加快,镀层的生长速度加快,镀层变得致密;当温度高于70 ℃时,镀液中粒子运动速度过快,碰撞加剧,氢气的释放速率快,导致镀层粗糙疏松。同时温度过高易导致镀液的自分解,温度越高,副反应越剧烈,生成的杂质也越多,镀层颜色逐渐变黑。

图7 温度对TA0粉末表面化学镀铜各阶段反应时间的影响曲线
2.5 工艺参数变化对化学镀铜层物相结构的影响
工艺参数变化对铜镀层物相的影响曲线如图8所示。根据单质铜的PDF卡片(Cu-04-0839)可知,单质铜的三强峰出现在2θ角为43.297°、50.433°、74.130°三处,分别为(111)、(200)、(220)晶面。结果表明,在XRD衍射图谱中只存在Ti和Cu的衍射峰,说明镀层的纯度较高。
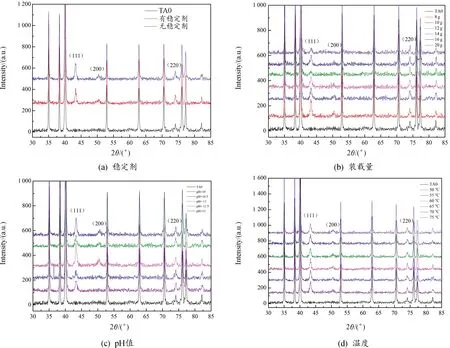
图8 工艺参数变化对铜镀层物相的影响曲线
由图8(a)可知,镀液中加入稳定剂后,(111)和(200)晶面的衍射峰强度明显降低,存在一定程度的(220)晶面择优取向生长。装载量显著影响了镀层的厚度,装载量增加导致镀层厚度减少,铜元素的衍射峰降低,如图8(b)所示。同时,镀层中铜元素(111)和(200)晶面的衍射强度随着pH值的增大先增大后减小,在pH值为11时衍射峰强度最高。当pH值较低时,(111)和(200)晶面有较为明显的择优生长,如图8(c)所示;而温度对镀层的晶面择优取向生长影响不大,(111)、(200)和(220)3个晶面的衍射峰无明显变化,如图8(d)所示。
图9为镀制不同阶段Ti-Cu复合粉末的表面形貌。根据形貌变化,铜镀层在TA0粉末表面的形成过程可大致分为3个阶段,形核孕育期、自动催化期及前沿汇合期[13-14]。

图9 在不同镀制阶段铜镀层在钛粉表面的形貌变化
在初始阶段,少量细小的铜颗粒首先沉积在钛粉表面凹槽处,此处易吸附镀液中的活性中心,促使Cu2+优先在此进行氧化还原反应,如图9(a)所示。随后,沉积颗粒形核长大,同时在钛粉表面沉积的铜颗粒越来越多,相邻颗粒之间开始堆叠形成铜胞,如图9(b)所示;随着镀铜反应进行,如图9(c)所示,铜胞越来越多并产生融合,钛粉表面出现大面积铜层,但仍存在未镀区域;由图9(d)可知,反应进行一定时间后,钛粉表面基本被初始铜层覆盖。此时,钛粉表面的Pd2+活性中心被覆盖,镀液中的游离Ni2+开始发挥催化作用,后续铜颗粒以沉积铜颗粒为形核中心在初始铜层上沉积生长[14];此过程不断重复,越来越多的铜胞在横向和纵向上融合,形成完整、致密、均匀的镀层,如图9(f)所示。
3 结论
1) 采用化学镀铜技术可以成功制备Ti-Cu复合粉末,镀层均匀致密,不含氧化物杂质。
2) 在实验参数设计范围内,5 mg/L次亚磷酸钠的添加有利于提升铜镀层的致密度与均匀性;装载量为12 g/100 mL时可获得质量最好的铜镀层,装载量过小,镀层过于厚重,易脱落,装载量过大则易导致镀覆不均,出现漏镀现象。
3) TA0粉末化学镀铜的镀液pH值的临界值为11,临界温度为60 ℃。pH值较低(10~10.5)时,化学镀反应较慢;当pH值大于11,镀液易自分解失效,镀覆不均。当镀液温度在50~65 ℃时,反应所需时间长达490 min;温度升高,反应速率增大,镀层均匀;当镀液温度超过70 ℃时,反应速度过快导致镀覆不均,镀层结合力下降并出现脱落。
4) 基于化学镀铜层质量与反应时长、成本等综合考虑,确定在本试验中钛粉表面化学镀铜的优化工艺参数为:硫酸铜为6 g/L,次亚磷酸钠为30 g/L,柠檬酸钠为10 g/L,硼酸为30 g/L,稳定剂为5 mg/L,装载量为12 g/100 mL,适宜温度为 60 ℃,pH值为11。

