缬沙坦/氨氯地平通过调控miR-21对心肌缺血/再灌注损伤大鼠的保护作用及机制研究
秦少博,黄增刚
(1.西安市第一医院心血管内科,陕西 西安 710002;2.安康市中医医院制剂中心,陕西 安康 725000)
心肌缺血/再灌注损伤(Myocardial ischemia reperfusion injury,MIRI)是指心肌组织缺血后恢复血流灌注而发生的心肌组织损伤加重甚至出现不可逆性损伤的病理过程,可加重心功能障碍和心肌结构的破坏,严重威胁患者的生命健康安全[1]。MIRI的发生机制尚不明确,目前研究[2-3]认为其病理生理过程涉及氧自由基增多、炎性细胞因子过表达、钙超载和能量代谢障碍等,故目前临床防治MIRI主要通过抑制炎性反应、抗氧化、减轻钙超载和能量代谢障碍以及保护血管内皮细胞等途径[4]。缬沙坦/氨氯地平为血管紧张素受体拮抗剂(Angiotensin receptor blockers,ARBs)缬沙坦与钙通道阻滞剂(Calcium channel blockers,CCBs)氨氯地平的复方制剂,临床广泛应用于原发性高血压的治疗。临床实验[5]表明,ARBs具有抗炎、抗心肌细胞凋亡、抗动脉粥样硬化和对抗梗死后交感神经重构等作用,已逐步成为各类心血管疾病的常用治疗药物之一。CCBs具有抗炎、抗氧化应激、改善血管内皮功能和中性粒细胞聚集的作用,并可通过阻断钙离子跨膜转运,改善钙超载[6]。既往研究[7]还发现,ARBs和CCBs类药物除发挥降压作用,具有独立于该作用之外改善心率变异性、逆转左心室肥厚、缩短动脉粥样硬化斑块等靶器官保护作用,对存在靶器官损伤的高血压患者疗效更好。微小RNA(microRNA,miRNA)是一类高度保守的短链内源性非编码RNA,成熟的miRNA可与靶mRNA的3’端非编码区(3’-Untranslated regions,3’-UTR)相结合,沉默或降解靶基因,进而调控基因的表达,在调节细胞生长、发育、增殖、分化和凋亡过程中均起重要作用[8]。已有多项研究[9-10]认为,miR-21参与了多种心血管系统疾病、免疫系统疾病及恶性肿瘤的发生发展,通过细胞凋亡和自噬途径,调控心律失常、心肌肥厚、心肌细胞损伤等多个生理病理过程。然而,缬沙坦/氨氯地平对MIRI有无疗效、miR-21是否参与了MIRI的病程、其具体分子机制如何,目前鲜有报道。因此,本研究通过给予MIRI模型大鼠缬沙坦/氨氯地平,观察其对大鼠心肌组织的保护作用,并探究其可能的作用机制,以期为临床治疗MIRI提供新的方向。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:选取健康雄性SPF级SD大鼠30只,8周龄,体重(180±10)g,西安微元生物医药研究所有限公司,许可证号:SYXK(陕)2020-006,常规饲养于洁净动物房内,恒温恒湿,正常昼夜交替,自由摄食摄水。
1.1.2 药品及试剂:缬沙坦/氨氯地平片(80 mg/5 mg,国药准字J20150135);注射用青霉素钠80万U(国药准字H20033934);水合氯醛、DMSO、RIPA裂解液(上海碧云天生物技术有限公司);DMEM、胎牛血清、胰蛋白酶、MTT(美国Gibco);BCA蛋白测定试剂盒、Trizol试剂、逆转录试剂盒(Invitrogen公司);抗过氧化物酶体增殖物激活受体γ辅激活因子1α(Peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)抗体、核呼吸因子1(Nuclear respiratory factor 1,NRF1)抗体、线粒体转录因子A(Mitochondrial transcription factor A,TFAM)抗体(美国Sigma公司)。
1.1.3 主要仪器:超低温冰箱、细胞培养箱(美国Thermo Scientific公司);超净工作台(北京东联哈尔仪器制造有限公司);电子天平(瑞士METTLERTOLEDO公司);石蜡组织切片机(德国Leica公司);激光共聚焦显微镜(尼康仪器有限公司);实时荧光定量PCR仪(美国Bio-Rad公司);紫外分光光度仪(日本岛津公司)。
1.2 实验方法
1.2.1 分组及MIRI模型建立:将30只大鼠随机分为假手术组、模型组和治疗组,每组10只。模型组和治疗组均建立MIRI模型:腹腔注射10%水合氯醛溶液,待麻醉效果满意后固定大鼠于手术台上,气管插管接呼吸机辅助呼吸,胸部备皮,碘伏常规消毒,胸腔正中切1.5~2 cm切口,剪开心包,用无损伤线结扎冠状动脉左前降支30 min,剪断扎线,恢复血流灌注,建立MIRI模型。假手术组仅开胸,不结扎。术后腹腔注射80万U/d青霉素预防感染,连续注射3 d。灌胃给予治疗组30 mg/kg的缬沙坦/氨氯地平药物混悬液,假手术组和模型组给予等体积的生理盐水,共连续给药8周。
1.2.2 取样及处理:治疗结束后,颈椎脱臼处死大鼠,碘伏消毒,打开胸腔,断开肋骨,取出整个心脏,分离左心室,冰冷的无菌PBS洗涤,立即称重后置于-80 ℃冻存备用。
1.2.3 心肌组织形态学观察:取各组部分心肌组织,10%甲醛溶液固定,乙醇脱水,石蜡包埋,切5 μm厚连续切片,HE染色,中性树胶封片,于光学显微镜下观察心肌组织形态学变化。
1.2.4 心肌梗死面积比例:取各组部分心肌组织病理切片,称重,沿白色心肌梗死区域边缘切下梗死心肌组织,称重,计算梗死心肌占总心肌的比例。
1.2.5 心肌细胞生存率:取各组部分心肌组织,剪碎,匀浆,RIPA裂解液裂解消化,用DMEM+10%胎牛血清培养基,置于37 ℃、5%CO2细胞培养箱中培养,胰蛋白酶消化传代培养至第三代,用PBS调整细胞悬液计数为1×106个/ml,接种于96孔板,每孔100 μl,每组各设置6个复孔,继续置于培养箱内培养24 h。取出培养板,每孔加入10 μl浓度为5 mg/ml的MTT溶液,继续孵育4 h后吸弃上清,加入DMSO溶解结晶,震荡10 min,于490 nm波长下测定各孔吸光度值(OD)。
1.2.6 各组心肌组织中miR-21和PGC-1α、NRF1、TFAM mRNA的相对表达:分别取各组心肌组织,称重,冰冷水浴中剪碎、研磨,采用Trizol试剂提取各组中的总RNA,于260 nm和280 nm波长下测定吸光度A,计算纯度和浓度。用逆转录试剂盒将总RNA逆转录为cDNA进行PCR反应,反应条件如下:95 ℃预变性2 min;95 ℃变性20 s、65 ℃退火延伸15 s共38个循环。以u6作为内参,采用2-△△CT法计算各组中miR-21和PGC-1α、NRF1、TFAM mRNA的相对表达量,引物序列见表1。

表1 引物序列
2 结 果
2.1 心肌组织形态学观察 模型组大鼠心肌组织可见心肌纤维和间质坏死,大量炎性细胞浸润,间质水肿,心肌纤维化,嗜酸性粒细胞增强,大量心肌细胞核呈现碎裂或变性状。治疗组心肌组织形态基本趋于正常,心肌纤维基本排列整齐,可见少量炎性细胞浸润,间质水肿明显改善,心肌细胞胞浆染色较为均匀。假手术组大鼠心肌组织基本正常,可见极少量炎性浸润,心肌细胞形态正常。见图1。

A:假手术组;B:模型组;C:治疗组
2.2 各组大鼠心肌梗死面积比例比较 三组大鼠心肌梗死面积比例相比具有统计学差异(均P<0.05);三组之间两两相比,模型组心肌梗死面积比例显著高于假手术组(均P<0.05);治疗组心肌梗死面积比例显著低于模型组(P<0.05)。见表2。

表2 各组大鼠心肌梗死面积比例比较(%)
2.3 各组大鼠心肌细胞生存率比较 三组大鼠心肌细胞生存率相比差异具有统计学意义(F=516.857,P<0.05);三组之间两两相比,模型组心肌细胞生存率显著低于假手术组(均P<0.05);治疗组心肌细胞生存率显著高于模型组(P<0.05)。见图2。
2.4 各组大鼠心肌组织中miR-21相对表达比较 三组心肌组织中miR-21的相对表达比较具有统计学差异(F=78.375,P<0.05);三组之间两两相比,模型组心肌组织中miR-21的相对表达显著高于假手术组(均P<0.05);治疗组心肌组织中miR-21的相对表达显著低于模型组(P<0.05)。见图3。
2.5 各组大鼠心肌组织中PGC-1α、NRF1、TFAM mRNA表达比较 三组大鼠心肌组织中PGC-1α、NRF1和TFAM mRNA的相对表达比较具有统计学差异(均P<0.05);三组之间两两相比,模型组心肌组织中PGC-1α、NRF1和TFAM mRNA的相对表达显著低于假手术组(均P<0.05);治疗组心肌组织中PGC-1α、NRF1和TFAM mRNA的相对表达显著高于模型组(P<0.05)。见表3。

注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05

注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05
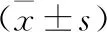
表3 各组大鼠心肌组织中PGC-1α、NRF1、TFAM mRNA表达比较
3 讨 论
缺血性心脏病目前已成为威胁人类生命健康的主要心血管疾病之一,尽快恢复缺血区血流灌注为最主要的治疗方法,然而,MIRI为临床治疗缺血性心脏病过程中最常见的病理损伤之一,可导致患者出现心肌梗死面积扩大、心功能下降、心律失常甚至猝死,严重影响缺血性心脏病患者的预后和生命安全[11]。
既往研究[12]认为,MIRI可能与血管内皮细胞(Endothelial cell,EC)功能障碍有关,EC释放的一氧化氮(Nitric oxide,NO)在心血管生理病理进程中发挥至关重要的作用,冠脉血管内皮源性NO释放的减少可能是EC功能障碍发生的主要早期事件。氨氯地平、硝苯地平、拉西地平等CCBs类药物与血管内皮依赖性舒张功能密切相关,可通过调节NO活性、促进NO的释放而发挥保护心脏的作用;此外,CCBs还可阻碍心肌组织和血管平滑肌的钙离子的跨膜转运,抑制钙离子内流,改善钙超载[13]。Guo等[14]在高胆固醇血症模型大鼠的体内试验中发现,缺血期给予氨氯地平可显著上调内皮型一氧化氮合酶(Endothelial nitric oxide synthase,eNOS)、下调诱导型一氧化氮合酶(Inducible nitric oxide synthase, iNOS),下调灌注早期NOS和iNOS的表达水平,纠正血管EC功能失调,从而发挥保护缺血缺氧心肌的作用。缬沙坦作为ARBs的代表药物,具有降血压,逆转血管重塑和左心室,保护肾功能,预防心力衰竭、心肌梗死后心脏和血管的重构等作用,已成为众多心血管疾病的常用药物之一。基础研究[15]表明,在心肌缺血/再灌注过程中,心肌组织和血液循环中的肾素-血管紧张素系统(Renin-angiotensin system,RAS)被激活,心肌组织和血液中的AngⅡ大量释放,其可诱导心肌细胞内钙超载,增加能量消耗,降低NOS的活性,从而损伤血管内皮细胞和心肌细胞。而ARBs可选择性、竞争性的与血管紧张素Ⅱ1型受体(Angiotensin Ⅱ type 1 receptor,AT1)结合,从而阻滞AngⅡ所介导的生物学效应,保护心肌细胞,减小心肌梗死面积。除此之外,ARBs可借助于其结构中的酚醛基团发挥清除自由基的功能,从而起到抗炎作用[16]。
本研究中,HE染色结果显示模型组大鼠心肌组织可见心肌纤维和间质坏死,炎性细胞浸润和间质水肿明显,嗜酸性粒细胞增强,大量心肌细胞核呈现碎裂或变性状,而治疗组大鼠心肌组织的上述表现明显改善,心肌形态趋于正常,仅可见少量炎性细胞浸润和间质水肿;比较各组大鼠心肌梗死面积,发现模型组大鼠心肌梗死面积比例显著高于假手术组,而治疗组的心肌梗死面积比例较模型组显著降低;此外,模型组大鼠心肌细胞生存率显著低于假手术组,而治疗组的心肌细胞生存率显著高于模型组,上述结果均提示缬沙坦/氨氯地平可显著改善MIRI模型大鼠心肌组织的病理损伤,减少心肌梗死面积以及MIRI引起的心肌细胞凋亡。
miRNA是一类长度约为20~24个核苷酸的高度保守的内源性单链非编码RNA,是真核生物体内重要的调控基因表达的分子,可通过沉默靶基因,影响翻译过程,从而抑制蛋白的表达,对细胞的增殖、分化、凋亡、坏死及自噬等等诸多方面产生巨大的影响[17]。MIRI是一种涉及心肌细胞凋亡、坏死、自噬等复杂的病理生理过程,往往伴随着多种miRNA的异常表达。miR-21作为一种广泛存在于机体组织器官中且靶基因众多的miRNA,近年来的不断深入研究[18-19]表明,其在急性冠脉综合征、心力衰竭、高氧性急性肺损伤(Hyperoxi induced acute lung iniury,HALI)、心肌细胞氧化应激、MIRI、肝脏和肾脏缺血再灌注损伤等多种疾病的发生发展中均呈现异常表达。李童等[20]研究发现,MIRI模型大鼠心肌组织中miR-21、miR-126的表达显著上调。Olson等[21]的研究表明,miR-21可通过作用于靶基因PDCD4来调控缺血/再灌注损伤及心肌细胞氧化应激。本研究结果同样显示,模型组大鼠心肌组织中miR-21的相对表达显著高于假手术组,提示miR-21可能参与了MIRI的病理进程;而经缬沙坦/氨氯地平治疗后,治疗组大鼠心肌组织中miR-21的相对表达显著降低,提示缬沙坦/氨氯地平可通过调控miR-21的表达而发挥对MIRI大鼠心肌的保护作用。
进一步的机制通路研究发现,MIRI模型大鼠心肌组织中的miR-21的下游关键基因PGC-1α、NRF1和TFAM mRNA的相对表达均显著低于假手术组;而经缬沙坦/氨氯地平治疗后,治疗组大鼠心肌组织中PGC-1α、NRF1和TFAM mRNA的相对表达显著升高。PGC-1α为氧化磷酸化、三羧酸循环及脂肪酸氧化的最主要转录因子之一,可通过影响线粒体的生物合成和生理功能,并同时辅助活化NFR1和NFR2,提高心肌细胞在环境变化时对能量需求的变化[22]。Tran等[23]通过敲除小鼠的PGC-1α基因,发现小鼠肾脏对缺血的耐受力明显减弱,小鼠肾功能与PGC-1α的表达呈正相关。NRF1可通过调节核基因组编码呼吸链亚基的表达和调控TFAM的途径影响基因组的转录和翻译等[24]。TFAM可通过调节线粒体DNA(mitochondria NDA,mtDNA)的轻链和重链的转录从而调控miRNA的转录和复制[25]。本研究结果提示miR-21及其下游基因可能参与了MIRI的调控,而通过上调PGC-1α、NRF1和TFAM mRNA的相对表达可对MIRI大鼠的心肌组织发挥保护作用。
综上所述,缬沙坦/氨氯地平对MIRI 模型大鼠的心肌组织具有良好的保护作用,其机制可能与下调miR-21的表达而上调其下游基因基因PGC-1α、NRF1和TFAM的表达有关,对miR-21表达的调控有望成为临床治疗MIRI的新靶点之一。

