芳氧基取代的邻苯二腈衍生物的合成研究
丁 茯, 姚 佳, 陈伟楠, 陈 卓, 姚美任, 王东平, 王康军
(沈阳化工大学 化学工程学院, 辽宁 沈阳 110142)
金属酞菁是18-π电子共轭的芳香大环平面化合物,其结构易于修饰,可以通过引入不同的中心金属原子以及不同取代位置(α-位或β-位)和性质的官能团,获得性能各异的金属配合物.此外,金属酞菁还具有易于合成、合成成本低、稳定性好(化学、光和热)以及优良的光电性能等优点,因此被广泛用于太阳能电池[1-2]、医学治疗[3]、化学传感器[4]、催化[5]等领域.尤其是,芳氧基取代的金属酞菁具有更易于修饰、易溶于多种有机溶剂而方便应用等特点,受到科学家们的广泛关注[1-4].例如:近年来芳氧基取代的金属酞菁开始逐渐应用于第三代太阳能电池,光电转换效率接近20%,有望取代硅基太阳能电池,实现工业化应用[6-9].目前,芳氧基取代的金属酞菁的合成主要采用经典的钼酸铵或1,8-二氮杂二环[5.4.0]十一碳-7-烯(DBU)催化的邻苯二甲腈法[3],因此,对关键原料芳氧基取代的邻苯二甲腈的合成方法研究十分必要.
脂肪族亲核取代反应(SN1和SN2)中的离去基团通常是卤素原子或是磺酸基团,而硝基基团很难离去.但是当硝基连接在缺电子的芳香环时,则是特别好的离去基团,离去能力超过卤素原子和磺酸基团,容易发生芳香族亲核取代反应(SNAr).因此,硝基取代的邻苯二腈易于与种类众多的亲核试剂苯酚衍生物发生亲核取代反应,从而获得一系列的芳氧基取代的邻苯二腈.但是相对于受到广泛研究的脂肪族亲核取代反应,对芳香族亲核取代反应,尤其是硝基作为离去基团的反应的研究很有限,其也受溶剂、碱性、温度、反应物的物质的量的比和时间等反应条件的影响.因此,本文研究了不同反应条件对苯酚衍生物分别与3-硝基邻苯二腈和4-硝基邻苯二腈发生芳香族亲核取代反应的影响,期望获得通用的高产率反应条件.
1 实验部分
1.1 主要试剂和仪器
3-硝基邻苯二腈(AR)和4-硝基邻苯二腈(AR),国药集团化学试剂有限公司;对叔丁基苯酚(AR)和对丁氧基苯酚(AR),上海阿拉丁生化科技股份有限公司;薄层层析硅胶板,烟台江友硅胶开发有限公司.对丁硫基苯酚参照文献[10]合成.ARX-500型核磁共振波谱仪(CDCl3溶剂,TMS内标),美国Bruker;LC-20A型液相色谱仪,日本Shimadzu;XDB-C18型色谱柱(0.46 cm i.d.x 25 cm),美国Agilent Eclipse.
1.2 合成路线
合成路线如图1所示.
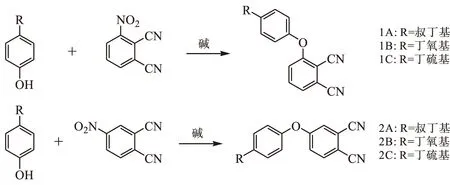
图1 合成路线Fig.1 Synthesis route
1.3 芳氧基邻苯二腈衍生物的合成
以3-硝基邻苯二腈和对叔丁基苯酚为模型反应,采用优化后的反应条件,具体如下:在室温下将3-硝基邻苯二甲睛(5.19 g,30 mmol)和对叔丁基苯酚(4.96 g,33 mmol)溶于DMF(60 mL)中,加入K2CO3(8.29 g,60 mmol),然后将所得溶液加热至65 ℃,反应6 h.反应结束后,加入蒸馏水(500 mL),产生大量的沉淀.过滤,将滤饼60 ℃真空干燥,得到粗产品.滤液用乙酸乙酯萃取,分离有机相,有机相用无水硫酸钠干燥、过滤、旋干,得另一部分粗产品.合并上述两部分粗产品,然后通过快速硅胶柱层析法分离提纯(流动相:二氯甲烷),收集所要产品组分,蒸除溶剂并干燥后得到白色固体3-(4-叔丁基苯氧基)邻苯二腈(1A)7.98 g,产率为96.2%.1H-NMR(500 MHz,CDCl3),δ:1.37(s,9H,tert-Bu),7.05(d,2H,tert-BuArH),7.12(d,1H,CNArH),7.47(m,3H,CNArHandtert-BuArH),7.57(t,1H,CNArH).
以3-硝基邻苯二腈和4-丁氧基苯酚为原料,步骤与模版反应一致,得到3-(4-丁氧基苯氧基)邻苯二腈(1B)7.78 g,产率为88.7%.1H-NMR(500 MHz,CDCl3),δ:1.00(t,3H,CH2CH2CH2CH3),1.52(m,2H,CH2CH2CH2CH3),1.79(m,2H,CH2CH2CH2CH3),3.98(t,2H,CH2CH2CH2CH3),6.95(d,2H,BuOArH),7.03(d,3H,CNArHand BuOArH),7.42(d,1H,CNArH),7.53(t,1H,CNArH).
以3-硝基邻苯二腈和4-丁硫基苯酚为原料,步骤与模版反应一致,得到3-(4-丁硫基苯氧基)邻苯二腈(1C)8.47 g,产率为91.6%.1H-NMR(500 MHz,CDCl3),δ:0.96(t,3H,CH2CH2CH2CH3),1.49(m,2H,CH2CH2CH2CH3),1.66(m,2H,CH2CH2CH2CH3),2.95(t,2H,CH2CH2CH2CH3),7.04(d,2H,BuSArH),7.11(d,1H,CNArH),7.41(d,2H,BuSArH),7.47(d,1H,CNArH),7.58(t,1H,CNArH).
以4-硝基邻苯二腈和4-叔丁基苯酚为原料,步骤与模版反应一致,得到4-(4-叔丁基苯氧基)邻苯二腈(2A)7.88 g,产率为95.1%.1H-NMR(500 MHz,CDCl3),δ:1.37(s,9H,tert-Bu),7.01(d,2H,tert-BuArH),7.27(s,2H,CNArH),7.48(d,2H,tert-BuArH),7.73(d,J=9.2 Hz,1H,CNArH).
以4-硝基邻苯二腈和4-丁氧基苯酚为原料,步骤与模版反应一致,得到4-(4-丁氧基苯氧基)邻苯二腈(2B)8.02 g,产率为91.4%.1H-NMR(500 MHz,CDCl3),δ:1.00(t,3H,CH2CH2CH2CH3),1.52(m,2H,CH2CH2CH2CH3),1.80(m,2H,CH2CH2CH2CH3),3.98(t,2H,CH2CH2CH2CH3),6.92~7.02(m,4H,BuOArH),7.16~7.25(m,2H,CNArH),7.69(d,1H,CNArH).
以4-硝基邻苯二腈和4-丁硫基苯酚为原料,步骤与模版反应一致,得到4-(4-丁硫基苯氧基)邻苯二腈(2C)8.55 g,产率为92.4%.1H-NMR(500 MHz,CDCl3),δ:0.95(t,3H,CH2CH2CH2CH3),1.49(m,2H,CH2CH2CH2CH3),1.66(m,2H,CH2CH2CH2CH3),2.95(t,2H,CH2CH2CH2CH3),7.00(d,2H,BuSArH),7.22~7.29(m,2H,CNArH),7.40(d,2H,BuSArH),7.73(d,1H,CNArH).
2 结果与讨论
2.1 苯酚衍生物与硝基邻苯二腈的芳香族亲核取代反应
2.1.1 溶剂对芳香族亲核取代反应的影响
以廉价的对叔丁基苯酚为代表性的亲核试剂,在碱性条件下分别与3-硝基邻苯二腈和4-硝基邻苯二腈发生反应,考察溶剂对反应的影响.由表1可知:在极性质子溶剂MeOH中的反应产率最低,为50%左右;在非质子中极性溶剂二氧六环中的产率达到76%左右;在非质子大极性溶剂DMF和DMSO中的产率超过82%.此外,通过薄层色谱层析(TLC)跟踪发现:在MeOH中仍有较多未反应完的原料;在二氧六环中,有少量的原料残余;而在DMF和DMSO中,原料全部转化完.苯酚衍生物在碱性条件下生成芳氧基负离子,在质子溶剂中易被溶剂分子包围产生溶剂化作用,不利于发生亲核取代反应,因此在MeOH中的反应效果不佳.此外,芳香族亲核取代反应中第一步决速步骤的Meisenheimer型中间体带负电荷,增加极性,有利于带负电荷的中间体解离生成目标产物,所以在极性更大的DMF和DMSO中的反应效果更好.另外,由于DMSO易吸潮,且在工业上比较难于回收再利用,因此,优选的溶剂是DMF.
2.1.2 碱对芳香族亲核取代反应的影响
碱在芳香族亲核取代反应中起到至关重要的作用,因为它可以使苯酚衍生物的酚羟基脱掉质子生成亲核试剂芳氧基负离子,然后进攻与硝基相连的碳,生成亲核取代产物.考虑到溶剂的回收和再利用,以及下游处理的方便程度,仅考察常用无机碱对反应的影响.
如表2所示,所采用的4种无机碱都取得了较好的反应效果.采用NaOH时的产率最低,这可能是因为其碱性过强,使反应中生成的芳氧基负离子的浓度过大而易发生氧化,副产物增多.此外,在NaOH做碱的反应液中,其颜色呈现出土褐色,明显比碳酸盐做碱的反应液的颜色更深,这也证明了有更多氧化副产物的生成.而在3个碳酸盐中,随着碱性从Na2CO3、K2CO3、Cs2CO3的逐渐增大,反应产率也在逐渐增加.但是因为Cs2CO3的价格较贵,因此优选的碱是K2CO3.

表2 碱对SNAr的影响Table 2 The effect of base on SNAr
2.1.3 温度对芳香族亲核取代反应的影响
如表3所示,对于两个硝基取代的邻苯二腈而言,温度对反应的影响趋势相同,都是随着温度的升高,产率先升高到最大值,然后降低.这是因为升高温度会促进酚羟基在碱性条件下生成芳氧基负离子,有利于亲核取代反应的发生,由此提高了反应产率;而当温度进一步升高时,酚羟基容易被氧化而发生副反应,由此导致了产率下降.此外,对比两种邻苯二腈衍生物,升高到较高温度后,温度对4-硝基邻苯二腈的影响比对3-硝基邻苯二腈更为明显.例如:在85 ℃时,4-硝基邻苯二腈的产率由最高产率93.7%降低了近20%,降到74.3%;而3-硝基邻苯二腈的产率由最高产率95.3%降低了近7%,降到87.9%.因此,3-硝基邻苯二腈可在55~75 ℃更宽的温度范围内反应,而4-硝基邻苯二腈则在55~65 ℃较窄的温度范围内反应.由以上分析及表3数据可以确定,对3-硝基邻苯二腈,优选的温度是65 ℃;对4-硝基邻苯二腈,优选的温度是55 ℃.

表3 温度对SNAr的影响Table 3 The effect of temperature on SNAr
2.1.4 反应物物质的量的比对芳香族亲核取代反应的影响
由于苯酚类衍生物较多,并且具有代表性的对叔丁基苯酚相对便宜,因此以与硝基取代的邻苯二腈等物质的量或过量的对叔丁基苯酚为优化目标,确定最佳的物质的量的比.如表4所示,当采用等物质的量的比的对叔丁基苯酚时,产率明显较低.这是因为在较高的温度下,部分酚羟基被氧化而发生了副反应.对4-硝基邻苯二腈而言,微过量的对叔丁基苯酚(二腈与酚物质的量的比:1/1.05)即可达到较高的产率,再增加对叔丁基苯酚的量,产率基本不变.而对3-硝基邻苯二腈而言,则需要稍过量的对叔丁基苯酚(二腈与酚物质的量的比:1/1.1)才可达到较高的产率.因此,对3-硝基邻苯二腈,优选的二腈与酚物质的量的比是1/1.1;对4-硝基邻苯二腈,优选的二腈与酚物质的量的比是1/1.05.

表4 邻苯二腈与对叔丁基苯酚物质的量的比对SNAr的影响Table 4 The effect of mole ratio of phthalonitrile/ p-tert-butylphenol on SNAr
2.1.5 反应时间对芳香族亲核取代反应的影响
在上述优化条件的基础上,考察反应时间对产率的影响.如表5所示,随着反应时间的延长,产率逐渐升高,在反应6 h后,产率达到最大值,再继续延长反应时间,产率基本不变.由此可以确定,优选的反应时间为6 h.
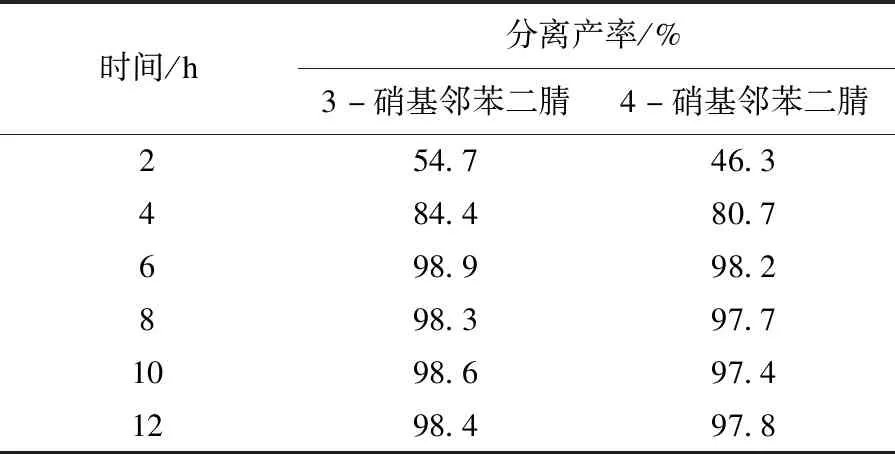
表5 反应时间对SNAr的影响Table 5 The effect of reaction time on SNAr
由以上研究可知,3-硝基邻苯二腈与对叔丁基苯酚进行芳香族亲核取代反应的优选条件为:DMF为溶剂,K2CO3作碱,n(3-硝基邻苯二腈)∶n(对叔丁基苯酚)∶n(K2CO3)=1∶1.1∶2,65 ℃,反应时间为6 h;4-硝基邻苯二腈与对叔丁基苯酚进行反应的优选条件为:DMF为溶剂,K2CO3作碱,n(4-硝基邻苯二腈)∶n(对叔丁基苯酚)∶n(K2CO3)=1∶1.05∶2,55 ℃,反应时间为6 h.
2.2 优选反应条件的应用
采用前述优化的反应条件,研究亲核试剂对丁氧基苯酚和对丁硫基苯酚分别与3-硝基邻苯二腈和4-硝基邻苯二腈的芳香族亲核取代反应.如表6所示,所有的亲核取代反应的产率都超过88%,证明之前优化的反应条件切实可行.此外,对丁氧基苯酚和对丁硫基苯酚作为反应物的反应产率比对叔丁基苯酚的产率稍低,这说明电子云密度更大的苯酚衍生物在较高温度下可能更容易被氧化,生成副产物,由此导致了产率降低.因此,针对具体的亲核试剂,还应对上述的优化条件进行微调,以达到最佳的收率.

表6 苯酚衍生物对SNAr的影响Table 6 The effect of phenol derivative on SNAr
2.3 芳香族亲核取代反应机理
芳香族亲核取代反应机理如图2所示.

图2 芳香族亲核取代反应机理Fig.2 Mechanism of nucleophilic aromatic substitution
芳香族亲核取代反应的机理是加成-消除机理.苯酚衍生物的酚羟基在碱性环境下脱掉质子,生成亲核试剂芳氧基负离子,然后进攻与硝基相连的碳,生成带负电的Meisenheimer型中间体M.这一步是双分子反应过程,是反应速率决定步骤,该步能有效进行的关键是要求被取代基团的邻位或对位有很强的吸电子基团,如文中的氰基基团,以产生活化作用.此外,高度电负性的硝基稳定了加成过渡态,是非常好的离去基团,其离去能力超过卤素原子和磺酸基团.最后,中间体M离去硝基,完成亲核取代反应.
3 结 论
以硝基取代的邻苯二腈和对叔丁基苯酚为模型底物,研究芳氧基取代的邻苯二甲腈的合成方法,优选条件为:3-硝基邻苯二腈为底物时,DMF为溶剂,K2CO3作碱,n(3-硝基邻苯二腈)∶n(对叔丁基苯酚)∶n(K2CO3)=1∶1.1∶2,65 ℃,反应时间为6 h;4-硝基邻苯二腈为底物时,DMF为溶剂,K2CO3作碱,n(4-硝基邻苯二腈)∶n(对叔丁基苯酚)∶n(K2CO3)=1∶1.05∶2,55 ℃,反应时间为6 h.通过上述优选条件高收率地合成了另外4个邻苯二腈衍生物:3-(4-丁氧基苯氧基)邻苯二腈(1B)、3-(4-丁硫基苯氧基)邻苯二腈(1C)、4-(4-丁氧基苯氧基)邻苯二腈(2B)和4-(4-丁硫基苯氧基)邻苯二腈(2C),其中1C、2B和2C是全新的化合物.该芳香族亲核取代反应的机理是加成-消除机理:苯酚衍生物的酚羟基在碱性条件下脱除质子生成亲核试剂芳氧基负离子,然后进攻与硝基相连的碳,生成带负电的中间体,随后硝基离去,生成产物.该研究为芳氧基取代的邻苯二腈衍生物的合成以及相应金属酞菁的合成和应用奠定了基础.

