基于CD40/NF-κB通路丹皮酚调控miR-145抑制小鼠动脉粥样硬化泡沫细胞炎症反应
刘 玲,蒋婷婷,杨宇龙,施晓艳,刘雅蓉,吴鸿飞,戴 敏
(安徽中医药大学药学院 安徽省中药研究与开发重点实验室,安徽 合肥 230012)
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性疾病,炎症反应贯穿AS发展的始终[1],巨噬细胞通过清道夫受体CD36摄取氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)形成巨噬细胞源性泡沫细胞,泡沫细胞分泌炎症因子加剧AS的发生与发展[2]。AS炎症的发生与多种微小RNA(micro RNA,miRNA)有关,miR-145在巨噬细胞上均有分布,且在AS斑块中低表达[3]。在病理情况下,它的下游靶基因CD40在巨噬细胞上高度表达,与受体结合后可以激活下游核转录因子-κB(nuclear factor kappa-B,NF-κB)通路,导致炎症因子白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumornecrosis factor-α,TNF-α)的释放[4-5]。
丹皮酚(paeonol,Pae)为毛茛科植物牡丹PaeoniaSuffruticoasAndr.干燥根皮的主要活性成分之一,具有抗炎、抗AS作用[67]。但是Pae抗泡沫细胞炎症作用机制尚不清楚。本课题组采用高脂饲料饲养ApoE-/-小鼠复制AS模型,从整体动物水平观察Pae对主动脉miR-145表达的影响及其抑制血管泡沫细胞炎症的作用;进一步采用ox-LDL刺激RAW264.7细胞建立巨噬细胞源性泡沫细胞炎症模型,从细胞水平探讨Pae是否通过影响miR-145的表达,抑制CD40/NF-κB通路,从而发挥抑制泡沫细胞炎症反应的作用。
1 材料
1.1 动物 SPF级健康雄性ApoE-/-和C57BL/6J小鼠,体质量为(20±5)g,7~8周龄,常州卡文实验动物有限公司提供,生产许可证号:SCXK(苏)2019-0001,实验动物在(21±1)℃、相对湿度50%~60%的环境下进行饲养,饲养期间给予高脂饲料。
1.2 RAW264.7细胞 RAW264.7细胞购于中国科学院上海生命科学研究院细胞库,培养于DMEM培养基(含10%胎牛血清,1%青霉素-链霉素),37 ℃、5% CO2饱和湿度条件下,每隔1 d传代一次。
1.3 药物与试剂 Pae(批号T2012218,纯度99%):宣城百草药业有限公司;ox-LDL(批号1805P210642):上海懋康生物科技有限公司;油红O染色液(批号20201113):北京索莱宝科技有限公司;白细胞分化抗原40(clusters of differentitation 40,CD40)、磷酸化核转录因子-κB p65(p-NF-κB p65,p-p65)(批号C69G12、C74G24):美国Cell Signaling Technology公司;CD36(批号18426685):Santa Cruz Biotechnology;Lipofectamine®2000试剂(批号2267372):美国Invitrogen生命技术公司;IL-1、IL-6、TNF-α ELISA试剂盒(批号JL20050002、JL20040001、JL20050001):美国酶免公司。
1.4 仪器 电子精密分析天平:上海精密科学仪器公司;荧光显微镜:日本Olympus公司;石蜡切片机:德国Leica公司;移液枪:美国Eppendorf公司;多功能酶标仪:美国MD公司;低温台式离心机:美国Thermo公司;实时荧光定量PCR检测仪(M×3000P):Agilent Technologies Stratagene。
2 方法
2.1 动物分组及给药 将ApoE-/-小鼠随机分为3组:模型组和Pae中、高剂量组,每组6只,给予高脂饲料喂养,高脂饲料配方为20%蛋白质、50%碳水化合物、21%脂肪、0.15%胆固醇。另取6只C57BL/6J小鼠为空白组,普通饲料喂养。Pae组灌胃给予Pae溶液(200、300 mg/kg),其余两组灌胃0.5%羧甲基纤维素钠溶液,给药容积均为10 mL/kg。
2.2 油红O染色观察主动脉病理学变化 第20周末,动物禁食、处死,预冷PBS冲洗小鼠心脏及主动脉血管组织,使用纤维剪将心脏去除,在体式显微镜下观察,用显微镊及显微剪将血管外膜上附着的脂肪及其他组织分离去除,用显微剪将血管纵向剖开。平铺整根主动脉,用细针将其固定于黑色培养皿上,油红O工作液染15 min,分别用100%和65%异丙醇分化5 min,采用高分辨率相机拍照,以斑块占总血管面积的百分比代表AS的相对严重程度。
2.3 激光共聚焦显微镜观测主动脉免疫荧光蛋白CD36、CD40 采用免疫荧光双染CD36与CD40蛋白,即红色荧光与绿色荧光共定位的红色荧光部分占绿色荧光区域面积的系数,以此检测并比较各组主动脉巨噬细胞源性泡沫细胞中CD40的表达水平。将预先放入-80 ℃的主动脉病理切片,放置室温复温,加入4%多聚甲醛固定30 min,使用0.1% TritonX-100通化细胞,加入5%羊血清浸润封闭后按照说明书分别加入相应的特异性一抗、二抗;37 ℃恒温箱中孵育1 h取出后,加入DAPI在室温下孵育10 min,对细胞核进行染色,加入防猝灭剂,在激光共聚焦显微镜下观察两种蛋白染色情况并拍照。
2.4 RT-PCR检测miR-145表达水平 50 ~100 mg主动脉或培养板中每孔加入1 mL的Trizol,用移液枪反复吹打80次,移入无酶的1.5 mL的EP管中,室温静置5 min,每管加入200 μL的氯仿,剧烈摇15 s,12 000 r/min离心15 min,取EP管中最上层,加入等容积的氯仿, 10 000 r/min离心10 min,加入75%乙醇,10 000 r/min离心10 min,弃上清,用滤纸吸干残余液体,加20 μL DEPC水溶解白色沉淀。测定RNA浓度后,按照SYBR Green PCR试剂盒说明书进行RT-PCR。miR-145上游引物是5′-CGGTCCAGTTTTCCCAGGA-3′,下游引物是5′-AGTGCAGGGTCCGAGGTATT-3′,U6上游引物是5′-GTGCTCGCTTCGGCAGC-3′,下游引物是5′-ATGGAACGCTTCACGAATTTG-3′,采用2-ΔΔCT法计算miR-145表达水平。
2.5 ELISA法检测IL-1、IL-6、TNF-α水平 将小鼠麻醉后暴露腹腔,定位腹主动脉并取血,4 000 r/min离心15 min,分离上层血清,EP管分装或将RAW264.7细胞悬液接种于6孔板中,进行分组后,收集各组细胞的上清液,采用ELISA法,在450 nm波长下测量各孔的A值,计算血清IL-1、IL-6、TNF-α水平。
2.6 细胞培养及分组 RAW264.7细胞用含10% FBS的DMEM高糖培养基,于37 ℃、5% CO2培养箱中培养,细胞每隔1 d更换新鲜的培养基,待细胞密度达到80%~90%时,用胰酶消化,进行后续实验。
将RAW264.7(1×105/mL)接种于6孔板中,每孔含有2 mL培养基,在37 ℃、5% CO2细胞培养箱中孵育,根据Lipofectamine®2000转染试剂盒说明书将miR-145模拟剂和miR-145抑制剂转染入细胞12 h后,给予Pae预保护24 h,更换含ox-LDL的高糖DMEM细胞培养基,在37 ℃、5% CO2细胞培养箱中孵育,备用。等到RAW264.7融合度约达到80%时,终止细胞培养,用细胞刮轻轻地刮取细胞,以提取RAW264.7的总蛋白,将实验分成7组。①空白组;②模型组:加入ox-LDL(80 μg/mL);③Pae组:加Pae(60 μmol/L);④miR-145模拟剂组:转染miR-145模拟剂后,加ox-LDL;⑤miR-145抑制剂组:转染miR-145抑制剂后,加ox-LDL;⑥Pae+miR-145模拟剂组:转染miR-145模拟剂后,再加入Pae和ox-LDL;⑦Pae+miR-145抑制剂组:转染miR-145抑制剂后,加Pae和ox-LDL;每组设3个复孔。
2.7 细胞毒性检测试剂盒(cell counting kit-8,CCK-8)检测细胞毒性 将RAW264.7细胞混悬液(1×105/mL)接种于96孔板中培养,加入含有不同浓度(10、20、40、80、160 μmol/L)的ox-LDL培养液100 μL的细胞为实验组,另设不含ox-LDL刺激剂的培养液的细胞为正常对照组,只有培养液的为空白组,分别在细胞培养箱中培养24 h,CCK8法检测细胞吸光度(A)。细胞存活率=(A实验组-A空白组)/A正常对照组×100%。得到ox-LDL刺激RAW264.7细胞的最佳浓度。
每孔预先给予含不同浓度(15、30、60、120、240 μmol/L)Pae的培养液100 μL,分别置于37 ℃、5% CO2细胞培养箱12 h,采用CCK-8法测定A值。细胞存活率=(A实验组-A空白组)/(A正常对照组-A空白组)×100%。得出Pae保护RAW264.7细胞的最佳浓度。
2.8 油红O观察细胞的荷脂情况 用异丙醇配置5%油红O储备液备用,细胞用PBS洗2次,4%的多聚甲醛固定30 min,油红O储备液经滤纸过滤后与去离子水按3∶2比例稀释成工作液,染色30 min,用PBS清洗,显微镜下观察脂质蓄积情况。
2.9 Western blot法检测CD40和p-p65水平 弃去细胞培养液,用PBS冲洗细胞3次,加上适量的裂解液,冰上裂解30 min,离心弃去上清液,加入上样缓冲液后高温使蛋白变性,提取各组细胞总蛋白,根据BCA试剂盒说明书计算蛋白浓度,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,转膜,封闭后分别与特异性一抗、二抗孵育,用化学发光法进行曝光,用Image J软件分析目的蛋白灰度值,分析CD40、p-p65蛋白水平。
2.10 统计学方法 所得数据运用Graph Pad Prism 8软件分析处理,两组均数比较采用t检验,多组均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 Pae对ApoE-/-小鼠动脉粥样硬化斑块形成的影响 与空白组比较,模型组小鼠主动脉及主动脉弓处阳性区斑块面积显著增加(P<0.05);与模型组比较,Pae中、高剂量组小鼠主动脉及主动脉弓处阳性区斑块面积显著减少(P<0.05)。见图1。
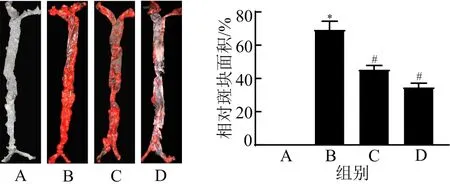
注:A.空白组;B.模型组;C.Pae中剂量组;D.Pae高剂量组;与空白组比较,*P<0.05;与模型组比较,#P<0.05
3.2 Pae对AS小鼠主动脉CD36、CD40蛋白共定位的影响 与空白组比较,模型组小鼠主动脉泡沫细胞共定位系数增大(P<0.05);与模型组比较,Pae中、高剂量组小鼠主动脉泡沫细胞共定位系数显著减小(P<0.05),说明Pae显著下调主动脉泡沫细胞上CD40蛋白表达水平。见图2、图3。
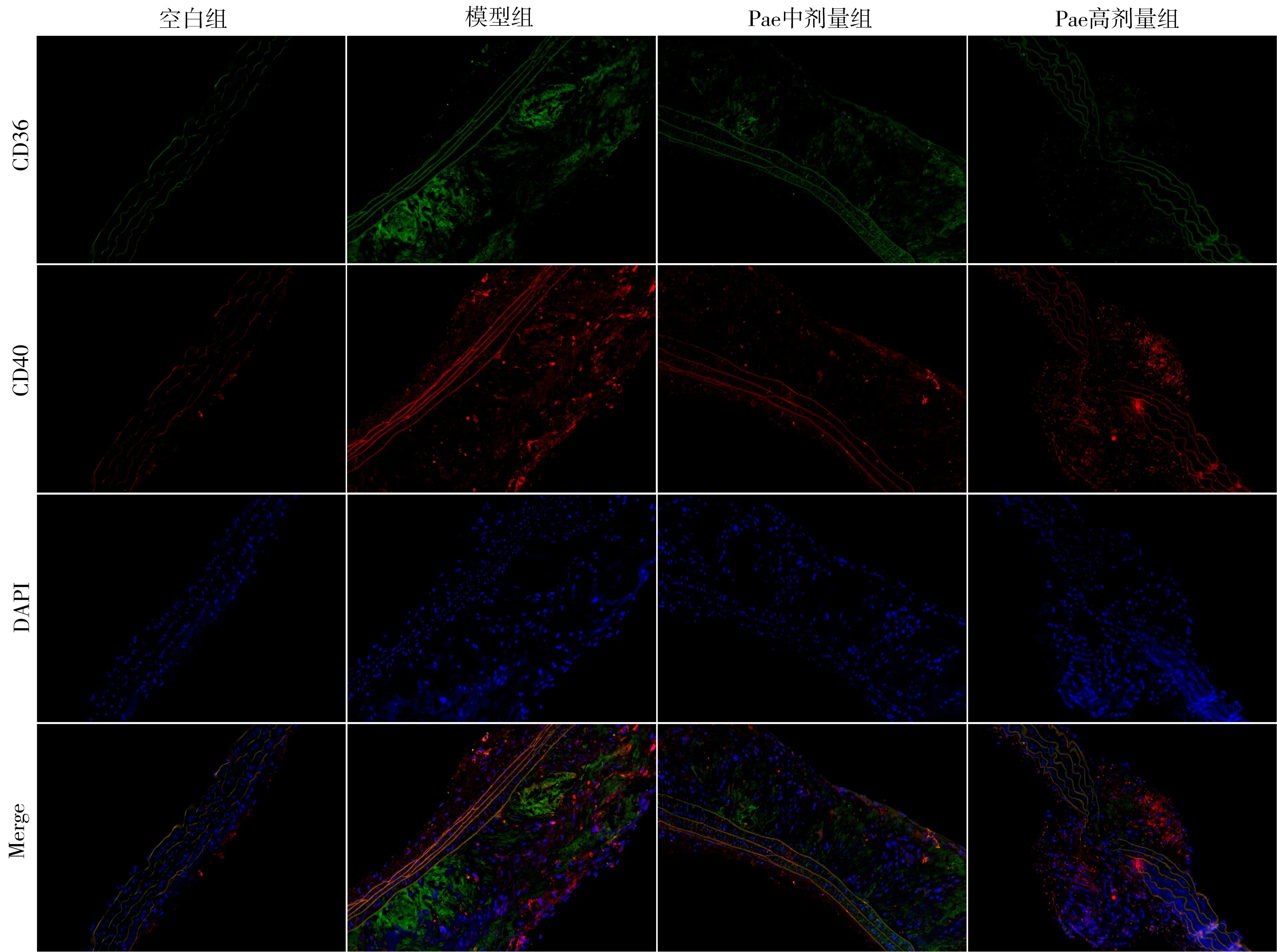
图2 CD36、CD40表达的免疫荧光图(免疫荧光染色法,10×20倍)

注:A.空白组;B.模型组;C.Pae中剂量组;D.Pae高剂量组;与空白组比较,*P<0.05;与模型组比较,#P<0.05
3.3 Pae对ApoE-/-小鼠主动脉miR-145表达水平的影响 与空白组比较,模型组小鼠主动脉miR-145表达水平明显降低(P<0.05);与模型组比较,Pae中、高剂量组小鼠主动脉miR-145表达水平明显升高(P<0.05),说明Pae可以上调AS主动脉miR-145表达水平。见图4。

图4 Pae对ApoE-/-小鼠主动脉miR-145表达的影响
3.4 Pae对ApoE-/-小鼠血清IL-1、IL-6、TNF-α水平的影响 与空白组比较,模型组小鼠血清IL-1、IL-6、TNF-α水平显著升高(P<0.05);与模型组比较,Pae中、高剂量组小鼠血清IL-1、IL-6、TNF-α水平显著降低(P<0.05),说明Pae能降低AS小鼠血清IL-1、IL-6、TNF-α水平。见图5。

图5 Pae对ApoE-/-小鼠血清IL-1、IL-6、TNF-α水平的影响
3.5 ox-LDL对巨噬细胞活力及脂质蓄积的影响 与空白组比较,ox-LDL 80、160 mg/L时细胞活力显著下降(P<0.05),本实验以80 mg/L ox-LDL开展后续实验。显微镜下油红O染色显示:经过ox-LDL(80 mg/L)干预24 h后的巨噬细胞,在油红O染色中细胞内有红色脂滴,表明巨噬细胞源性泡沫细胞建立成功。见图6。

注:A.空白组;B.10 mg/L ox-LDL组;C.20 mg/L ox-LDL组;D.40 mg/L ox-LDL组;E.80 mg/L ox-LDL组;F.160 mg/L ox-LDL组;与空白组比较,*P<0.05
3.6 Pae对巨噬源性泡沫细胞的保护作用 与空白组比较,模型组(ox-LDL 80 mg/L)细胞的活力显著下降(P<0.05);与模型组比较,Pae(15、30、60、120、240 μmol/L)对细胞有不同程度的保护作用(P<0.05),且在60 μmol/L对ox-LDL损伤的巨噬细胞保护作用最好,故后续实验采用此浓度。见图7。

注:A.空白组;B.模型组;C.15 μmol/L Pae组;D.30 μmol/L Pae组;E.60 μmol/L Pae组;F.120 μmol/L Pae组;G.240 μmol/L Pae组;与空白组比较,*P<0.05;与模型组比较,#P<0.05
3.7 Pae对巨噬细胞源性泡沫细胞表达miR-145的影响 与空白组比较,模型组miR-145水平显著下调(P<0.05);与模型组比较,Pae组miR-145水平显著上调(P<0.05),表明Pae可以上调泡沫细胞表达miR-145水平。见图8。

图8 Pae对巨噬细胞源性泡沫细胞表达miR-145的影响
3.8 Pae对转染后巨噬细胞源性泡沫细胞表达CD40、p-p65蛋白的影响 与空白组比较,模型组CD40、p-p65蛋白表达水平显著上调(P<0.05);与模型组比较,Pae组CD40、p-p65蛋白表达水平显著下调(P<0.05);与Pae组比较,Pae+miR-145模拟剂组CD40、p-p65蛋白表达水平显著下调(P<0.05)。结果提示Pae通过上调miR-145水平抑制泡沫细胞CD40、p-p65蛋白的表达。见图9。

注:A.空白组;B.模型组;C.Pae组;D.ox-LDL+Pae组;E.ox-LDL+Pae+miR-145抑制剂组;F.ox-LDL+miR-145模拟制组;G.ox-LDL+Pae+miR-145模拟剂组;与空白组比较,*P<0.05;与模型组比较,#P<0.05;与Pae组比较,△P<0.05
3.9 Pae对转染后巨噬细胞源性泡沫细胞TNF-α、IL-1、IL-6水平的影响 与空白组比较,模型组TNF-α、IL-1、IL-6水平显著上调(P<0.05);与模型组比较,Pae组TNF-α、IL-1、IL-6水平显著下调(P<0.05);与Pae组比较,Pae+miR-145模拟剂组TNF-α、IL-1、IL-6水平显著下调(P<0.05)。结果提示Pae通过上调miR-145水平抑制泡沫细胞分泌IL-1、IL-6、TNF-α的表达。见图10。

注:A.空白组;B.模型组;C.Pae组;D.ox-LDL+Pae+miR-145模拟剂组;E.ox-LDL+Pae+miR-145抑制剂组;与空白组比较,*P<0.05;与模型组比较,#P<0.05;与Pae组比较,△P<0.05
4 讨论
AS不仅是一种脂质代谢紊乱引起的代谢性疾病[8],而且还是一种慢性血管炎症性疾病,当机体处于病理状态时,体内炎症因子和黏附分子增加,单核细胞在各种因子的驱动下,通过受体介导的方式迁移出血管进入各组织器官,分化为巨噬细胞[9]。巨噬细胞通过表面清道夫受体CD36吞噬ox-LDL,转化为泡沫细胞[10],形成早期的AS斑块,且泡沫细胞分泌的炎症因子和趋化因子促进炎症细胞的黏附、浸润以及细胞外基质的降解,最终导致斑块的破裂。斑块破裂又是导致心脑血管突发意外的重要原因[11]。有研究[12]表明,CD36-/-小鼠巨噬细胞吞噬ox-LDL的能力下降,以至于泡沫细胞形成减少,从而导致由泡沫细胞引起的炎症反应减小,延缓AS的进展。
AS炎症的发生与多种miRNA有关,miR-145在多种细胞中表达,这其中包括巨噬细胞,miR-145的表达水平可以用来预测心血管疾病患者冠状动脉病变的存在及严重程度[13]。本研究结果表明,AS小鼠主动脉miR-145水平降低,炎症因子升高,而给予Pae后,miR-145升高,炎症因子降低;进一步研究miR-145模拟剂、miR-145抑制剂转染泡沫细胞后miR-145与各种炎症因子表达变化的关系后发现,转染miR-145模拟剂后,miR-145表达上调,炎症因子水平下降,转染miR-145抑制剂后,miR-145表达下调,炎症因子水平上升。因此Pae抑制炎症的作用可能与上调miR-145的表达有关。
CD40是miR-145的靶基因,受miR-145的调控[14]。在生理情况下,巨噬细胞源性泡沫细胞膜蛋白CD40是低表达或不表达的,当遇到炎症等刺激时其表达量上调,CD40受体与其配体结合后,激活CD40受体,导致NF-κB活化易位,诱导炎症因子IL-1、IL-6、TNF-α的分泌[15]。本研究转染miR-145模拟剂泡沫细胞后结果显示,CD40蛋白及其下游p-p65蛋白表达水平显著下调,与Pae干预后miR-145表达水平上调、CD40蛋白及其下游p-p65蛋白表达水平显著下调结果一致。转染miR-145抑制剂后,Pae具有逆转miR-145表达下调,CD40蛋白、p-p65蛋白表达上调的作用。因此,Pae可能通过上调miR-145的表达抑制CD40蛋白及其下游p-p65蛋白的表达,抑制炎症因子的分泌,减轻泡沫细胞炎症反应。
本研究结果表明,Pae对巨噬细胞源性泡沫细胞分泌的炎症因子具有显著的抑制作用,该抑制作用可能与Pae上调miR-145的表达从而抑制炎症通路CD40/NF-κB有关,该研究结果为Pae抗AS作用的分子机制提供了实验证据。

