ZrO2-(NH4)3PW12O40光催化降解罗丹明B
冯少凡,李 征,李 芳,郝泽坤,胡 乐,李 静
(1.河北工业大学 土木与交通学院,天津 300401;2.中国市政工程华北设计研究总院 第一设计研究院,天津 300074;3.河北工业大学 化工学院,天津 300401)
光催化氧化技术是利用光照半导体催化剂生成电子和空穴,发生一系列氧化还原反应,达到降解有机物的目的,是一种高效且二次污染少的水处理技术。带隙能约为5.0 eV的ZrO2因具有热稳定性好、耐光腐蚀性能好、可重复使用、成本低等优点,被广泛应用于光催化反应中。但由于其禁带较宽、电子-空穴复合率高,使其在光催化中的应用受到限制[1]。为提高其光催化性能,研究人员采用掺杂其他物质的方法减小ZrO2禁带宽度,避免电子-空穴的复合,提高光催化效率。多金属氧酸盐(POM)是一类具有大尺寸、能够储存质子和具有良好电子接受能力等特征的过渡金属氧化物团簇[2-3]。POM中金属的d轨道可接受金属氧化物在光催化反应中产生的光电子,降低光电子与空穴的复合率,提高金属氧化物的光催化性能。
本研究以(NH4)3PW12O40和ZrO2为原料制备高效复合光催化剂,并以罗丹明B(RhB)为目标污染物评价其光催化活性。
1 实验部分
1.1 试剂和仪器
ZrOCl2·8H2O,NH4Cl,乙二胺四乙酸二钠(EDTA-2Na),异丙醇(IPA),磷钨酸(H3PW12O40·xH2O),氨水(w=25%~27%),苯醌(BQ):均为分析纯。
D8 Discover 型X射线衍射(XRD)仪:德国布鲁克公司;Nicolet NEXUS 470型傅里叶变换红外光谱(FTIR)仪:美国Thermo Fisher Scientific公司;Talos F200s型透射电子显微镜(TEM):美国FEI公司;Nova Nano SEM450型扫描电子显微镜(SEM):美国FEI公司;Lambda 25型紫外-可见漫反射(UV-Vis DRS)仪:美国Perkin Elmer公司;TNM-L ROHS型总有机碳分析仪:日本岛津公司;Optima 8300型电感耦合等离子体光谱仪:美国PE公司。
1.2 ZrO2-(NH4)3PW12O40的制备
ZrO2的制备:以ZrOCl2·8H2O为锆源,采用水热法制备ZrO2[4]。沉淀经离心清洗除去Cl-(AgNO3溶液检验),105 ℃烘干,500 ℃焙烧3 h得到ZrO2。
(NH4)3PW12O40的制备:称取300 mg的H3PW12O40·xH2O溶于40 mL超纯水中形成A溶液,搅拌过程中向A溶液中滴加一定体积的2 mol/L NH4Cl,搅拌15 h生成沉淀。沉淀经离心清洗除去Cl-(AgNO3溶液检验),105 ℃烘干备用。
ZrO2-(NH4)3PW12O40制备:取200 mg ZrO2置于40 mL超纯水中超声分散10 min,形成B溶液;将2 mol/L的NH4Cl加入B溶液中超声5 min,形成C溶液;称取不同质量的H3PW12O40·xH2O溶于5 mL超纯水中,缓慢滴加至C溶液中,搅拌15 h生成沉淀;沉淀经离心清洗除去Cl-(AgNO3溶液检验),105 ℃烘干后再350 ℃焙烧2 h,冷却至室温,得到ZrO2-(NH4)3PW12O40复合光催化剂,其中n(Zr)∶n(W)分别为1∶3、1∶5和1∶7的样品分别记为ZrW3、ZrW5和ZrW7。
机械混合样品制备:按照n(Zr)∶n(W)=1∶5的比例将已制备的ZrO2和(NH4)3PW12O40进行机械混合,样品记为ZrWM。
1.3 光催化实验
将20 mg制备的催化剂加入100 mL 质量浓度为15 mg/L的RhB溶液中,在暗环境下搅拌吸附60 min至吸附-脱附平衡。400 W汞灯(波长365 nm)照射下进行光催化性能实验,每隔15 min取5 mL水样,离心分离,在552 nm处测定上清液吸光度,计算降解率。
1.4 催化剂的表征
采用XRD谱图表征催化剂颗粒的晶体物相;采用SEM和TEM照片观察催化剂的形貌;利用UV-Vis DRS谱图计算各催化剂的带隙能;采用FTIR谱图表征催化剂的化学键。
根据1997年《刑法》第416条第2款的规定,阻碍解救被拐卖、绑架妇女儿童罪在客观方面表现为:负有解救职责的国家机关工作人员利用职务阻碍解救被拐卖、绑架的妇女、儿童。在司法实践中,就本罪客观方面的认定而言,应当注意把握以下两个方面的问题:
1.5 催化剂的再生
将光催化反应后的催化剂ZrW5离心回收,利用无水乙醇和超纯水反复清洗、干燥。在相同实验条件下重复光催化实验。
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRD谱图
样品的XRD谱图见图1。

图1 样品的XRD谱图
由图1a可知:ZrO2衍射峰分别对应于单斜相(JCPDS No.65-1022)和四方相(JCPDS No.65-0461)[5];(NH4)3PW12O40,ZrW3,ZrW5,ZrW7均在2θ=10.89°,21.64°,26.54°,30.75°处出现磷钨酸(H3PW12O40)的特征峰(JCPDS No.50-0654)[6],说明(NH4)3PW12O40和复合催化剂均保留了Keggin型结构;但由于ZrO2含量较少导致复合催化剂中ZrO2的衍射峰不明显。由图1 b可知,随着ZrO2相对含量减少,复合催化剂的衍射峰位置有不同程度的左移,表明复合催化剂中的ZrO2和(NH4)3PW12O40之间存在一定的相互作用,影响其衍射峰的位置。
2.1.2 SEM和TEM照片
图2为样品的TEM和SEM照片。由图2a、2b可知,纯ZrO2为直径10~20 nm的纳米球状颗粒,但颗粒团聚明显。(NH4)3PW12O40为分散性较好的粒径为200~700 nm的球形颗粒(见图2c)。由图2d~2f可知:ZrW3颗粒形状不规则且出现明显团聚;ZrW5中的ZrO2均匀分散在(NH4)3PW12O40表面,明显减轻了ZrO2的团聚;由于ZrO2相对含量减少,导致ZrW7中(NH4)3PW12O40表面的ZrO2颗粒明显少于ZrW5。

图2 样品的TEM(a)和SEM(b~f)照片
样品的UV-Vis DRS谱图见图3。由图3可知:ZrO2在波长200~250 nm范围内具有很强的吸收;ZrW3、ZrW5和ZrW7复合催化剂的吸收边缘与(NH4)PW12O40相似。
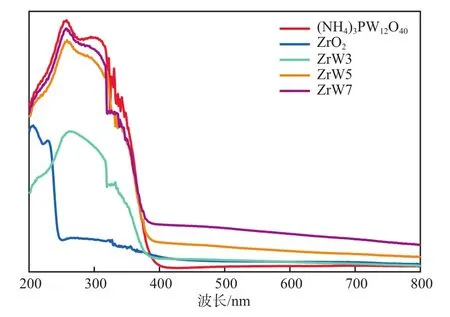
图3 样品的UV-Vis DRS谱图
催化剂的带隙能通过Kubelka-Munk公式(见式(1))计算得到。
式中:α为紫外漫反射中的吸收系数;h为普朗克常数,4.135 667 43(35)×10-15eV·s;v为光频率,Hz;A为常数;Eg为带隙能,eV;n与半导体类型相关,直接带隙n=1/2,间接带隙n=2[7-8]。
计算结果见图4。
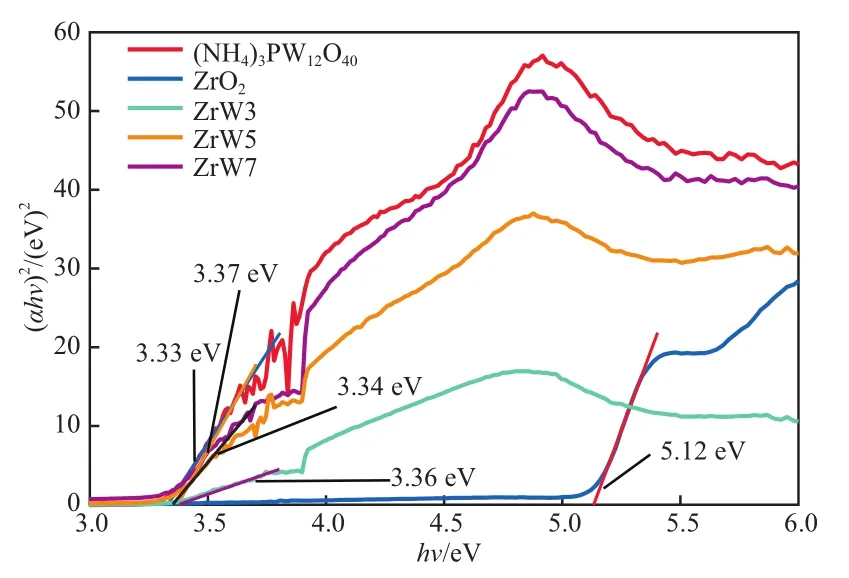
图4 样品的带隙能
由图4可知,ZrO2,(NH4)PW12O40,ZrW3,ZrW5,ZrW7的Eg分别为5.12,3.33,3.37,3.34,3.36 eV,说明ZrO2与(NH4)PW12O40复合后带隙能减小。
2.1.4 FTIR谱图
ZrO2、(NH4)3PW12O40和光催化反应前后ZrW5的FTIR谱图见图5。由图5可见:(NH4)3PW12O40在700~1 100 cm-1的特征峰归属于Keggin型结构振动,其中1 079 cm-1处的吸收峰归属于P—Oa的伸缩振动,983,890,813 cm-1处的吸收峰分别归属于W=Od,W—Od—W和W—Oc—W的伸缩振动;在3 212 cm-1和1 403 cm-1处的特征吸收峰归属于N—H弯曲振动,且光催化反应后的ZrW5仍保留该结构,说明ZrW5具有良好的稳定性;但由于复合催化剂中ZrO2含量较少,导致ZrW5的501 cm-1和750 cm-1处的Zr—O—Zr吸收峰不明显[9-12]。
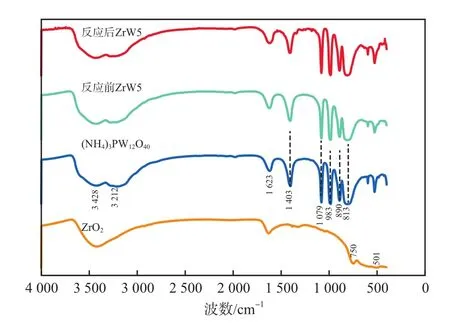
图5 ZrO2、(NH4)3PW12O40和光催化反应前后ZrW5的FTIR谱图
2.2 RhB的光催化降解效果
不同配比催化剂对RhB的光催化降解效果见图6。由图6可见,相比于纯ZrO2和(NH4)PW12O40催化剂,复合催化剂具有更低的ρt/ρ0值。经计算,ZrW3、ZrW5和ZrW7在90 min内对RhB的降解率分别为93.64%、96.69%和80.03%,说明当n(Zr)∶n(W)=1∶5时RhB的降解率达到最大。由SEM照片(图2)可知:当n(Zr)∶n(W)=1∶3时复合催化剂产生团聚,影响载流子的转移;n(Zr)∶n(W)=1∶7时(NH4)3PW12O40表面ZrO2含量较少,不能有效地传递载流子从而降低光催化活性;当n(Zr)∶n(W)=1∶5时ZrO2均匀分散在(NH4)3PW12O40的表面。(NH4)3PW12O40的存在减少了光生电子-空穴的复合[13],降低了带隙能Eg,提高了光利用率。
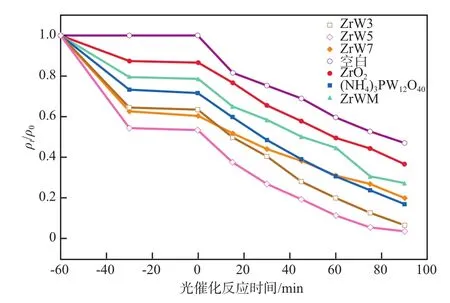
图6 不同配比复合催化剂对RhB的光催化降解效果
为研究复合催化剂光降解RhB的反应动力学,利用Langmuir-Hinshelwood动力学模型对图6的降解数据进行拟合,结果见图7。由图7得到ZrW3、ZrW5、ZrW7、ZrO2、(NH4)3PW12O40和ZrWM降解RhB的表观反应速率常数k值分别为0.024 7,0.030 9,0.011 9,0.009 5,0.015 7,0.011 9 min-1。其中ZrW5对RhB的k值是纯ZrO2的3.25倍、是(NH4)PW12O40的1.96倍、是ZrWM的2.59倍,证明ZrW5的降解效果高于纯ZrO2和(NH4)PW12O40,复合催化剂中ZrO2和(NH4)PW12O40之间存在一定的相互作用,能够有效地提高光催化活性。
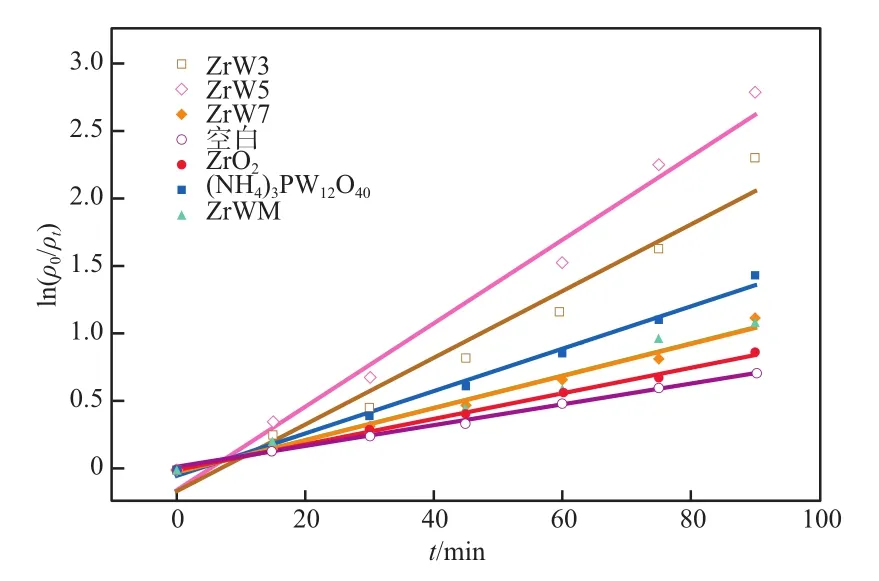
图7 ln(ρ0/ρt)~t的关系
2.3 TOC的去除效果
检测反应后溶液中残余的TOC,以考察复合光催化剂ZrW5对RhB的矿化情况,结果见图8。由图8可知,当光催化反应180 min后,TOC的去除率为25.3%,说明该光催化体系具有矿化有机物的能力。但TOC的去除率明显低于RhB的降解率,说明光催化反应过程中生成的中间有机产物难以被矿化,若达到完全矿化需要更长的时间。
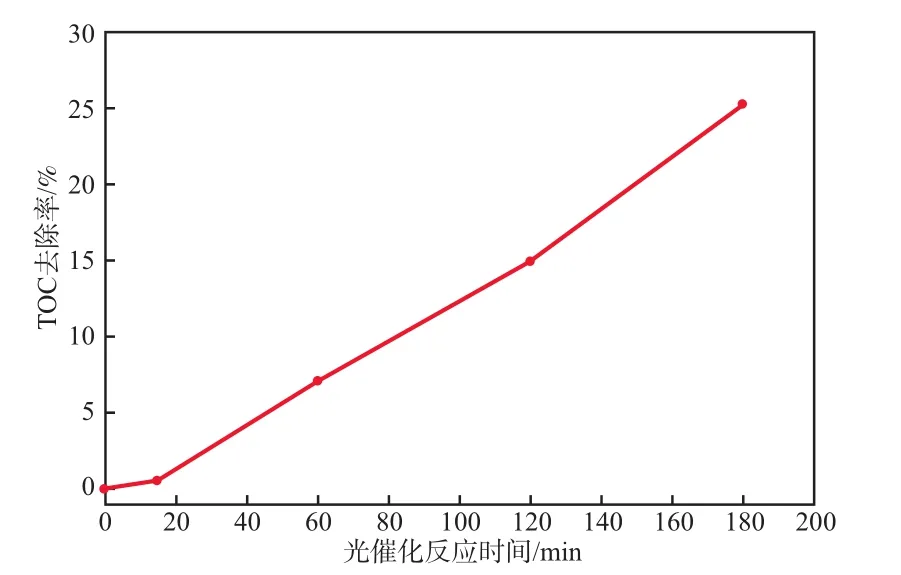
图8 TOC去除率
2.4 催化剂的重复使用性
回收后的ZrW5催化剂在相同实验条件下重复光催化实验,结果见图9。由图9可知,经过4次重复使用后,RhB的降解率由96.69%下降到91.73%。通过检测反应溶液中残余金属元素,发现反应溶液中Zr和W元素的质量浓度分别为0.257 mg/L和1.720 mg/L,说明光催化过程中发生了金属元素的溶出,且回收过程中催化剂也有一定损失,这些都影响了光催化剂的重复利用性。但ZrW5复合催化剂在经过4次重复使用后对RhB降解率仍达到90%以上,由图5可知光催化反应前后ZrW5的Keggin型结构基本无变化,说明该复合催化剂具有良好的稳定性。

图9 复合催化剂ZrW5对RhB的重复降解率
2.5 光催化机理
在ZrW5光催化反应时分别加入IPA、EDTA-2Na和BQ作为羟基自由基(·OH)、空穴(h+)和超氧自由基(·O2-)的捕获剂来分析降解过程中的活性物种。不同捕获剂对RhB降解效果的影响见图10。由图10可知,加入EDTA-2Na、BQ和IPA后,反应90 min时的RhB降解率由96.69%分别降至70.68%、67.73%和64.48%,说明光催化过程中·O2-、·OH和h+对RhB的降解均有作用。
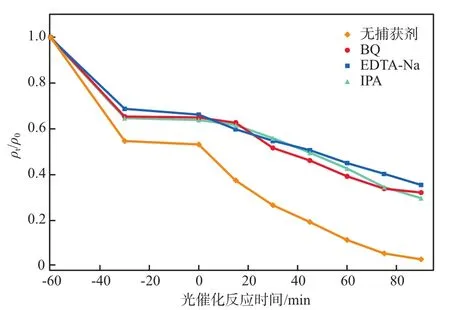
图10 不同捕获剂对RhB降解效果的影响
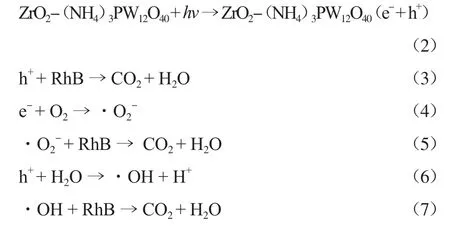
光催化过程中RhB的降解途径见式(2)~式(7)。
3 结论
a)利用水热沉淀法合成了ZrO2-(NH4)3PW12O40复合催化剂。复合过程未改变晶型结构和磷钨酸根离子的Keggin型结构,但影响其形貌和Eg。当n(Zr)∶n(W)=1∶5时,ZrO2均匀分布在(NH4)3PW12O40的表面上,Eg降低。
b)光催化降解90 min时,ZrW5通过·O2-、·OH和h+对RhB的降解率达96.69%;重复使用4次后,RhB降解率仍维持在90%以上。

