煤化工废水高盐反渗透浓水纳滤分盐的运行特性
安景辉,栾金义,冯吉飞
(1.中国石化工程建设有限公司,北京 100101;2.中国石化北京化工研究院,北京 100013;3.中安联合煤化有限责任公司,安徽 淮南 232090)
煤化工项目大多处于干旱地区,无受纳水体,不得不采取废水“零排放”措施。废水“零排放”是废水经深度处理后再将盐分从水中结晶出来,除去盐分的水进行回用。分盐结晶是废水“零排放”和资源化的有效措施[1]。利用纳滤(NF)把高盐水中二价离子分离是分盐结晶的主要方法之一。
煤化工废水中的阳离子通常包括Na+,K+,NH4+,Ca2+,Mg2+,阴离子包括Cl-,F-,SO42-,HCO3-,CO32-,NO3-。如要实现废水“零排放”和分盐结晶,必须去除对结晶过程有干扰或有害的离子。一般的策略是:Ca2+和Mg2+通过除硬技术而去除,NH4+通过生物硝化/反硝化转化为N2去除,HCO3-和CO32-通过酸化—吹脱而去除,F-通过投加钙盐进行控制。通常还需经过一级或多级反渗透(RO)回收淡水,最后RO排出的浓盐水(高盐RO浓水)的溶解性固体质量浓度(TDS)通常在20 000 mg/L以上,高盐RO浓水中的阳离子主要是Na+及少量的K+,阴离子主要有Cl-和SO42-以及少量NO3-和F-。
本工作结合某煤化工废水“零排放”项目,对高盐RO浓水进行NF处理,确定了高盐RO浓水中主要离子的截留率,并对水回收率与离子截留率的关系进行了探讨。
1 某煤化工高盐RO浓水纳滤分盐工艺概况
某煤化工项目因外排水体限制,所有废水必须做到“零排放”,并采取分盐技术回收硫酸钠和氯化钠固体,达到产品质量要求后外售,排放的少量高盐母液经烘干处理后装桶填埋。高盐RO浓水分盐结晶流程示意见图1。
由图1可见,高盐RO浓水(TDS>20 000 mg/L,TOC<50 mg/L,硬度<50 mg/L)首先进入NF装置,设计规模120 t/h。NF具有筛分效应和电荷效应,对不带电荷的物质主要靠筛分效应,对带电物质主要靠电荷效应[2],因此对二价离子的截留远远高于一价离子。NF出水分为两股:一股为浓水,含一价离子和绝大部分二价离子,TDS高;另一股为产水,含一价离子和极少的二价离子,TDS低。

图1 高盐RO浓水分盐结晶流程示意
NF产水再进入RO装置进一步浓缩,RO产水作为再生水回用,RO浓水进入NaCl结晶器,产出NaCl固体、蒸馏水及母液。
NF浓水含有98%以上的二价阴离子和85%以上的二价阳离子,因上游污水经多级除硬,NF进水中Ca2+、Mg2+质量浓度很小。基于电荷平衡理论,荷正电的阳离子与荷负电的阴离子相平衡,由于进水中K+浓度远小于Na+,故NF浓水以Na+占多数。由于NF膜不能截留一价离子,还有相当部分的一价阴离子进入NF浓水,故而NF浓水中除了高浓度SO42-之外还有较高浓度的Cl-。NF浓水和部分NaCl结晶排放母液进入Na2SO4+NaCl联合结晶单元,产出Na2SO4固体和NaCl固体。
剩余的NaCl结晶排放母液和Na2SO4+NaCl联合结晶排放母液一起进入干燥单元,产生杂盐。
2 NF运行概况
2.1 NF特性
NF属于膜分离的一种类型,膜分离过程都涉及两个概念:截留率和水回收率。微滤(MF)和超滤(UF)只能截留悬浮物,不能截留离子,对悬浮物的截留率一般在95%以上,水回收率一般在90%以上;RO对绝大多数的离子截留率在99%以上,水回收率随进水中TDS高低而变化,通常在50%~80%之间;NF对比MF、UF及RO有本质区别,即对每种离子的截留率都不同:对二价阴离子,截留率通常在98%左右;对二价阳离子,截留率通常在85%以上[3];对一价离子,截留率变化幅度很大,而且随水回收率高低而变化。因此对NF而言,最主要的问题是探索对一价离子的截留率以及截留率与水回收率之间的关系。
根据NF进水、产水或浓水流量可计算水回收率,也可根据同种离子的进水、浓水、产水浓度计算该离子的截留率和水回收率[4]。物料平衡式及水回收率、离子截留率计算公式见式(1)~式(3)。
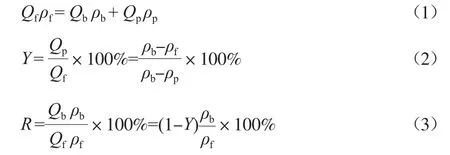
式中:Y为水回收率,%;R为某离子截留率,%;Qf,Qb,Qp分别为进水、浓水、产水的流量,L/min;ρf,ρb,ρp分别为进水、浓水、产水中某离子的质量浓度,mg/L。
式(3)中的截留率是质量截留率,不同于文献[2,5,6]中的截留率(这些文献中的截留率实质是浓度截留率,可能出现负值)。
2.2 NF进水的离子组成
NF进水的部分离子组成见表1。

表1 NF进水的部分离子组成 ρ,mg/L
表1中无Na+,K+,NO3-实测数据,但NF进水中的阳离子主要为Na+和K+,K+-Na+质量比约为0.035;阴离子除表1中所列外,还有NO3-和HCO3-,质量浓度在102~103mg/L之间。
定义:进水杂盐率=(TDS-ρ(Na2SO4)-ρ(NaCl))/TDS。将表1中SO42-和Cl-的质量浓度折合成Na2SO4和NaCl的质量浓度,计算得出进水杂盐率约为12.1%。
2.3 NF对Cl-分离比
NF对SO42-截留率很高,通常在98%以上,故而对NF来说最关注的是浓水中的Cl-浓度,这既影响NaCl收率,也影响Na2SO4纯度。根据式(2)、式(3)可推导出式(4)。
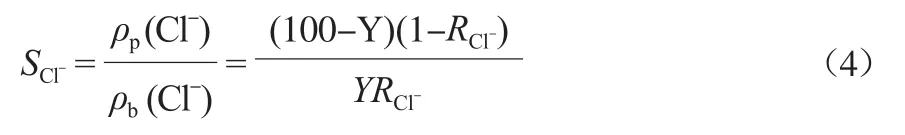
式中,SCl-为Cl-分离比;ρ(bCl-)为浓水的Cl-质量浓度,mg/L;ρp(Cl-)为产水的Cl-质量浓度,mg/L;RCl-为Cl-截留率,%。
图2为NF进水、浓水、产水中SO42-质量浓度的变化。由图2可得,在运行期间,进水、浓水、产水中SO42-平均质量浓度分别为12 112,29 394,261 mg/L,浓水中SO42-质量浓度远远大于产水中SO42-质量浓度,说明NF对SO42-分离很彻底。
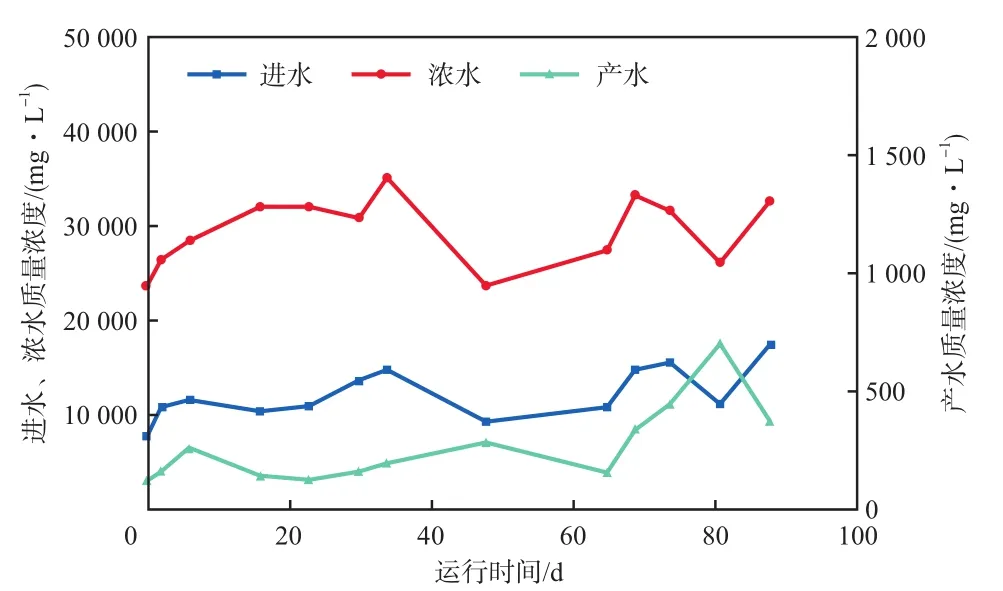
图2 NF进水、浓水、产水中SO42-质量浓度的变化
图3为NF进水、浓水、产水中Cl-质量浓度的变化。由图3可得,在运行期间,进水、浓水、产水中Cl-平均质量浓度分别为4 328,2 712,5 508 mg/L,Cl-分离比为2.03。Cl-分离比不高,表明浓水中仍存在高浓度的Cl-,需要进行“Na2SO4+NaCl联合结晶”处理。
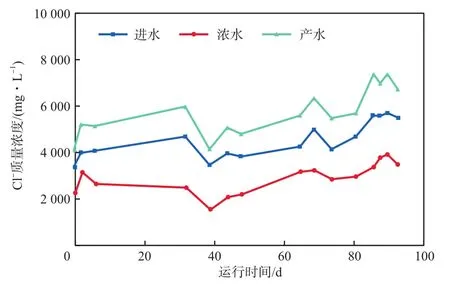
图3 NF进水、浓水、产水中Cl-质量浓度的变化
由NF浓水中SO42-和Cl-的平均质量浓度分别为29 394 mg/L 和2 172 mg/L,得到NF浓水ρ(SO42-)/ρ(Cl-)=13.53。由NF产水中Cl-和SO42-的平均质量浓度分别为5 508 mg/L 和261 mg/L,得到NF产水ρ(Cl-)/ρ(SO42-)=21.10。
2.4 Na2SO4和NaCl回收率分析
从NF浓水回收Na2SO4的角度定义:NF浓水杂盐率=(TDSb-ρb(Na2SO4))/TDSb×100%,式中,TDSb为NF浓水的TDS,ρb(Na2SO4)为NF浓水的Na2SO4质量浓度。NF浓水杂盐率的变化见图4。由图4可见,前2日和第11~20日时NF浓水杂盐率偏高,最高为57%,这可能与前期HCO3-浓度高有关;正常运行期间的NF浓水杂盐率最低值为11%,平均值为18%。计算得到Na2SO4回收率的理论值为82%~89%。尽量降低HCO3-浓度可提高Na2SO4的回收率。
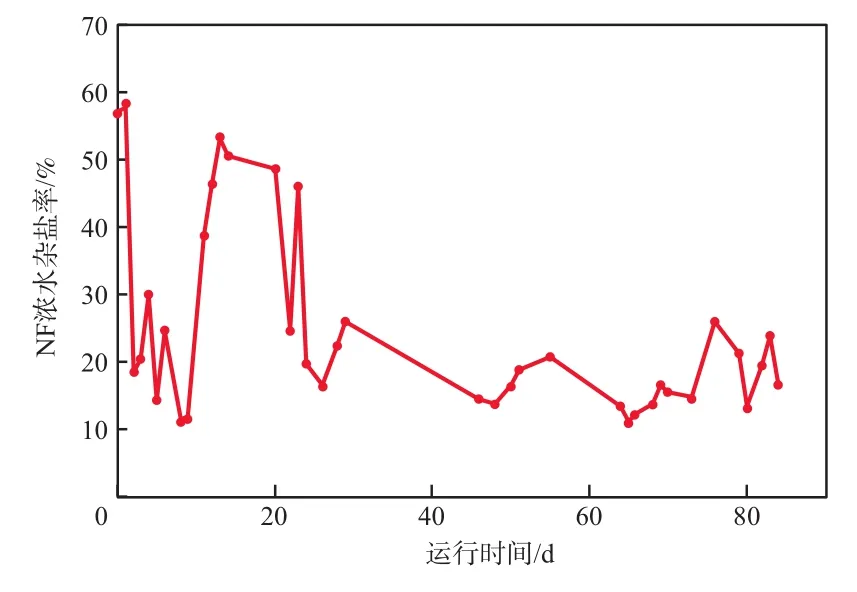
图4 NF浓水杂盐率的变化
从NF产水回收NaCl的角度定义:NF产水杂盐率=(TDSp-ρp(NaCl))/TDSp×100%,式中,TDSp为NF产水的TDS,ρp(NaCl)为NF产水的NaCl质量浓度。NF产水杂盐率的变化见图5。由图5可见,NF产水杂盐率最高值为36%,最低值为20%,平均值为27%。计算得到NaCl回收率的理论值为73%~80%。
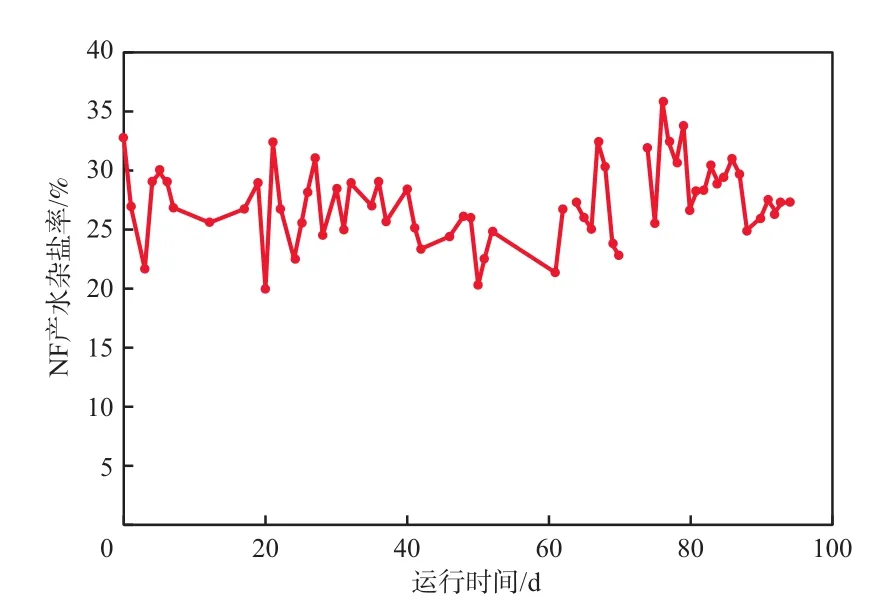
图5 NF产水杂盐率的变化
将NF浓水中ρ(SO42-)折算成ρ(Na2SO4)、ρ(Cl-)折算成ρ(NaCl),NF浓水TDS、ρ(Na2SO4)及ρ(NaCl)的变化见图6。由图6可见:TDS和ρ(Na2SO4)的变化曲线趋势相似,但变化幅度很大,其原因是上游污水处理经过数次除硬,除硬后出水pH达10.5左右,为此采用H2SO4进行中和,因而引入SO42-所致。前2日和第11~20日TDS与ρ(Na2SO4)+ρ(NaCl)相比差距较大,说明有其他杂盐离子大量存在,这与图4的现象一致。这种杂盐离子很可能是HCO3-,说明H2SO4投加量不足。
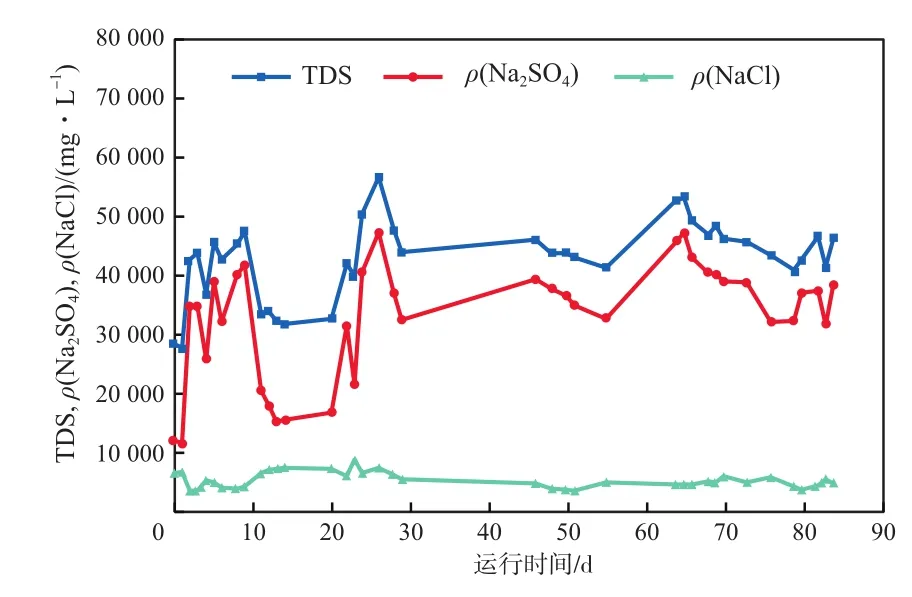
图6 NF浓水TDS、ρ(Na2SO4)及ρ(NaCl)的变化
实际上NF浓水还含有相当浓度的NaCl,故而采用Na2SO4+NaCl联合结晶,可有效提高整体系统的NaCl回收率。
将NF产水的RO浓水的ρ(SO42-)折算成ρ(Na2SO4)、ρ(Cl-)折算成ρ(NaCl),NF产水RO浓水的TDS,ρ(NaCl)及ρ(Na2SO4)的变化见图7。由图7可见,ρ(Na2SO4)不足以补足TDS与ρ(NaCl)之间的差值,造成这一结果的原因可能是RO浓水中含有高浓度的NO3-。
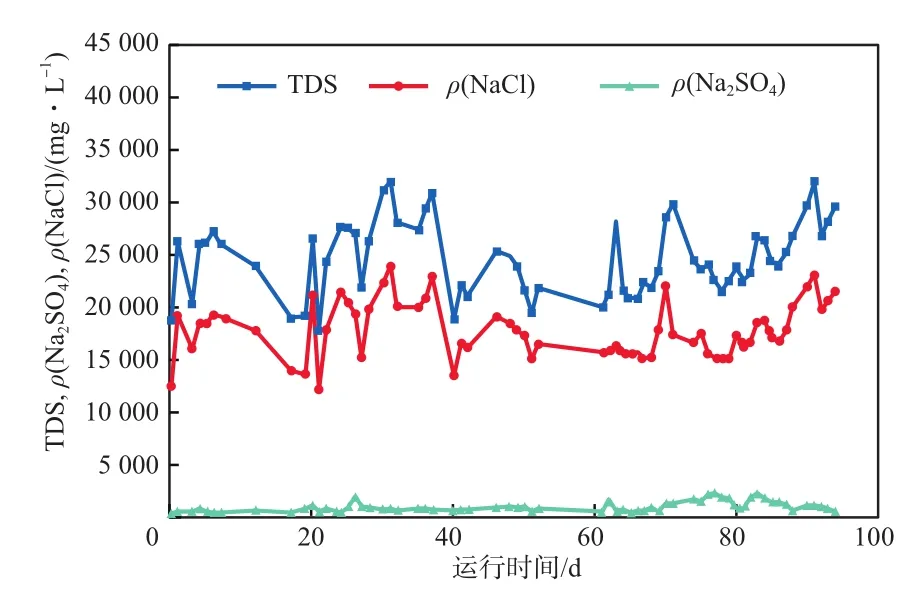
图7 NF产水RO浓水的TDS,ρ(NaCl)及ρ(Na2SO4)的变化
3 水回收率与离子截留率
3.1 水回收率
在某一运行时刻,水回收率只对应一个确定值,离子截留率则随离子种类和操作条件不同而有不同值。由于NF进水、产水的水量计量不同步,无法直接计算水回收率,因此采用NF进水、产水及浓水中的SO42-质量浓度和Cl-质量浓度计算水回收率。
以SO42-计算的水回收率和SO42-截留率见图8。由图8可见,水回收率分布在47.0%~68.2%之间,平均值为59.6%。以Cl-计算的水回收率和Cl-截留率见图9。由图9可见,水回收率分布在40.4%~74.2%之间,平均值为57.5%。两个水回收率平均值相差3.5百分点,误差可接受,水回收率可再取平均值58.5%。

图8 以SO42-计算的水回收率和SO42-截留率

图9 以Cl-计算的水回收率和Cl-截留率
3.2 离子截留率
离子截留率首先取决于离子电荷数,其次与水合离子半径有关[7]。由图8、图9可见:NF对SO42-截留率的平均值为98.7%,基本稳定;对Cl-截留率的平均值为27.3%,变化幅度为11.2%~46.9%。此外,还计算出NF对F-截留率的平均值为74.3%,变化幅度为40.6%~95.3%;NF对NO3-截留率的平均值为55.8%,变化幅度为30.4%~81.5%。负一价阴离子截留率变化幅度大有以下几个原因:1)由式(3)可以看出,离子截留率与水回收率存在直接关联;2)运行过程中,各种离子的浓度比例是波动的,离子截留率与该离子占比有关系[6];3)pH、温度、NF膜结垢及清洗状况对截留率也造成影响[8];4)不同种类的NF膜对同一种离子的截留率也不相同[9]。
本项目的NF平均离子截留率排序为:SO42->F->NO3->Cl-,与文献[10-11]报道不一致。
3.3 离子截留率与水回收率的关系
由图9可以看出水回收率和Cl-截留率的相对关系,两条曲线变化趋势基本相反:水回收率高,则Cl-截留率低,反之亦然。水回收率和F-截留率也表现出相同的规律。Cl-截留率与水回收率的关系见图10。由图10可见,二者呈现良好的负相关性,线性方程为R(Cl-) = -1.039Y+0.871,相关系数r=0.983。作F-截留率与水回收率的关系见图11。由图11可见,二者同样呈现良好的负相关性,线性方程为R(F-) = -1.163Y+1.311,相关系数r=0.992。

图10 Cl-截留率与水回收率的关系

图11 F-截留率与水回收率的关系
分析这一现象的原因,其本质是在一定操作压力下NF浓水总离子浓度有确定的上限值。水回收率越高,浓水流量越小,二价离子必然被截留使浓度变高,一价离子浓度相应变低,截留率变小。由此可得出结论:提高水回收率可以有效降低NF浓水侧的一价离子浓度,提高Cl-分离比。
根据图10及式(4)计算NF水回收率对应的Cl-截留率及Cl-分离比的理论值,结果见表2。
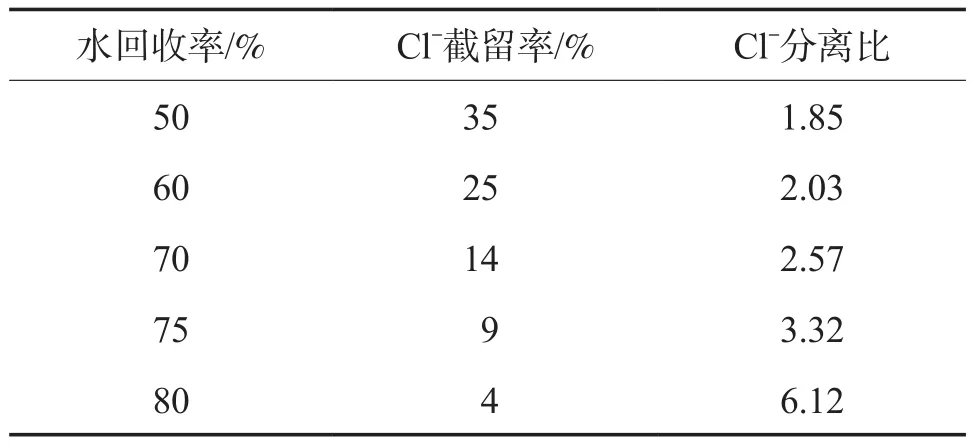
表2 NF水回收率对应的Cl-截留率及Cl-分离比的理论值
由表2可见,当水回收率达到一定程度后,浓水侧Cl-能控制到很低的浓度,绝大多数Cl-进入产水侧。例如当NF水回收率为75%时,Cl-分离比为3.32,即浓水侧Cl-只有产水侧的约30%;再考虑NF产水量是浓水量的3倍,按质量核算,Cl-在NF浓水中的质量只有NF产水中的约1/10,因此NaCl结晶母液部分回流到“Na2SO4+NaCl联合结晶”单元也无必要,可以简化结晶流程。
4 结论
a)采用NF处理煤化工废水高盐RO浓水,Cl-分离比为2.03。NF浓水中还含有相当浓度的NaCl,采用“Na2SO4+NaCl联合结晶”工艺处理NF浓水可有效提高NaCl产量。
b)浓水侧Na2SO4回收率理论值为82%~89%,产水侧NaCl回收率理论值为73%~80%。
c)在平均水回收率58.5%的条件下,NF对SO2-4的平均截留率可达98.7%,对Cl-的平均截留率为27.3%,对F-的平均截留率为74.3%,对NO3-的平均截留率为55.8%。截留率排序为:SO42->F->NO3->Cl-。
b)在NF运行中,Cl-、F-的截留率与水回收率大致呈线性负相关关系。
c)提高水回收率可有效降低NF对一价阴离子的截留率,提高Cl-分离比,有利于简化结晶流程。

