参附注射液质量标准研究*
袁海英 史琳莉 蔡帮军 侯新莲
[华润三九(雅安)药业有限公司,四川 雅安 625000]
参附注射液是由红参和附子2味中药经现代工艺制备而成的注射剂,比传统的参附汤起效快、疗效好,在临床上广泛用于心衰、急性心梗、休克等心血管危重疾病的抢救,其主要有效成分为人参皂苷和乌头类生物碱[1-3]。参附注射液在制备过程中去除了多糖、蛋白质、黏液质、鞣质等大分子物质,并使毒性较大的双酯型生物碱转化为单酯型生物碱。而参附注射液现行版质量标准已有人参皂苷含量测定项,同时对毒性较大的双酯型生物碱含量也进行了限度要求,为了进一步控制参附注射液的安全性及有效性,本试验建立了高效凝胶渗透色谱法[4-8]对参附注射液中大分子物质进行定性鉴别,同时建立了高效液相色谱法[9-12]测定其有效成分单酯型生物碱的含量。
1 仪器与试药
1.1 仪器
Agilent 1260超高效液相色谱仪(美国Agilent)、Alltech ESLD 2000型蒸发光散射检测器、XPE26电子天平(梅特勒)、UPT-1-40L超纯水器(优普)。
1.2 试药
参附注射液为华润三九(雅安)药业有限公司生产,批号:180101010、180403010、180404010、180501010、180601010、180701010、180801010、180901010、181001010、181101010(国药准字Z51020664)。右旋糖酐系列标准 品(D0-180,D1-2500,D2-4600,D3-7100,D4-10000,D5-21400,D6-41100,D7-84400,D8-133800,D2000-2000000;批号为140637-2000-01)购于中国食品药品检定研究院。苯甲酰新乌头原碱对照品(批号:111795-201303)、苯甲酰乌头原碱对照品(批号:111794-201303)、苯甲酰次乌头原碱对照品(批号:111796-201303),均购于中国药品生物制品检定所。甲醇为色谱纯(默克),水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1 大分子物质鉴别
2.1.1 色谱条件 采用Agilent 1260型高效液相色谱仪,凝胶色谱柱为TSK gel G4000PWXL(300 mm×7.8 mm,10 μm),流动相为50 mmol乙酸铵溶液,流速0.5 mL/min,柱温40℃,蒸发光检测器,漂移管温度115℃,干燥气流速3.2 L/min,供试品溶液进样量为10 μL。
2.1.2 溶液的制备 对照品溶液:取右旋糖酐标准品适量,精密称定,分别加水制成每1毫升约含2 mg的溶液,用0.45 μm微孔滤膜滤过即得。供试品溶液:取参附注射液成品,用0.45 μm微孔滤膜滤过即得;另取参附注射液中间体,按参附注射液处方用水稀释至配制量,混匀用0.45 μm微孔滤膜滤过即得。
2.1.3 标准曲线 分别精密称取系列右旋糖苷标准品D1(Mp2700)、D2(Mp5250)、D3(Mp9750)、D4(Mp13050)、D5(Mp36800)、D6(Mp64650)、D7(Mp135350)、D8(Mp300600)8种对照品适量,分别加超纯水溶解成2.0 mg/mL的对照品溶液。分别精密吸取各对照品溶液10 μL注入高效液相色谱仪,依法测定。以对照品相对分子质量的对数值为横坐标(X),保留时间为纵坐标(Y),绘制标准曲线。结果回归方程为Y=-3.003X+30.415,r=0.997。表明相对分子质量在2 700~300 600内其对数值与保留时间呈现良好的线性关系。
2.1.4 检出限测定 精密量取右旋糖酐D4标准品适量,加超纯水配成2.168 mg/mL的对照品溶液,再逐级稀释,分别取10 μL依法测定,记录色谱图。以信噪比约为3∶1时相应的进样量0.678 μg确定为检出限。
2.1.5 精密度试验 精密吸取“2.1.4”项下右旋糖酐D4对照品溶液,依法连续测定6次,计算6次保留时间的RSD为0.12%,峰面积对数值的RSD为0.31%,表明在仪器精密度良好。
2.1.6 稳定性试验 取“2.1.4”项下右旋糖酐D4对照品溶液,分别于0、2、4、8、12、24 h重复测定,计算24 h内保留时间的RSD为0.47%,峰面积对数值的RSD为0.36%,表明待测成分在24 h内稳定。
2.1.7 重复性试验 取同一批参附注射液,分别按“2.1.2”项下方法制备成6份供试品溶液,依法测定,均未检出保留时间大于右旋糖酐D4的色谱峰,且样品中其他色谱峰保留时间的RSD均小于2.0%,峰面积对数值的RSD为0.36%,说明重复性良好。
2.1.8 样品测定 取3批参附注射液中间体和对应批次成品,另随机取7批参附注射液成品,按照“2.1.2”项下方法制备成供试品溶液,依法测定,结果在3批中间体样品中检出了保留时间大于D4和D8的色谱峰,而在参附注射液成品中,则均未检出保留时间大于D4的色谱峰,见图1。说明在生产工艺过程中,大分子物质可被去除。
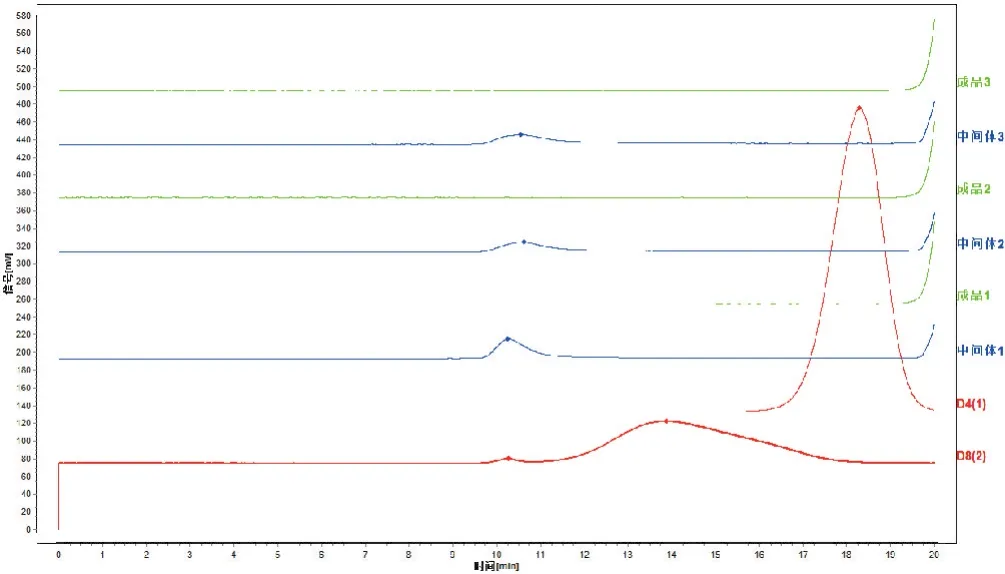
图1 参附注射液中间体及成品大分子物质检测色谱图
2.2 单酯型生物碱含量测定
2.2.1 色谱条件 采用Agilent 1260高效液相色谱仪,色谱柱 Thermo Hypersil BDS C18(4.6 mm×250 mm,5 μm),以0.2%三乙胺(用冰醋酸调至pH5.3)为流动相A,甲醇为流动相B,按表1中的规定进行梯度洗脱,检测波长为235 nm;柱温30℃;流速1.0 mL/min,进样量20 μL。理论塔板数按苯甲酰新乌头原碱峰计算应不低于20 000。

表1 梯度洗脱表
2.2.2 溶液的制备 对照品溶液:取苯甲酰新乌头原碱对照品、苯甲酰乌头原碱对照品、苯甲酰次乌头原碱对照品适量,精密称定,加异丙醇-二氯甲烷(1∶1)混合溶液分别制成每1毫升含苯甲酰新乌头原碱509.62 μg、苯甲酰乌头原碱507.82 μg、苯甲酰次乌头原碱503.88 μg的对照品贮备溶液。再精密吸取上述各对照贮备溶液1 mL至50 mL量瓶中,加异丙醇-二氯甲烷(1∶1)的混合溶液至刻度,摇匀制成每1毫升含苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱分别为10.19、10.16、10.08 μg的混合对照品溶液。供试品溶液制备:取参附注射液10 mL,加于固相萃取小柱(Phenomenex Strata-X,先以甲醇15 mL活化,再以15 mL水平衡),缓慢过柱,以水5 mL冲洗,再以甲醇缓慢洗脱,用1 mL量瓶收集甲醇洗脱液至刻度,摇匀作为供试品溶液。另按参附注射液工艺制备缺附子的阴性样品,照供试品处理方法制备成阴性样品溶液。
2.2.3 专属性试验 精密吸取混合对照品溶液、供试品溶液和阴性样品溶液各20 μL,按“2.2.1”项下色谱条件测定,结果阴性样品对供试品测定无干扰,见图2,说明本方法专属性良好。
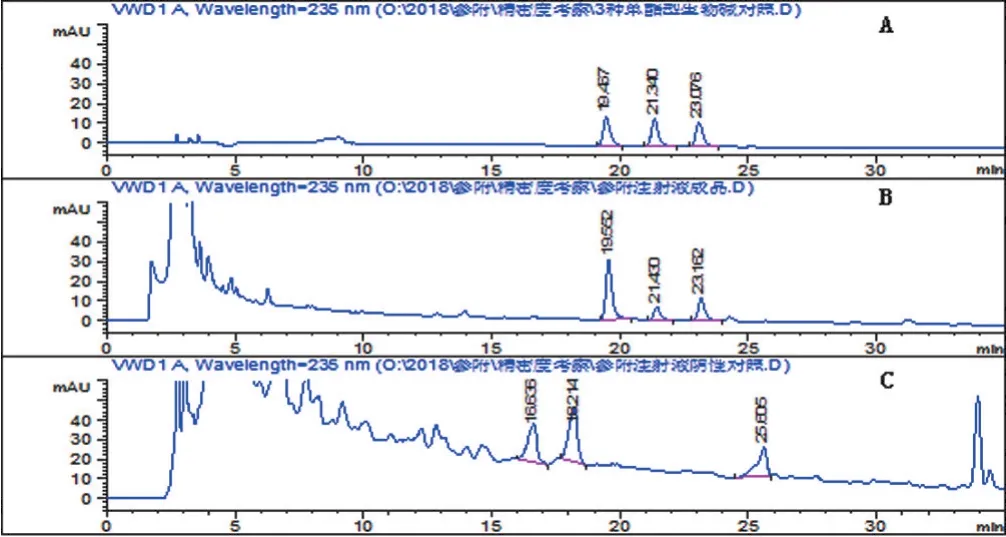
图2 对照品(A)、供试品(B)和阴性样品(C)HPLC色谱图
2.2.4 精密度试验 精密吸取“2.2.2”项下混合对照品溶液20 μL,连续进样6次,测得苯甲酰新乌头原碱峰面积RSD为1.78%、苯甲酰乌头原碱峰面积RSD为0.99%、苯甲酰次乌头原碱峰面积RSD为1.34%,表明仪器精密度良好。
2.2.5 线性关系考察 精密量取“2.2.2”项下各对照品贮备溶液2 mL至同一10 mL量瓶中,用异丙醇-二氯甲烷(1∶1)的混合溶液稀释定容至刻度,摇匀制成每1 mL含苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱分别为101.92 μg、101.56 μg、100.77 μg的混合对照溶液。再将该混合对照溶液用异丙醇-二氯甲烷(1∶1)的混合溶液逐级稀释2倍、5倍、10倍、20倍、40倍。精密吸取各浓度混合对照品溶液20 μL,按“2.2.1”项下色谱条件依法检测,以进样量(X)为横坐标,色谱峰峰面积为纵坐(Y,μg)标绘制标准曲线,各成分回归方程、线性范围见表2。结果表明各成分在线性范围内与峰面积有良好的线性关系。
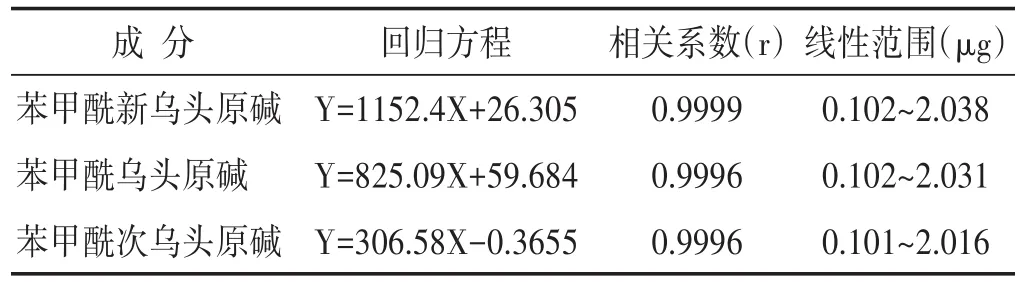
表2 线性关系考察结果
2.2.6 重复性试验 取同一批参附注射液,按“2.2.2”项下方法平行制备供试品溶液6份,按“2.2.1”项下色谱条件测定,结果苯甲酰新乌头原碱平均含量为1.85 μg/mL,RSD为1.69%;苯甲酰乌头原碱平均含量为0.61 μg/mL,RSD为1.23%;苯甲酰次乌头原碱平均含量为1.23 μg/mL,RSD为0.98%。表明本方法具有良好的重复性。
2.2.7 稳定性试验 取同一参附注射液供试品溶液,室温放置0、2、4、8、12、24 h,按“2.2.1”项下色谱条件测定,结果24 h内苯甲酰新乌头原碱平均含量为1.86 μg/mL,RSD为1.17%;苯甲酰乌头原碱平均含量为0.62 μg/mL,RSD为1.94%;苯甲酰次乌头原碱平均含量为1.24 μg/mL,RSD为0.88%。表明在24 h内供试品溶液稳定性良好。
2.2.8 加样回收率试验 根据重复性试验已知参附注射液中苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的含量,加水配制成相应浓度的混合对照品溶液,精密吸取5 mL同一批参附注射液共6份,分别精密加入相应浓度的混合对照品溶液各5 mL,按“2.2.2”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件测定,结果见表3。苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的加样回收率均在85%~110%之间,RSD均小于3%,符合《中国药典》相关要求,表明本方法具有较好的准确度。
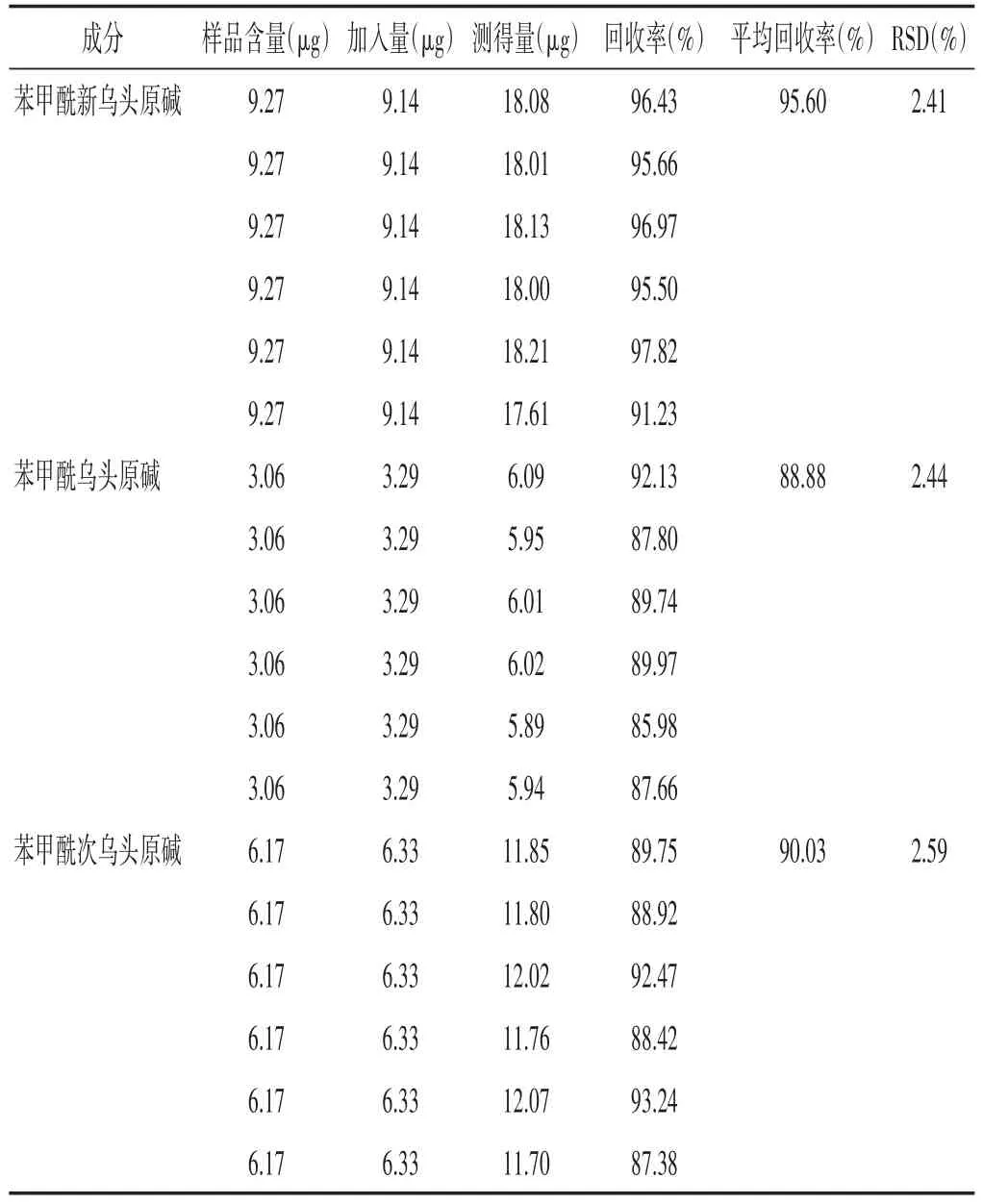
表3 加样回收试验结果
2.2.9 样品测定 取10批参附注射液,按“2.2.2”项方法制备供试品溶液,并按“2.2.1”项下色谱条件测定,测定结果见表4。
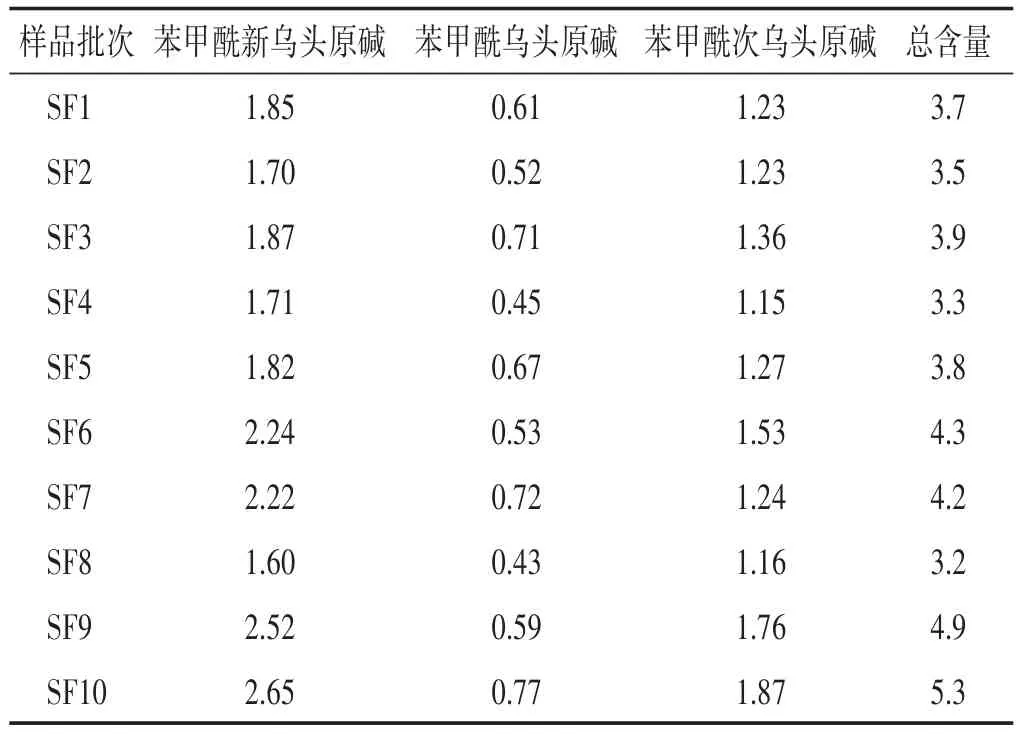
表4 参附注射液3种单酯型生物碱含量测定结果(μg/mL)
3 结 论
中药注射剂经过几十年的发展,在提升药效的同时不良反应也时有发生,其安全性得到广泛关注。据文献报道,影响中药注射剂安全性的主要物质基础是大分子物质[13-16],包括蛋白质、鞣质、多糖、树脂等,本研究建立了参附注射液中大分子物质定性鉴别方法,有利于监控生产过程中大分子物质的去除情况,对控制产品质量具有重要意义,对其他中药注射剂中大分子物质的鉴别也有参考作用。故在参附注射液原注册标准的基础上增加大分子物质检查项,规定在色谱图中不得检出保留时间小于标准品右旋糖酐D4保留时间的色谱峰。
本研究建立了参附注射液处方中另一味药材附子中有效成分单酯型生物碱的含量测定方法。通过对10批参附注射液中3种单酯型生物碱总含量进行测定,结果3种单酯型生物碱总含量在3.2~5.3 μg/mL范围内波动,均值为4.0 μg/mL,RSD为17.0%。故增加了参附注射液中3种单酯型生物碱总含量标准为2.0~6.0 μg/mL,以此作为现行质量标准的补充。进一步控制参附注射液质量稳定性及临床用药的安全有效性。另在原标准中对于3种双酯型生物碱即新乌头碱、乌头碱、次乌头碱已采用薄层鉴别的方法进行了限量检查,需继续进行研究后将该方法进行改进。

