硬毛棘豆根的抑菌活性成分研究
叶生伟, 胡嘉隽,2, 胡子龙, 赵 龙, 郝 楠, 田向荣*,,3
(1. 西北农林科技大学 植物保护学院,陕西 杨凌 712100;2. 天地恒一制药股份有限公司,长沙 410329;3. 西北农林科技大学 林学院,陕西 杨凌 712100)
从植物资源中挖掘和发现具有农用活性的天然产物,是新型农药创制的源头和热点研究领域,也是开发绿色环保型农药的有效途径之一[1-2]。硬毛棘豆Oxytropis hirtaBunge 是豆科棘豆属多年生草本植物,主要分布于中国山西、河北、陕西、内蒙古和甘肃等地,是中国蒙古族的传统蒙药资源,具有止血、愈伤、消肿和清热等作用[3]。文献报道,棘豆属30 多种植物中具有160 多种化学成分,结构类型主要有黄酮类、三萜皂苷类和生物碱类等,另外还有少量的木脂素、有机酸、氨基酸等[4-8]。其中黄酮类以异黄酮、黄酮、二氢黄酮、黄酮醇、高异黄酮、查耳酮、二氢查耳酮、查耳酮二聚体和紫檀烷为主[6],三萜皂苷苷元以齐墩果烷型和五环三萜环丙烷型为主[7],生物碱以喹喏里西啶、吲哚里西啶、哌啶、喹啉、有机酰胺为主[8]。目前,关于棘豆属植物的医用活性报道较多,主要有抑菌、抗肿瘤、抑酶活性[9]和调节动物神经系统等功能[10],但其在农业领域的报道相对较少。有研究表明,棘豆属植物可引起马、羊等牧畜中毒,而其毒性与所含的苦马豆素等毒素有关,该属植物虫害较少,具有开发为植物源杀虫剂的潜力[11-12]。另有研究表明,棘豆属多叶棘豆和黄花棘豆对多种病原菌具有显著的抑制活性[13-14]。迄今为止,除有关硬毛棘豆地上部分总黄酮和山奈素含量的相关报道外[3],尚未见其他相关化学成分及生物活性的报道。基于此,课题组在从植物资源中寻找具有农用抑菌与抗病毒活性先导化合物的过程中[15-16],首次探究了硬毛棘豆根75%乙醇粗提物及不同极性溶剂萃取相对植物病原真菌与细菌的抑菌活性,对抑菌活性较高的乙酸乙酯相进行了化学成分分离与结构鉴定,并对含量较高的化合物进行了抑菌活性评价。
1 材料与方法
1.1 供试材料和药剂
1.1.1 植物材料 硬毛棘豆根于2016 年6 月购于河北安国药材市场,经第四军医大学药物研究所汤海峰教授鉴定确定为豆科棘豆属硬毛棘豆Oxytropis hirtaBunge。
1.1.2 供试病原菌 病原真菌:水稻纹枯病菌Thanatephorus cucumeris、小麦赤霉病菌Fusahum graminearum、苹果炭疽病菌Colletotrichum gloeosporioides、小麦全蚀病菌Gaeumannomyces graminisvar.triticiGgt、番茄灰霉病菌Botrytis cinereaPers. 和辣椒疫霉Phytophthora capsiciLeonian,共6 种。病原细菌:猕猴桃溃疡病菌Pseudomonas syringaepv.actinidae、白菜软腐病菌Erwinia carotovora、烟草青枯病菌Pseudomonas solanacearumSmith、枯草芽孢杆菌Bacilus subtilis和金黄色葡萄球菌Staphylococcus aureus,共5 种。以上病原菌均由西北农林科技大学无公害农药研究服务中心提供。
1.2 供试仪器、试剂和药剂
SGW X-4B 显微熔点仪 (上海仪电物理光学仪器有限公司);R205B 型、R502 型旋转蒸发仪 (上海申生科技有限公司);Bruker Avance 500 MHz核磁共振波谱仪 (德国Bruker 公司);高分辨液质联用仪 (AB SCIEX);Sephadex LH-20 凝胶 (美国GE 公司)。
75%乙醇、乙酸乙酯、石油醚、正丁醇、甲醇、二氯甲烷等常规试剂 (分析纯,杨凌三力化玻采供应站);氘代氯仿 (CIL,美国剑桥同位素实验室);柱层层析硅胶 [200~300 目 (50~75 μm)、100~200 目 (75~150 μm)]、薄层层析硅胶、GF254薄层硅胶板 (青岛海洋化工厂);96 孔板 (泰州鑫联诚润生物技术有限公司);链霉素 (720 I.U./mg,阿拉丁科技(中国)有限公司)。30%丁香菌酯悬浮剂 (coumoxystrobin 300 SC,吉林省八达农药有限公司)。
1.3 试验方法
1.3.1 硬毛棘豆根中抑菌成分的提取 硬毛棘豆根经干燥、粉碎后 (3 kg),加入3 倍体积的75%乙醇浸泡提取7 d,共提取4 次。合并提取液,减压浓缩,得到褐色浸膏粗提物。加水至混悬状态后依次用等体积石油醚、乙酸乙酯和正丁醇萃取,浓缩,分别得到不同溶剂萃取物:石油醚相 (42.6 g)、乙酸乙酯相 (72.2 g) 和正丁醇相 (53.6 g) 。将最后的剩余物减压旋干得到水相 (62.9 g) 。
1.3.2 粗提物及各萃取相抑菌活性测定
1.3.2.1 粗提物及各萃取相对病原真菌的影响 利用菌丝生长速率法[17]测定硬毛棘豆根粗提物以及各萃取相(质量浓度为1 × 103mg/L) 对6 种植物病原真菌菌丝生长的抑制活性。用体积分数为10%的二甲基亚砜(DMSO)水溶液分别将粗提物及各萃取相配制成质量浓度为2 × 104mg/L 供试药液。取1 mL 药液,加入19 mL 马铃薯葡萄糖琼脂 (PDA)培养基,制成1 × 103mg/L 含药培养基。对照组用10%的DMSO 水溶液代替供试药液后重复以上操作。打取直径5 mm 的菌饼接种在含药培养基上,将培养皿置于25 ℃、相对湿度75%的条件下培养3 d。采用十字交叉法测量菌落直径,按(1) 式计算菌丝生长抑制率 (I)。
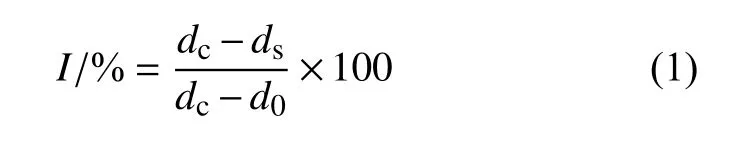
其中:dc为CK 组菌落平均直径,ds为样品组菌落平均生长直径,d0为菌饼直径。
1.3.2.2 粗提物及各萃取相对病原细菌的影响 采用抑菌圈法[18]测定硬毛棘豆根粗提物以及不同萃取相在质量浓度为1 × 103mg/L 时对3 种植物病原细菌的抑菌圈大小。用体积分数为0.5%的DMSO水溶液将粗提物以及各萃取相配制成质量浓度为1 × 104mg/L 的供试药液。吸取1 mL 药液加入至9 mL 无菌水中,得到1 × 103mg/L 供试药液。将菌液稀释至1 × 105~1 × 107CFU/mL,备用。取1 mL 稀释后的菌液加入19 mL 营养琼脂 (NA) 培养基,混匀制成带菌培养基。用内径为5 mm 打孔器以正三角形的形状在培养皿中均匀打3 个小孔,每孔中加入80 μL 1 × 103mg/L 药液。阴性对照组用0.5%的DMSO 水溶液代替供试药液,阳性对照组采用100 mg/L 的链霉素。4 ℃预扩散2 h 后置于37 ℃环境条件下培养24 h,采用十字交叉法测定抑菌圈大小。
1.3.3 硬毛棘豆根乙酸乙酯相活性成分的分离纯化 取乙酸乙酯相 (72.2 g) 用二氯甲烷与甲醇溶解后,用1.3 倍质量的硅胶(100~200 目)拌样,用200~300 目硅胶(900 g)进行正相柱层析,流动相为石油醚-乙酸乙酯体系,梯度洗脱,体积比分别为100 : 1、50 : 1、30 : 1、20 : 1、10 : 1、7 : 1、5 : 1、3 : 1、2 : 1 和1 : 1,通过薄层层析 (TLC) 监测,合并相同组分分别得到JDY-1(1.3 g)、JDY-2(3.2 g)、JDY-3 (10.2 g)、JDY-4 (15.1 g)、JDY-5(2.6 g)、JDY-6 (1.1 g) 和JDY-7 (9.6 g) 共7 个馏分。其中JDY-1 主要为极性小的脂溶性成分,薄层成点性差,未进行进一步分离纯化;JDY-6 分离纯化后得到的纯品较少,结构尚未确定。馏分JDY-2(3.2 g)经Sephadex LH-20 凝胶柱层析,以V(二氯甲烷) :V(甲醇) = 1 : 1 进行洗脱,得到化合物1(62.2 mg) 。馏分JDY-3(10.2 g)经硅胶柱层析,以石油醚/丙酮为洗脱溶剂进行梯度洗脱,体积比分别为30 : 1 和10 : 1,得到JDY-3-1~JDY-3-3,其中JDY-3-1 (342.3 mg) 进一步通过Sephadex LH-20 凝胶柱层析,以V(二氯甲烷) :V(甲醇) =1 : 1 进行洗脱,得到化合物2 (16.3 mg)。馏分JDY-4 (5.0 g) 经硅胶柱层析,以V(石油醚) :V(乙酸乙酯) = 10 : 1 与8 : 1 进行梯度洗脱,得到化合物3 (45.7 mg) 和4 (12.9 mg)。馏分JDY-5 (2.6 g)用丙酮溶解进行重结晶,得到化合物5 (35.4 mg)。馏分JDY-7 (3.6 g) 通过Sephadex LH-20 凝胶柱层析,以V(二氯甲烷) :V(甲醇) = 1 : 1 进行洗脱,得到化合物6 (113.2 mg)。
1.3.4 化合物的抑菌活性测定
1.3.4.1 化合物对病原真菌的抑菌活性 利用菌丝生长速率法[17]分别测定了化合物1、3、5、6 在100 mg/L 时对6 种植物病原真菌菌丝生长的抑制作用。用DMSO 将化合物配制成2 × 104mg/L 的供试药液。吸取75 μL 供试药液,加入15 mL PDA 培养基中,然后均匀倒入3 个直径6 cm 的培养皿中,制成质量浓度为100 mg/L 含药培养基。阴性对照和阳性对照分别用DMSO 和30%丁香菌酯SC 代替供试药液重复以上操作。打取直径5 mm的供试菌饼,接种在含药培养基上,并将培养皿置于25 ℃、相对湿度75%的条件下培养3 d,采用十字交叉法测量菌落直径,按 (1) 式计算菌丝生长抑制率。最后对抑菌活性较好的化合物进行精密毒力测定 (药剂系列质量浓度分别为400、200、100、50、25 mg/L) ,求出毒力回归方程和EC50值。
1.3.4.2 化合物对病原细菌的抑菌活性 利用琼脂稀释法[19]分别测定化合物1、3、5、6 在200 mg/L时对3 种植物病原细菌的抑制作用。用体积分数为10%的DMSO 水溶液将化合物配制成4 × 103mg/L 的供试药液。将菌液稀释至1 × 105CFU/mL,备用。在已灭菌的96 孔板中,每孔加入95 μL 稀释后的菌液和5 μL 药液。阴性对照组用10%的DMSO 水溶液代替供试药液重复以上操作,阳性对照采用100 mg/L 的链霉素。于37 ℃培养16 ~20 h 后滴加碘硝基氯化四氮唑蓝 (INT) 观察结果。若菌液出现明显浑浊,滴加INT 显粉红色说明无抑菌活性;菌液呈清澈状态,滴加INT 后颜色不发生改变说明有抑菌活性。最后对抑菌活性较好的化合物,设置质量浓度200、100、50、25 和12.5 mg/L,进行最低抑菌浓度 (MIC) 测定。
1.3.5 数据分析 采用SPSS 数据处理软件进行统计分析。
2 结果与分析
2.1 硬毛棘豆根75%乙醇粗提物及萃取相的抑菌活性
2.1.1 对病原真菌的抑制活性 测定结果(表1)
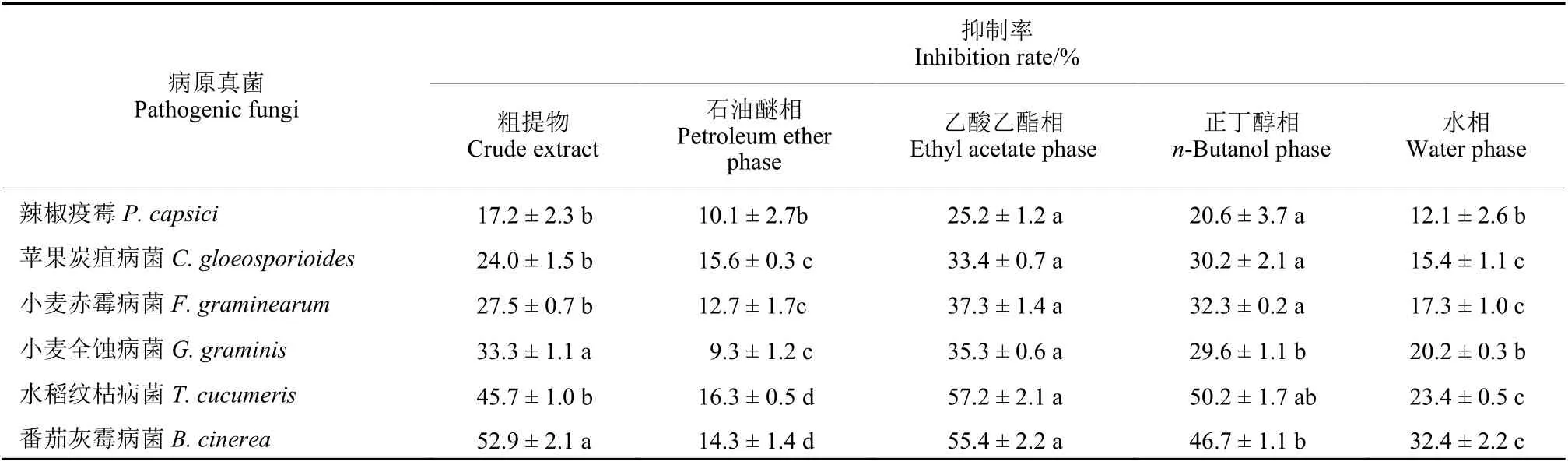
表1 硬毛棘豆根75%乙醇粗提物及其不同萃取相对植物病原真菌的抑制作用Table 1 Inhibition of 75% ethanol extract and its different phases from O. hirta against plant pathogenic fungi
表明,硬毛棘豆根75%乙醇粗提物及其乙酸乙酯和正丁醇相对供试病原真菌的抑菌活性较好,而石油醚相和水相抑菌活性较差。其中,乙酸乙酯相对水稻纹枯病菌和番茄灰霉病菌的抑菌活性最好,在其质量浓度为1 × 103mg/L 时对病原真菌的抑制率分别为57.2%和55.4%。
2.1.2 对病原细菌的抑制活性 测定结果(表2)表明,硬毛棘豆根乙酸乙酯相对病原细菌的抑菌活性最好,其质量浓度为1 × 103mg/L 时对烟草青枯病菌与猕猴桃溃疡病菌的抑菌圈分别为 21.8 mm和19.0 mm,抑菌活性与链霉素相当。

表2 硬毛棘豆根75%乙醇粗提物及其不同萃取相对植物病原细菌的抑制作用Table 2 The inhibition of 75% ethanol extract and its different phases from O. hirta against plant pathogenic bacteria
2.2 化合物的结构鉴定
化合物1:白色针晶,m.p. 196~197 ℃,Liebermann-Burchard 反应阳性。HRMS(ESI-)给出了准分子离子峰m/z461.362 3 [M + Cl]-(C30H50OCl,计算值:461.355 0),提示化合物的相对分子质量为426,分子式为C30H50O。1H NMR (CDCl3,500 MHz) 图谱中,δH5.18 (1H, t,J= 4.0 Hz) 为H-12 位的烯氢质子信号,δH3.22 (1H, m) 为H-3 位连接羟基的次甲基质子信号,δH1.13 (3H, s, CH3)、1.00 (3H, s, CH3) 、0.97 (3H, s, CH3) 、0.94 (3H, s,CH3)、0.87 (6H, s, 2CH3)、0.83 (3H, s, CH3) 和0.79 (3H, s, CH3) 为连接季碳的8 个角甲基氢信号。13C NMR 图谱 (表3) 中给出了C-3 (δC79.2) 位连接羟基的次甲基碳信号,以及双键碳信号δC145.3 (C-13) 和 121.9 (C-12)。12-烯-乌苏烷型三萜C-12 和C-13 位的化学位移值接近δC125 和139,而12-烯-齐墩果烷型三萜C-12 和C-13 位的化学位移值接近δC123 和145[20],因此,根据碳谱数据 (表3),确定化合物1 具有12-烯-齐墩果烷型三萜结构骨架。以上数据与文献中报道的β-香树脂醇的波谱数据一致[21],鉴定化合物1 为β-香树脂醇。
化合物2:白色针晶,m.p. 263~264 ℃,Liebermann-Burchard 反应阳性。HRMS(ESI+)给出了准分子离子峰m/z493.328 6 [M + Na]+(C30H46O4Na,计算值:493.329 4) ,提示化合物的相对分子质量为470,分子式为C30H46O4。1H NMR (500 MHz, CDCl3)图谱中,δH1.25 (3H,s)、0.97 (3H, s)、0.96 (3H, s)、1.13 (3H, s)、0.83(3H, s)和1.21 (3H, s)为三萜的6 个甲基氢信号;δH5.24 (1H, t,J= 3.6 Hz)为H-12 位的烯氢质子信号;δH3.46 (1H, d,J= 11.3 Hz)和3.95 (1H, d,J=11.2 Hz)为H-24 位连接羟基的亚甲基质子信号。13C NMR 图谱 (表3) 中给出了C-3 位特征性的酮羰基碳信号δC215.3,C-29 位的羧基碳信号δC184.6,C-24 位连接羟基的亚甲基碳信号δC66.0,以及双键碳信号δC144.1 (C-13)和 122.7 (C-12),确定化合物2 具有12-烯-齐墩果烷型三萜结构骨架。以上波谱数据与文献中报道的3-O x oazukisapogenol 一致[22],故鉴定该化合物为3-Oxoazukisapogenol。
化合物3:白色粉末,m.p. 131~132 ℃,Liebermann-Burchard 反应阳性。MS(ESI+)给出了准分子离子峰m/z437 [M + Na]+,提示化合物的相对分子质量为414,结合核磁共振氢谱和碳谱,推测化合物分子式为C29H50O。1H NMR (500 MHz,CDCl3) 中,δH5.35 (1H, d,J= 5.3 Hz)为H-11 位的烯氢质子信号, 3.52 (1H, tt,J= 10.8, 5.0 Hz)为H-3 位的次甲基氢信号,δH1.00 (3H, s, H3-19)、0.92 (3H, d,J= 6.4 Hz, H3-21)、0.85 (3H, d,J=7.5 Hz, H3-29)、0.83 (3H, d,J= 7.5 Hz, H3-26)、0.81 (3H, d,J= 7.5 Hz, H3-27)和0.68 (3H, s, H3-18)为甾体上的6 个甲基氢信号。13C NMR 图谱中(表3) ,δC121.9 和141.0 分别为C-11 位和C-9 位的双键碳信号,δC72.0 为C-3 位的连氧碳信号。以上波谱数据与文献中报道的5α-豆甾-9(11)-烯-3β-醇一致[23],故鉴定化合物3 为5α-豆甾-9(11)-烯-3β-醇。
化合物4:白色粉末,m.p. 165~166 ℃,Liebermann-Burchard 反应阳性。MS(ESI-)给出了准分子离子峰m/z425 [M - H]-,提示化合物的相对分子质量为426,结合核磁共振氢谱和碳谱,推测化合物分子式为C29H46O2。1H NMR (500 MHz,CDCl3) 中,δH6.17 (1H, d,J= 3.8 Hz)为H-4 位的烯氢质子信号,δH1.16 (3H, s, H3-19)、0.93 (3H, d,J= 6.1 Hz, H3-21)、0.85 (3H, d,J= 6.9 Hz, H3-29)、0.83 (3H, d,J= 6.9 Hz, H3-27)、0.81 (3H, d,J= 7.0 Hz, H3-26)和0.72 (3H, s, H3-18)为甾体的6 个甲基氢信号。13C NMR 图谱中 (表3),δC202.5和199.7 分别为C-6 位和C-3 位的两个酮羰基,δC161.3 和125.7 分别为C-5 位和C-4 位的两个双键碳信号,提示该甾体母核为4-烯-3,6-二酮骨架。以上波谱数据与文献报道的豆甾-4-烯-3,6-二酮一致[24],故鉴定化合物4 为豆甾-4-烯-3,6-二酮。

表3 化合物1 ~ 6 的碳谱数据 (CDCl3, 125 MHz)Table 3 13C NMR data of compounds 1-6(CDCl3, 125 MHz)
化合物5:白色粉末,m.p. 255~256 ℃,Liebermann-Burchard 反应阳性。HRMS(ESI+)给出了准分子离子峰m/z4 8 1.3 6 4 6 [M + N a]+(C30H50O3Na,计算值:481.365 8),提示化合物的相对分子质量为458,分子式为C30H50O3。1H NMR (500 MHz, CDCl3) 中,δH5.24 (1H, d,J=4.5 Hz)为H-12 位的烯氢质子信号,δH4.20 (1H,d,J= 11.1 Hz)为H-3 位的连氧次甲基氢信号,δH3.34 (1H, d,J= 11.1 Hz) 和3.42 (1H, m) 为H2-24 位的两个连氧亚甲基氢信号,δH1.25 (3H, s)、1.11 (3H, s)、1.03 (3H, s)、0.94 (3H, s)、0.90 (3H,s)、0.89 (3H, s)和0.87 (3H, s)为化合物中7 个连接季碳的甲基氢信号。13C NMR 图谱中 (表3),δC122.5 和144.1 分别为C-12 位和C-13 位的双键碳信号,确定化合物5 具有12-烯-齐墩果烷型三萜结构骨架。碳谱中,δC81.1、76.8 和64.7 分别为C-3、C-22 和C-24 位的连氧碳信号,以上波谱数据与文献中报道的3β,22β,24-三羟基齐墩果-12-烯一致[25],故鉴定化合物5 为3β,22β,24-三羟基齐墩果-12-烯。
化合物6:白色粉末,m.p. 276~278 ℃,Liebermann-Burchard 反应阳性。HRMS(ESI+)给出了准分子离子峰m/z495.344 2 [M + Na]+(C30H48O4Na,计算值:495.345 0),提示化合物的相对分子质量为472,分子式为C30H48O4。1H NMR (500 MHz, CDCl3) 中,δH5.10 (1H, d,J=4.4 Hz)为H-12 位的烯氢质子信号,δH4.07 (1H, d,J= 10.8 Hz)为H-3 位连接羟基的次甲基氢信号,δH3.20 (1H, d,J= 10.7 Hz)和3.26 (1H, m)为H2-24 位连接羟基的亚甲基氢信号,δH1.10 (3H, s)、1.09 (3H, s)、1.02 (3H, s)、0.82 (3H, s)、0.77 (3H,s)和0.73 (3H, s)为化合物中6 个连接季碳的甲基氢信号。13C NMR 图谱中 (表3),δC122.6 和144.1 分别为C-12 位和C-13 位的双键碳信号,推测化合物6 具有12-烯-齐墩果烷型三萜结构骨架。碳谱中,δC181.9 为C-29 位的羧基碳信号,δC80.3 和64.4 分别为C-3 位和C-24 位的连氧碳信号,以上波谱数据与文献中报道的azukisapogenol一致[26],故鉴定化合物6 为azukisapogenol。
化合物1~6 的结构式见图式1,核磁共振碳谱数据见表3。

图式1 硬毛棘豆根中分离鉴定的化合物结构1 ~ 6Scheme 1 Chemical structures of compounds 1-6 from Oxytropis hirta
2.3 化合物的抑菌活性
2.3.1 化合物对病原真菌的抑制作用 采用菌丝生长速率法对含量较高的化合物1、3、5 和6 进行了抑菌活性测定,结果见表4。当质量浓度为100 mg/L 时,化合物6 对水稻纹枯病菌与番茄灰霉病菌的抑制率分别为43.6%和62.4%,其中对番茄灰霉病菌的抑制效果与30%丁香菌酯SC 相当。因此,进一步测定了化合物6 对两种供试病原菌的EC50值,分别为117.4 mg/L 和86.2 mg/L(表5)。

表4 化合物对6 种植物病原真菌的抑制作用Table 4 Antifungal effects of compounds against six plant phytopathogenic fungi

表5 化合物6 对水稻纹枯病菌与番茄灰霉病菌的EC50 值Table 5 EC50 value of compound 6 against T. cucumeris and B. cinerea
2.3.2 化合物对病原细菌的抑制作用 采用琼脂稀释法测试了化合物1、3、5 和6 在200 mg/L 时对3 种植物病菌细菌的抑制作用。结果 (表6) 表明,化合物1 在200 mg/L 时对白菜软腐病菌、烟草青枯病菌和猕猴桃溃疡病菌皆有抑制效果。

表6 化合物对3 种植物病原细菌的抑制作用Table 6 Antibacterial activities of compounds against three plant pathogenic bacteria
利用96 孔板进一步测定了化合物1 对不同病原细菌的MIC 值。结果 (表7) 表明:化合物1 对白菜软腐病菌的MIC 为200 mg/L,对金黄色葡萄球菌的MIC 为50 mg/L,对烟草青枯病菌、猕猴桃溃疡病菌和枯草芽孢杆菌的MIC 为100 mg/L。

表7 化合物1 对5 种细菌的最低抑制浓度Table 7 Minimum inhibitory concentration of compound 1 against five bacteria
3 结论与讨论
本研究对硬毛棘豆根75%乙醇粗提物及不同溶剂萃取相进行了抑菌活性评价,从抑菌活性较好的乙酸乙酯相中分离鉴定了6 个化合物,结构类型包括4 个三萜类:β-香树脂醇 (1)、3-Oxoazukisapogenol (2)、3β,22β,24-三羟基齐墩果-12-烯(5) 和azukisapogenol (6),以及两个甾醇类:5α-豆甾-9(11)-烯-3β-醇 (3) 和豆甾-4-烯-3,6-二酮 (4),以上化合物均是首次从硬毛棘豆根中分离获得。3-Oxo-azukisapogenol (2) 最早从镰形棘豆O.falcata中分离鉴定,其立体构型通过X-单晶衍射加以确定,是棘豆属的特征性成分[17]。3β,22β,24-三羟基齐墩果-12-烯 (5) 和azukisapogenol (6) 也是从镰形棘豆、甘肃棘豆、黄花棘豆等棘豆属植物中分离获得[27-28],是棘豆属三萜皂苷的主要苷元。
棘豆属植物具有广泛的抑菌活性。孟根小等的研究发现,与正丁醇和石油醚提取物相比,多叶棘豆乙酸乙酯提取物体外抗菌活性最强,对金黄色葡萄球菌的MIC 和最小杀菌浓度 (MBC) 分别为20 mg/L 和1.25 × 103mg/L[13]。杨震发等的研究结果表明,黄花棘豆乙醇提取物的二氯甲烷相和乙酸乙酯相是其发挥抑菌作用的活性段,在1 ×104mg/L 质量浓度下,其对番茄灰霉病菌的抑制率分别为84.3% 和83.1%[14]。本研究结果表明,硬毛棘豆根75%乙醇粗提物的乙酸乙酯相对水稻纹枯病菌和番茄灰霉病菌具有较好的抑制效果,在1 × 103mg/L 质量浓度下的抑制率分别为57.2%和55.4%,同时,该乙酸乙酯相对烟草青枯病菌和猕猴桃溃疡病菌等病原细菌也有较好的抑制效果。另外,通过活性追踪发现正丁醇相的杀虫活性较好,初步研究结果表明其化学成分主要为齐墩果烷型三萜皂苷。本文主要对抑菌活性较好的乙酸乙酯相进行了系统的抑菌活性成分研究。棘豆属植物的抑菌活性成分具有多样性,黄花棘豆对植物病菌原真菌的抑菌活性成分研究结果表明,紫檀烷类化合物的抑菌活性高于甾体类和三萜类化合物。其中,3-羟基-4,9-二甲氧基紫檀烷和3-羟基-8,9-二甲氧基紫檀烷对番茄灰霉病菌和黄瓜枯萎病菌的EC50值分别为10.4 mg/L 和27.1 mg/L[14]。而本研究结果表明,三萜azukisapogenol (6) 对水稻纹枯病菌与番茄灰霉病菌的菌丝生长速率具有明显的抑制作用,其EC50值分别为117.4 mg/L 和86.2 mg/L;三萜β-香树脂醇 (1)对金黄色葡萄球菌的抑制效果最好,MIC 为50 mg/L,对烟草青枯病菌、猕猴桃溃疡病菌和枯草芽孢杆菌亦有抑制效果,MIC 为100 mg/L。因此,三萜类化合物也是棘豆属植物的抑菌活性成分之一。棘豆属植物是天然草地中的疯草类有毒植物,可危害我国天然草地动物的健康[12]。本文针对几种常见的植物病原真菌与细菌,探究了硬毛棘豆的抑菌活性成分,为棘豆属植物的资源利用与开发奠定了理论基础。

