肝癌细胞仑伐替尼耐药的基因筛选及其通路研究
陈家诚,刘路政,陈良,陈骋,许达峰,林仕勋,罗相相,武金才
(海南省人民医院/海南医学院附属海南医院 肝胆胰外科,海南 海口 570311)
原发性肝细胞肝癌(以下简称为肝癌)在我国发病率和病死率均较高,虽然手术切除是肝癌治疗的主要手段,但大部分肝癌患者确诊时肿瘤已处于中晚期,失去手术机会[1]。近年来,靶向药物及免疫治疗逐渐被应用于中晚期或术后复发转移的肝癌患者,为肿瘤降级转化后外科治疗创造了机会,也显著延长了患者的总生存期[1-2]。仑伐替尼(Lenvatinib)作为新一线肝癌靶向治疗药物在中晚期肝癌治疗中取得一系列亮眼的成绩,但其耐药问题也逐渐成为患者改善预后的主要障碍。然而,仑伐替尼耐药的潜在分子机制尚不清楚。本实验基于CRISPR/Cas9 sgRNA全基因组文库结合Affymetrix表达谱芯片筛选出仑伐替尼耐药相关基因THOC2,并探索其具体分子机制,现报道如下。
1 材料和方法
1.1 实验材料
人SMMC-7721、MHCC-97H及MHCC-LM3肝癌细胞购于和元生物技术(上海)股份有限公司,细胞均无支原体等污染。仑伐替尼敏感与耐药肝癌患者癌组织与癌旁组织样本(各6例)取自海南省人民医院肝胆胰外科标本库,并遵从《赫尔辛基宣言》要求,签署伦理知情同意书。样本自离体30 min内液氮速冻,并在-80℃冰箱内保存。稳定细胞株构建中聚凝胺、嘌呤霉素购买于德国Sigma公司,杀稻瘟菌素购于上海翊圣生物科技有限公司。所有细胞均在含10%的胎牛血清(购于美国GIBCO公司)和1%的双抗(青霉素和链霉素,购于美国Invitrogen公司)条件的杜氏改良培养基(购于美国GIBCO公司)中培养,细胞传代胰酶购于美国Invitrogen公司。THOC2、BAX、cyclinD1、c-Myc(一抗)购于上海艾博抗公司,磷酸甘油醛脱氢酶GAPDP(一抗)、二抗、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒购买于上海碧云天生物技术有限公司,IC50 CellTiter-Glo®试剂盒购于美国Promega公司,免疫共沉淀试剂盒购于美国赛默飞公司。仑伐替尼购买于日本卫材公司。
1.2 稳定细胞株的构建
构建对照慢病毒(空载体Empty)和目的病毒THOC2,然后将其感染SMMC-7721细胞。72 h以后,加入终浓度5 μg/mL的杀稻瘟菌素。每隔2~3 d更换1次含5 μg/mL杀稻瘟菌素的新鲜培养基,配合药物筛选获得稳定THOC2高表达的SMMC-7721-THOC2和对照SMMC-7721-Empty肝癌细胞。
1.3 CRISPR/Cas9 sgRNA全基因组文库筛选
选择人SMMC-7721 肝癌细胞,支原体检测合格后,行细胞倍增时间测试、Puromycin筛选预实验;IC50 实验(共3 次)及药物的最适浓度确定:确定仑伐替尼作用SMMC-7721 细胞株48 h或72 h的IC50,以不同药物浓度(μg/mL)处理细胞14 d,得到药物浓度为2 μg/mL时细胞抑制率为36.42%,并选择以此浓度进行后续正式实验。文库慢病毒扩增包装:行Cas9 sgRNA文库扩增,包装慢病毒;Cas9-sgRNA文库(GeCKO library,含19 050个靶向基因和1 864个microRNA,且每个靶点设计6条sgRNA,共计12 万种慢病毒载体)慢病毒感染:大规模扩增SMMC-7721细胞,感染慢病毒,并控制MOI,使大部分细胞只感染一个病毒,嘌呤霉素药筛;细胞加药培养:加入仑伐替尼(浓度为2 μg/mL)后共培养细胞,分别在第0天、7天、14天收耐药细胞;sgRNA扩增:细胞基因组DNA纯化后使用特异引物扩增sgRNA;高通量测序及数据分析:高通量测序定量分析sgRNA在3 个时间点的变化,筛选仑伐替尼敏感相关的候选基因,包括:测序数据质量分析;测序数据分布等。
1.4 Affymetrix基因表达谱芯片
将待检测的12 例仑伐替尼耐药组及敏感组肝癌组织进行研磨预处理,使用TRIzol法抽提组织总RNA,并使用天根RNeasy试剂盒进一步的纯化。反转录合成双链cDNA,准备IVT混合液,体外转录合成标记cRNA,提前在50~60 ℃预热aRNA Elution Solution,10 min后进行aRNA纯化。准备aRNA片断化混合液并进行片断化反应,室温平衡芯片,同时加适量预杂交液至芯片,芯片预热10 min。杂交液于99 ℃加热5 min后,45 ℃放置5 min,最大速度离心杂交液5 min。将处理后杂交液加至芯片,45 ℃,60 rpm杂交16 h。最后,进行洗涤、染色和芯片扫描分析。
1.5 逆转录聚合酶链式反应(reverse transcription-PCR,RT-PCR)
采用两步法进行RT-PCR。首先,将已抽提好的肝癌组织和细胞株RNA和稀释处理后的Oligo(dT)15混匀离心,70 ℃净置5 min,立即冰水浴,稍离心。根据M-MLV反转录说明书配制反应体系,混匀后离心,完成逆转录反应。将PCR反应试剂按照比例配制包含引物(引物信息:THOC2 引物正向序列:5’-ACATTGCCTTGAAACAGGCG-3’,反向序列:5’-A CTGCCCAGAGTAGCCCATA-3’;GAPDH引物正向序列:5’-GAAGGTGAAGGTCGGAGTC-3’,反向引物序列:5’-GAAGATGGTGATGGGATTTC-3’),混匀,97 ℃反应5 min,立即冰水浴,混匀。经预变性、变性、退火、延伸及终末延伸共28~36个循环,4 ℃保存。最终,加(1~10)μL PCR产物和溴芬兰(1~2.5)μL混匀,加样,电泳。
1.6 Western blotting分析
提取已建立的SMMC-7721-THOC2 和SMMC-7721-Empty细胞的总蛋白并检测浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,湿转法转模。封闭,孵育一抗与GAPDH(5% BSA-PBST稀释)4 ℃过夜。洗膜后孵育二抗。采用增强化学发光法显色,全自动化学发光成像分析系统曝光,软件Image J对图像进行灰度分析。
1.7 免疫共沉淀(co-immunoprecipitation,Co-IP)分析
根据Co-IP试剂盒说明书,在上述稳定构建的SMMC-7721-THOC2细胞基础上,使用双琥珀酰亚胺辛二酸酯交联抗体和磁珠,用含有蛋白酶抑制剂(Termo,Waltham,MA)的Pierce免疫共沉淀裂解缓冲洗裂解细胞。在4 ℃与细胞裂解液孵育过夜后,用细胞裂解缓冲液洗涤。从磁珠中分离出蛋白并进一步分析。
1.8 病理和免疫组织化学(immunohistoche-mical staining,IHC)染色分析
将临床获得的12例仑伐替尼敏感组与耐药组肝癌患者癌组织分别制成石蜡切片,烘烤后经二甲苯、乙醇脱蜡,苏木素染10 min,流水冲洗后70%和90%酒精中脱水各10 min,入酒精伊红染色液染色2~3 min。再次脱水后经二甲苯透明后中性树胶封片。上述对蜡片载玻片进行抗原回收处理。之后,组织切片冷却和封闭,然后分别用相关抗体孵育。随后,将肿瘤标本切片与酶标二抗混合。最后观察载玻片。
1.9 生物信息学分析
采用肿瘤与癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据集进行基因的表达和预后分析(http://starbase.sysu.edu.cn/panCancer.php),GCBI数据库(https://www.gcbi.com.cn)预测基因相关转录因子。
1.10 统计学分析
使用Graphpad Prism 8软件整理数据和绘图,计量资料两组比较采用t检验。生存分析采用Kaplan-Meier法,生存曲线采用Log-rank检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 全基因组CRISPR/Cas9结合Affymetrix基因表达谱芯片筛选肝癌与仑伐替尼靶向耐药相关基因
我们在Cas9药筛第7天分析(Day7vsDay0)共发现339个具有敲除后药效增敏作用的关键基因,即肝癌细胞对仑伐替尼不敏感或耐药的相关基因;在给药第14天收集分析(Day14vsDay0)共发现1 438个上述基因;且其中共53个基因出现在第7和14天的交集(Day7 vs Day14)中,提示这些基因可能具有更重要的研究价值。进一步,我们应用Affymetrix表达谱芯片分析了12 例肝癌组织样本(其中仑伐替尼敏感组6例,耐药组6例),结果提示共有1 233个差异表达基因(Fold change≥2)(见图1A),其中THOC2、CTNNB1(β-catenin)、MET(c-Met/HGFR)、HTATIP2、C10orf11、PRDX3、MAST4等7个基因存在于上述(Day7vsDay14)53 个交集基因中(见图1B、1C),其在仑伐替尼耐药组中的表达显著高于敏感组;且聚类分析发现该7个基因可以较好地将两组区分开来(见图1D)。
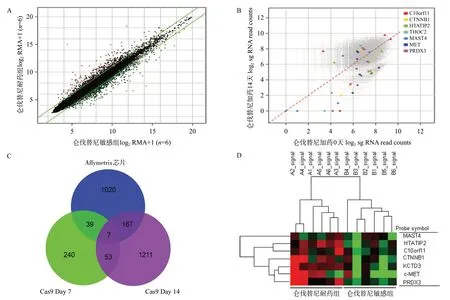
图1 全基因组CRISPR/Cas9结合Affymetrix基因表达谱芯片筛选肝癌与仑伐替尼靶向耐药相关基因
2.2 差异基因的生物信息学分析
我们使用TCGA 数据库中LIHC(Liver Hepatocellular Carcinoma,肝细胞癌)的数据(http://starbase.sysu.edu.cn/panCancer.php)分析提示,上述7个耐药基因中3个基因(C10orf11、PRDX3、MAST4)在癌组织与癌旁组织中表达水平均未见统计学差异,且除PRDX3外均无生存相关;其余4 个基因(β-catenin、c-Met、THOC2和HTATIP2)中,THOC2在癌与癌旁中表达存在显著统计学差异(见图2A),且与肝癌临床分期及预后呈负相关(见图2B、2C)。进一步对我院临床肝癌及癌旁组织IHC检测也提示THOC2蛋白在癌组织的表达(主要在细胞核)高于癌旁组织(见图2D、2E、2F、2G)。

图2 差异基因THOC2在TCGA数据库及THOC2蛋白肝癌组织中的表达差异
2.3 TCF家族可作为THOC2核转录的潜在调控因子
进一步我们预测调控THOC2的转录因子发现:Wnt通路关键转录因子TCF蛋白家族可能调控THOC2进而影响下游Wnt通路(https://www.gcbi.com.cn/gcanalyze/html/generadar/search/singlegene/regregulat/THOC2),预测提示THOC2与TCF(TCF 1、3、4、11)存在结合位点(且存在SNP),进而参与调控Wnt/β-catenin通路(见图3,表1)。
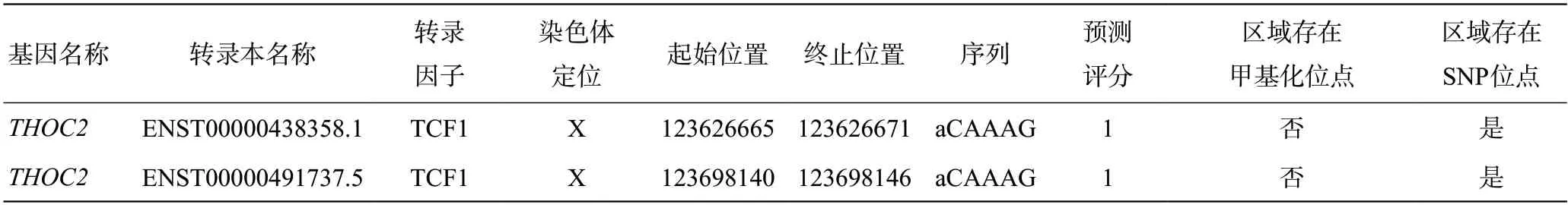
表1 THOC2可能结合位点
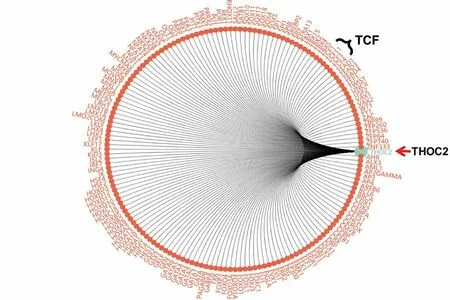
图3 THOC2核转录的潜在调控因子预测分析显示Wnt通路关键转录因子TCF蛋白家族与THOC2密切相关
2.4 THOC2与Wnt/β-catenin通路在肝癌仑伐替尼耐药中的关系
我们构建THOC2过表达质粒并成功稳定转染SMMC-7721 细胞(见图4A),Western blotting检测发现:与对照组细胞相比,高表达THOC2细胞(SMMC-7721-THOC2)中BAX、cyclinD1、c-myc和β-catenin的表达水平显著增高(见图4B、4C),提示THOC2表达可能导致Wnt/β-catenin经典通路下游靶基因的激活;在此基础上,免疫共沉淀(Co-IP)初步分析提示THOC2与β-catenin存在密切相关(见图4D)。进一步,IHC、RT-PCR和Western blotting检测上述仑伐替尼敏感及耐药组肝癌中THOC2和β-catenin的表达发现:THOC2和β-catenin在肝癌组织中存在差异化表达,THOC2在肝癌仑伐替尼耐药组中的表达水平高于敏感组(见图4E、4F、4G);同时分析显示THOC2在SMMC-7721、MHCC-97H和MHCC-LM3不同肝癌细胞中亦存在差异表达,且在高转移潜能肝癌细胞株中表达较高(见图4H)。
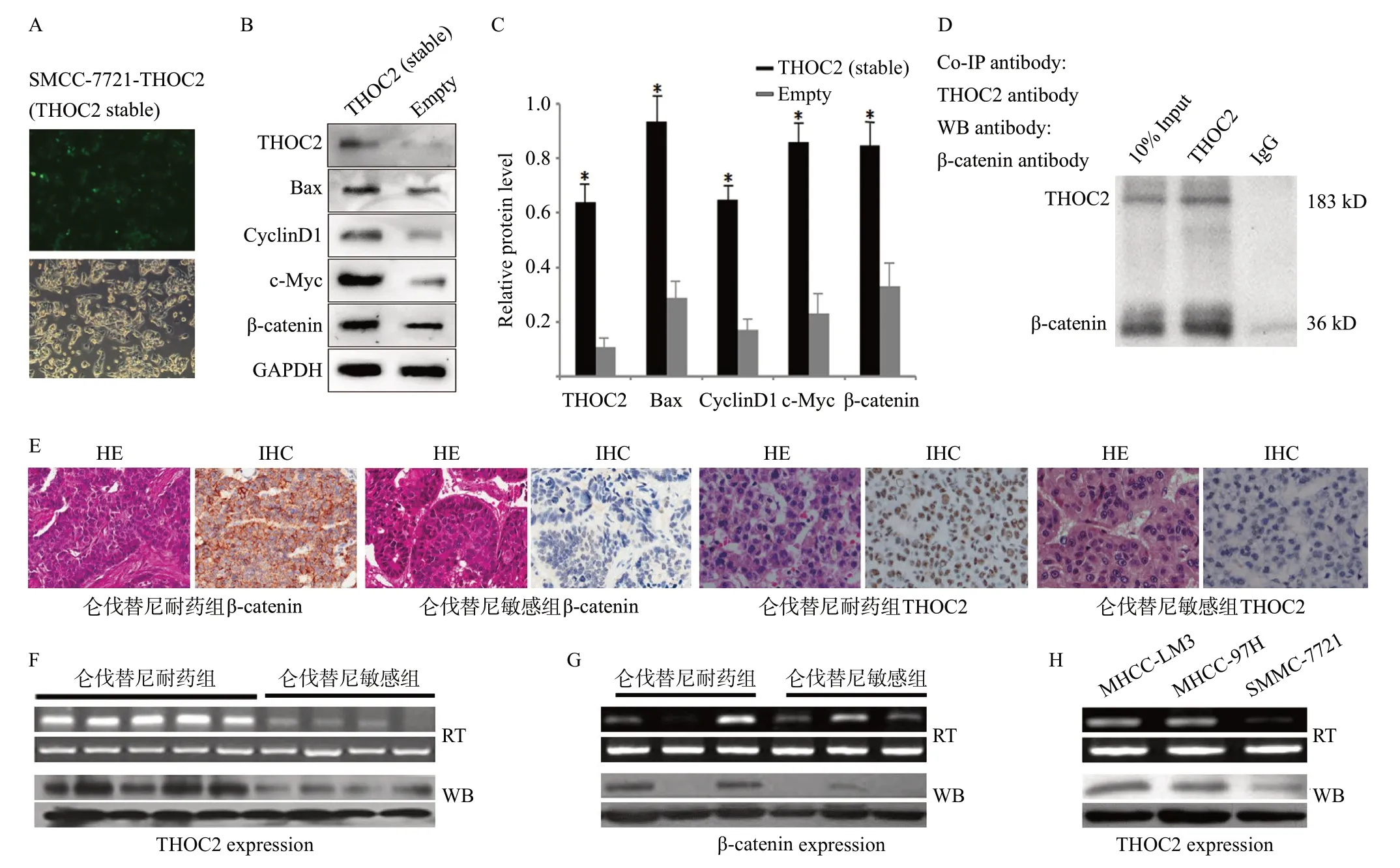
图4 THOC2与Wnt/β-catenin通路在肝癌仑伐替尼耐药中的关系分析
3 讨论
肝癌是我国常见的恶性肿瘤之一,其发病率、病死率高,术后易复发及转移,严重危害着我国公民的健康。2018年仑伐替尼获FDA审核成了治疗肝癌的新一线用药,用于不可切除的肝细胞癌,改善了肝癌靶向治疗缺药的现状[3]。我们近期的临床实践发现,部分中晚期肝癌患者在单药服用仑伐替尼治疗后,疾病尚未缓解甚至出现进展,提示仑伐替尼不敏感或耐药。因此,明确肝癌仑伐替尼耐药相关基因,早期检测评估肝癌患者对仑伐替尼的敏感性并进行前瞻性用药指导,具有重要的临床意义。
仑伐替尼是口服多靶点的药物,抑制参与肿瘤增殖的其他促血管生成和致癌信号通路相关RTK,主要靶点包括VEGFR1-3、FGFR1-4、PDGFR-a、KIT、RET等[4-5]。本实验基于CRISPR-Cas9 sgRNA全基因组文库筛选技术结合Affymetrix表达谱芯片,结果分析存在THOC2、CTNNB1(β-catenin)、MET(c-Met/HGFR)、HTATIP2、C10orf11、PRDX3、MAST4等7 个仑伐替尼耐药相关基因。我们通过TCGA数据分析发现3 个基因(C10orf11、PRDX3、MAST4)在肝癌与癌旁中表达水平均未见统计学差异、且除PRDX3外均无生存相关。研究已表明:c-Met、HTATIP2、PRDX3、MAST4均可参与PI3K/ALK/Akt通路,其中c-Met尚可参与Ras-Rac/Rho通路、HTATIP2可介导JAK-STAT3、MAST4可参与PI3K-Akt-mTOR通路[6-9];而c-Met和HTATIP2已被发现可分别导致肝癌对仑伐替尼和索拉非尼耐药[6,10];β-catenin可介导Wnt/β-catenin通路,促进肝癌发生发展,且与肝癌对索拉非尼耐药密切相关[11-12]。β-catenin、c-Met和HTATIP2已在肝癌中已多有报到并与肝癌耐药相关,尚未见THCO2在肝癌耐药中可能的相关研究报道。
THOC2为THO复合物(THO complex)的一员,定位于染色体Xq25,含13.2 kb序列,编码含1593氨基酸的蛋白(分子量为18.3kDa),常表达于细胞核中,参与mRNA转录,在转录延伸、核RNA输出和基因组稳定中起着重要的调控作用[13-14]。在肿瘤相关研究中,THOC2可促进黑色素瘤侵袭增殖,并且在其在肿瘤组织高表达与预后相关[15]。在耐辐射三阴性乳腺癌(TNBC)细胞中,THCO2上调并通过促进性别决定区Y-盒转录因子SOX2 和同源盒转录因子NANOG转录产物的核释放,以THOC5依赖的方式促进TNBC细胞的干性和抗辐射能力。我们通过TCGA数据库分析表明,THOC2在肝癌较癌旁组织中高表达,且与患者临床分期及预后密切相关。细胞水平发现上调THOC2(SMMC-7721细胞株)可使Wnt/β-catenin经典通路下游BAX、cyclinD1和c-myc蛋白水平显著增高,免疫共沉淀同时表明THOC2与β-catenin存在密切相关。进一步IHC、RT-PCR和WB提示THOC2 和β-catenin在肝癌组织和中存在差异化表达,THOC2及β-catenin在仑伐替尼肝癌耐药组中的表达高于敏感组,且THOC2在高转移潜能肝癌细胞株MHCC-LM3、MHCC-97H中较SMMC-7721细胞表达增高。有相关研究报道,干扰THOC2 可明显抑制肝癌细胞增殖和侵袭能力,并且外泌体THOC2联合MYL6B可作为HCC预后和复发风险预测的分子标志物,这与我们的研究结果一致。因此,THOC2可能是导致肝癌仑伐替尼耐药及复发转移的关键基因。
综上,我们基于CRISPR-Cas9 sgRNA全基因组耐药筛选得到的THOC2基因高表达可介导Wnt/β-catenin通路并与仑伐替尼耐药密切相关;THOC2基因在仑伐替尼肝癌靶向耐药中可能具有潜在的重要临床价值。

