超声引导下中心静脉导管技术治疗糖尿病合并胃癌的疗效分析*
朱虹,韩世权,房开宇,马新跃,彭湃
(大连市中心医院1.内科重症监护病房,2.超声影像科,辽宁大连116089)
中心静脉导管技术在临床上广为应用,具有操作简单、安全性高、创伤小的特点[1-2]。其主要用于肿瘤的治疗,并可当做药物通道[3-4]。近年来胃癌患者越来越多,糖尿病是其常见并发症。目前研究认为,胃癌合并糖尿病是代谢紊乱、氧化应激、血管功能障碍等因素共同作用的结果[5-6]。糖尿病患者的血管较脆、较窄,导致中心静脉导管穿刺成功率较低。有研究表明,超声引导下中心静脉导管技术可降低穿刺并发症发生率[7-8]。本研究旨在探究超声引导下中心静脉导管技术治疗糖尿病合并胃癌的疗效,以及对脂肪因子、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)表达的影响。
1 资料与方法
1.1 临床资料
选取2018年1月—2019年6月在大连市中心医院接受治疗的糖尿病合并胃癌患者150 例,将所有患者随机分为直接盲穿组和超声引导组,各75 例。直接盲穿组男性38 例,女性37 例;年龄48~73 岁,平均(60.3±10.2)岁;病程2~8 个月,平均(5.2±2.3)个月。超声引导组男性37 例,女性38 例,年龄48~74 岁;平均(60.6±10.7)岁;病程1~7 个月,平均(4.8±7.8)个月。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准①确诊为糖尿病合并胃癌;②未曾使用胰岛素治疗;③一般资料齐全。
1.2.2 排除标准①合并有其他重要器官严重病症者;②排除依从性较差患者;③排除非自愿参加患者。
1.3 方法
1.3.1 治疗方法①超声引导组采用超声引导下中心静脉导管技术治疗糖尿病合并胃癌。患者平卧,穿刺侧手臂外侧与躯干呈垂直角度,用超声探头探查内侧重要静脉区域,并在皮肤上方进行标记,测量导管置入长度,测量位置为标记处至右侧胸锁关节至第3 肋间距离,并记录预置管长度和臂围。将探头和导线进行无菌处理,扎紧压脉带,紧靠探头内侧,采用动态跟踪超声图像进行穿刺。回血后调低穿刺针,退出穿刺点,导丝固定。患者局部麻醉后在穿刺点做皮肤切口,切口位置位于导丝上方和导丝平行角度处。将导丝传入导入鞘和扩张器中,缓慢推进,直至全部送入血管,分离扩张器,导入鞘锁件,取出导丝和扩张器。将中心静脉导管从鞘口置入,到达所需长度时开始撤鞘,使用X射线确认导管位置。②直接盲穿组:医师根据经验对患者进行血管穿刺。选取2 位经验丰富医师,预置导管长度,用臂围止血带使患者静脉充盈后进行穿刺。回血后降低针头角度,进入1~2 mm,单独推进外套管,避免损伤血管壁。撤出针芯并压迫止血,使用X 射线确认导管位置。
1.3.2 脂肪因子检测上午7:50 抽取两组研究对象空腹静脉血6 mL,置于抗凝管中保存。3 000 r/min 离心20 min 分离血清,置入-20℃冰箱保存待用。采用酶联免疫吸附试验检测抵抗素、瘦素、脂联素水平,酶联免疫试剂盒购自北京博奥森生物技术有限公司,型号分别为bsk00191、bsk00102、bsk00199,实验步骤参照试剂盒说明书。
1.3.3 胰岛素样生长因子受体1(insulin-like growth factor receptor-1, IGFR-1)、人第10 号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome 10, PTEN)、IGF-1 检测采用流式细胞仪(上海Cytek Biosciences 公司,型号:N7-00003-0A)检测外周血IGFR-1、PTEN、IGF-1 水平。取两组血标本各5 μL加入IGFR-1、PTEN、IGF-1,再加入Mouse g1-PE、RGDS 各10 μL,混合均匀,室温环境下避光孵育15 min,加入磷酸盐缓冲液0.5 mL 稀释后上机检测。
1.3.4 肿瘤标志物检测采用全自动化学发光仪(美国贝克曼库尔特公司免疫分析系统UniCel DxI 800)检测患者癌胚抗原、糖类抗原19-9 水平。
1.3.5 穿刺及术中血管损伤、导管漂移情况统计穿刺成功例数和术中血管损伤、导管漂移例数。穿刺成功率=(置管成功例数/置管总例数)×100%。
1.3.6 疗效分析①完全缓解(complete response,CR):患者体内病灶完全消失;②部分缓解(partial response, PR):患者体内病灶缩小30%以上;③疾病稳定(stable disease, SD):患者体内病灶有一定缩小但未达到PR,或有一定扩大但扩大不明显;④疾病进展(progressive disease,PD):患者体内病灶扩大20%以上或者出现新肿瘤组织。总有效率=CR+PR。
1.4 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后抵抗素、瘦素、脂联素的变化
两组患者治疗前后抵抗素、瘦素、脂联素的差值比较,经t检验,差异有统计学意义(P<0.05),超声引导组降低的幅度大于直接盲穿组。
2.2 两组患者IGFR-1、PTEN、IGF-1 蛋白相对表达量比较
超声引导组与直接盲穿组IGFR-1、PTEN、IGF-1 蛋白相对表达量比较,经t检验,差异有统计学意义(P<0.05),超声引导组IGFR-1、IGF-1 蛋白相对表达量低于直接盲穿组,PTEN 蛋白相对表达量高于直接盲穿组。
表1 两组患者治疗前后抵抗素、瘦素、脂联素的差值比较(n=75,ug/L,±s)

表1 两组患者治疗前后抵抗素、瘦素、脂联素的差值比较(n=75,ug/L,±s)
组别直接盲穿组超声引导组t 值P 值抵抗素-2.18±0.44-4.88±0.97 3.465 0.001瘦素-0.40±0.08-0.88±0.13 27.230 0.001脂联素-8.47±2.13-23.49±4.88 24.430 0.001
表2 两组患者IGFR-1、PTEN、IGF-1蛋白相对表达量比较 (n=75,%,±s)
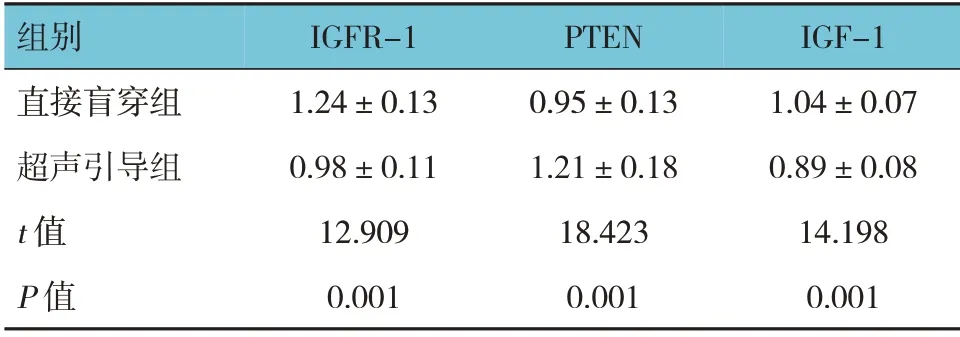
表2 两组患者IGFR-1、PTEN、IGF-1蛋白相对表达量比较 (n=75,%,±s)
组别直接盲穿组超声引导组t 值P 值IGFR-1 1.24±0.13 0.98±0.11 12.909 0.001 PTEN 0.95±0.13 1.21±0.18 18.423 0.001 IGF-1 1.04±0.07 0.89±0.08 14.198 0.001
2.3 两组患者治疗前后肿瘤标志物的变化
两组患者治疗前后癌胚抗原、糖类抗原19-9的差值比较,经t检验,差异有统计学意义(P<0.05),超声引导组降低的幅度大于直接盲穿组。
表3 两组患者治疗前后癌胚抗原、糖类抗原19-9的差值比较 (n=75,±s)
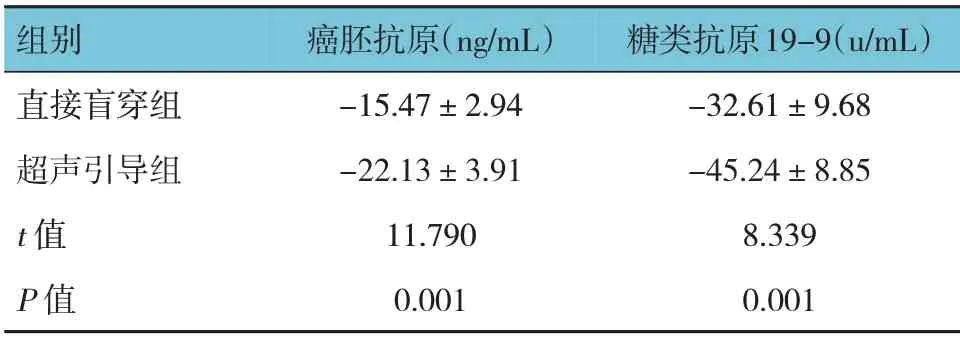
表3 两组患者治疗前后癌胚抗原、糖类抗原19-9的差值比较 (n=75,±s)
组别直接盲穿组超声引导组t 值P 值癌胚抗原(ng/mL)-15.47±2.94-22.13±3.91 11.790 0.001糖类抗原19-9(u/mL)-32.61±9.68-45.24±8.85 8.339 0.001
2.4 两组患者穿刺成功和术中血管损伤、导管漂移例数比较
超声引导组与直接盲穿组一次穿刺成功率、总成功率、导管漂移发生率、血管损伤发生率比较,经χ2检验,差异有统计学意义(P<0.05),超声引导组患者一次穿刺成功率、总成功率高于直接盲穿组,血管损伤发生率、导管漂移发生率低于直接盲穿组。
2.5 两组患者治疗效果比较
超声引导组与直接盲穿组总有效率比较,经χ2检验,差异有统计学意义(χ2=7.946,P=0.005),超声引导组高于直接盲穿组。

表4 两组患者穿刺和术中血管损伤、导管漂移情况比较[n=75,例(%)]
2.6 两组患者不良反应发生率比较
超声引导组与直接盲穿组不良反应发生率比较,经χ2检验,差异有统计学意义(χ2=5.042,P=0.025),超声引导组低于直接盲穿组。
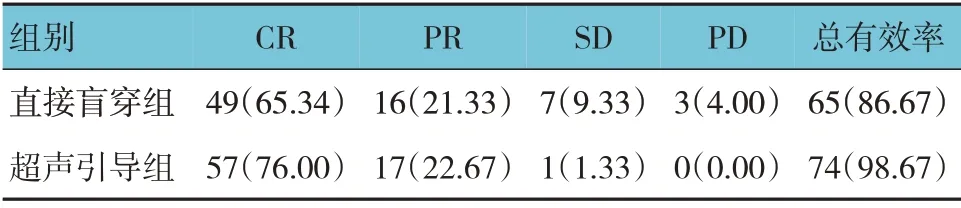
表5 两组患者治疗效果比较 [n=75,例(%)]
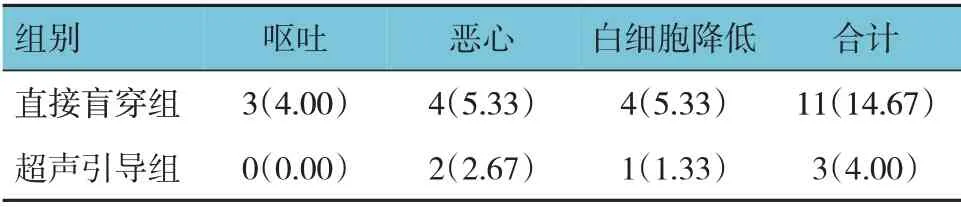
表6 两组患者不良反应发生率比较 [n=75,例(%)]
3 讨论
胃癌是一种常见的恶性肿瘤,其发病率在我国一直居高不下[9-10]。由于工作压力大、饮食改变等原因,导致胃癌发病率越来越高,并且呈年轻化趋势[11-12]。脂肪因子是脂肪组织分泌的细胞因子,瘦素由肥胖基因转录翻译而来,胃癌患者的瘦素表达水平与健康人群有差异。抵抗素具有抵抗胰岛素的作用,可通过介导IGF-1 从而影响胃癌的病程进展。脂联素与多种癌症的发生、发展有关,可以作为胃癌治疗和预防的靶点[13-14]。有研究结果表明,脂肪因子对胃癌的增殖能力有一定影响。还有研究结果表明,糖尿病合并胃癌患者的抵抗素、瘦素、脂联素存在异常表达[15]。上述研究说明脂肪因子在胃癌的发生、发展中发挥重要作用。本研究中患者的抵抗素、瘦素、脂联素水平得到有效控制,说明超声引导下中心静脉导管技术治疗糖尿病合并胃癌疗效显著。
IGFR-1、PTEN、IGF-1 能反映胃癌患者病情严重程度。IGF-1 是一类多功能细胞增殖调控因子,在细胞分化、个体生长发育中发挥促进作用,对胃癌血红素氧合酶-1 的表达有影响。IGF-1 对肿瘤细胞具有强丝裂原效应,可抑制胃癌细胞凋亡,促进增殖,与胃癌的发生、发展及转移有关[16-17]。有研究结果表明,IGFR-1、PTEN、IGF-1 与胃癌的发生、发展关系密切,能够反映病情严重程度[18]。本研究中患者IGFR-1、PTEN、IGF-1 水平得到有效控制,说明采用超声引导下中心静脉导管技术治疗糖尿病合并胃癌疗效显著。
癌胚抗原和糖类抗原19-9 与患者的临床病理特征有关[19-20]。临床上通常采用癌胚抗原和糖类抗原19-9 来评估患者病情变化。本研究中患者癌胚抗原和糖类抗原19-9 水平得到了有效的控制,说明超声引导下中心静脉导管技术治疗糖尿病合并胃癌,能够减少癌细胞转移。
有研究结果表明,中心静脉导管技术失败的主要原因为血管损伤和导管漂移[21]。胃癌患者置管失败的主要原因是营养状况较差和置管位置选择错误。本研究结果表明,超声引导下中心静脉导管技术治疗糖尿病合并胃癌能够提高患者置管成功率,降低术中血管损伤和导管漂移发生率。
综上所述,超声引导下中心静脉导管技术治疗糖尿病合并胃癌可调控患者脂肪因子、IGF-1 水平,降低手术过程中血管损伤和导管漂移的发生率。

