R环的形成及其在疾病中的作用研究进展
杜志鹏,杨彦勇,蔡建明,
1.温州医科大学 公共卫生与管理学院,浙江 温州 325035;2.中国人民解放军海军军医大学 海军医学系舰船辐射医学防护教研室,上海 200433
DNA复制是DNA聚合酶采用半保留的方式合成双链DNA(double-stranded DNA, dsDNA)的过程,而基因转录则是RNA聚合酶利用dsDNA中的一条链为模板合成RNA的过程。R环是当RNA链侵入dsDNA时形成的核酸结构。在复制过程中,DNA会解开双螺旋,因5’→3’方向的链不能连续合成新链,此时5’→3’方向的模板链上会出现单链DNA(single-stranded DNA, ssDNA),给R环的形成创造了机会。在细胞中,R环还会阻碍复制叉的进行,影响DNA的正常复制,进而影响基因组的稳定性[1]。在DNA转录时,RNA聚合酶解绕DNA并合成5’→3’方向的RNA链,这会在前进的RNA聚合酶后面产生负超螺旋,促进R环的形成。dsDNA R环的形成和调控具有复杂的生物学机制,在生物进化中产生了多种途径来减少R环对基因组稳定性的影响。本篇综述围绕R环的产生、修复的影响因素及主要机制,以及其在肿瘤等疾病发生发展治疗中的作用和应用前景进行讨论。
1 R环的形成与常用检测方法
1.1 R环的定义 R环是指在转录过程中,某些基因转录mRNA难与模板链分离时,由mRNA取代非模板链,形成由互补的DNA模板链上的RNA杂合体和非模板链上的ssDNA组成的三链裸露环,为非B DNA结构。通常,R环在伸长的RNA聚合酶后面形成,偶尔也会在新生RNA与聚合酶前面的DNA模板杂交,产生前R环[2]。
1.2 R环的分类 R环有两种类型:生理性和病理性R环。生理性R环通常依赖于需要特定因素的程序化过程来保证它们的形成;病理性R环以非预定方式意外发生。
生理性R环作为特定细胞过程中的关键中间体自然形成,例如基因表达调控、DNA损伤修复、免疫球蛋白类转换重组(immunoglobulin class switch recombination, CSR)、大肠杆菌质粒复制和线粒体DNA复制等。R环参与的主要生理学过程包括:①基因表达调控。一些哺乳动物基因3’端的R环可以帮助RNA聚合酶停止转录[3],从而参与基因的表达调控。②DNA损伤修复。DNA损伤修复主要包括同源重组(homologous recombination, HR)以及非同源末端连接(non-homologous end joining, NHEJ)。R环会影响复制蛋白A(replication protein A, RPA)蛋白的招募,过多或者过少的R环均会引起HR修复的异常[4]。③CSR。在一项理论中,稳定的R环结构为激活诱导的胞苷脱氨酶(activation-induced cytidine deaminase, AID)提供了ssDNA底物,以启动CSR过程[5]。AID将胞嘧啶转化为尿嘧啶,当被碱基切除修复机器处理时会导致DNA切口。当错配修复蛋白作用于该DNA缺口时,会导致dsDNA断裂。最后,末端连接DNA修复导致Ig类转换。见表1。

表1 R环在不同生物学过程中起的作用
病理性R环的形成频率异于一般R环的形成频率,并且可能会影响基因表达和基因组的完整性。病理性R环常见于以下环节:①R环参与复制叉冲突过程。在基因复制时会形成复制叉。R环可能会在复制叉冲突期间诱导DNA断裂造成DNA损伤[6]。②R环参与DNA错误切除。转录偶联核苷酸切除修复(transcription-coupled nucleotide excision repair, TC-NER)能去除转录阻断、庞大的DNA损伤,TC-NER核酸酶XPG和XPF可以切除阻止转录的R环,留下一个ssDNA缺口,导致DNA断裂[7]。③R环参与DNA双链断裂(DNA double strand break, DSB)修复。持续存在的R环会阻碍DNA修复因子与DSB的结合[8],并导致异常修复。
研究表明,R环可能与一些起点识别复合物共定位于复制起点,参与大肠杆菌线粒体的复制[9]。此外,R环容易在细菌DNA中的负超螺旋或在真核生物中暂时于RNA聚合酶后面的负超螺旋处生成。R环形成时会吸收负超螺旋的能量,从而使DNA纤维恢复到能量更低的部分或完全松弛状态。具有更有利的碱基配对特性的R环需要较少的DNA弛豫能量,而在较不利的区域上形成R环则需要更强的负超螺旋,以助其形成和稳定[10]。DNA促旋酶具有将负超螺旋引入DNA的能力,是转录相关的超负超螺旋和R环形成的主要驱动力[11]。
1.3 R环的常用检测方法
1.3.1 电泳技术:自1976年R环被首次描述[12],研究者们已经开发了多种技术研究真核生物的R环。在这些技术中,比较经典的就是电泳技术。R环结构在琼脂糖凝胶电泳中迁移的速度较慢,并且在体外转录后可以用溴化乙锭(EtBr)观察[5,13]。电泳中的条带表现出对RNase A的抗性和对RNase H1的敏感性,据此可以利用RNase A提高R环的浓度。由于EtBr是一种强诱变剂,可致畸和致癌,在后续的R环检测技术发展成熟后,凝胶电泳检测R环的技术逐渐被淘汰。
1.3.2 DNA-RNA免疫沉淀技术
1.3.2.1 DRIP-seq技术:在1986年,一种强大的全基因组技术DRIP-seq被报道用于R环的检测,该技术使用S9.6抗体沉淀DNA-RNA杂交体,然后进行高通量测序,从而鉴定R环的结构和序列信息[14]。DRIP-seq在技术上要求较低,需要的起始原料较少,耗时较少,却可提供有关基因组中R环分布的有用且可靠的信息,但是它的分辨率有限,并且不提供有关特异链的信息。
1.3.2.2 DRIPc-seq技术:有研究者在DRIP-seq技术的基础上研发了新的检测方法,其中一种是名为DRIPc-seq的技术,这是一种近碱基对分辨率和链特异性的方法,可在任何细胞群体中准确定位R 环[15]。由于DRIPc-seq信号绝大多数是链特异性的,因此对核糖核酸酶H(ribonuclease H, RNase H)预处理非常敏感,以致于无法在免疫沉淀之前从经过RNase H处理的样品中建立测序文库[16]。另外,细胞中短的R环序列是不太稳定的,而且抗体可能会以高特异性沉淀结合更长的R环结构域[17]。
1.3.2.3 ssDRIP-seq技术:ssDRIP-seq技术是一种基于ssDNA连接的文库制备技术,用于R环的全基因组鉴定。与DRIPc-seq方法相比,它可以区分特定的DNA链,并且ssDRIP-seq需要更少的文库构建步骤。当在拟南芥中使用时,ssDRIP-seq表现出高效率、低偏差和链特异性,并且利用该技术发现了拟南芥中一个先前未检测到的R环[18]。
1.3.3 其他方法:此外,还有一些方法,例如通过成像和荧光原位杂交(fluorescence in situ hybridization, FISH)方法将R环可视化[19]。通过检测R环相关蛋白来研究R环的方法,如用免疫荧光法检测RNA解旋酶DExH-box解旋酶9(DExH-box helicase 9, DHX9)[20]。作为鉴定dsDNA螺旋中扰动的方法,亚硫酸氢盐修饰可用于检测R环[5]。
2 影响R环形成的因素
细胞通过3种不同类型的因素保护基因组免受病理性R环积累的影响:①阻止R环形成的因素,在大多数情况下是RNA结合和加工因子,以及染色质重塑剂;②去除R环的因素,例如核糖核酸酶和DNA-RNA解旋蛋白;③在修复或复制过程中直接或间接帮助去除R环的DNA修复因子。
2.1 促进R环形成的因素
2.1.1 促进生理性R环的因子:R环是调节基因组动力学多个过程所需要的中间体,它参与了基因的复制、转录以及其他许多生理过程,因此促进生理性R环的形成对于细胞正常的生理活动具有十分重要的意义。例如,在基因转录和表达中,在CpG岛上形成的R环保护这些区域免受DNA甲基化的影响,最终避免了转录沉默。细胞中CSR[5]存在也会促进R环的形成。受刺激的B细胞中S区的转录,促进了R环的形成,最终促进Ig类别转换。在DNA损伤修复过程中,MRN复合体(MRE11-RAD50-NBS1)启动的DSB切除可导致断裂处的瞬时R环形成,从而在调节HR修复中发挥作用[21-22]。低渗胁迫诱导核仁中核糖体基因的转录促进了R环的稳定形成,从而产生了被RPA包裹的ssDNA片段。这导致募集至核仁的共济失调毛细血管扩张突变基因Rad3相关蛋白(aataxiatelangiectasia mutated and Rad 3 related protein, ATR)被激活,最终触发DNA损伤修复[23]。 细胞中整合的应激反应(integrated stress response, ISR)会阻断组蛋白的合成,促进R环的形成。在ISR环境中,组蛋白的缺失和R环的形成共同介导了DNA合成的快速中止,防止潜在的有害DNA复制[1]。细菌中的应激诱导的诱变(stress-induced mutagenesis, SIM)由DSBs/DSEs(double strand breaks or ends)触发,涉及使用易错(诱变)聚合酶Pol IV、II和V进行复制。在压力条件下,一些复制从R环开始,在遇到ssDNA切口时,复制叉崩溃会产生DSB,从而促进细菌的SIM,最终帮助细菌适应压力[24-25]。酵母细胞中GAL为响应环境变化的基因,通过lncRNA诱导R环的形成来暂时调节转录激活从而快速响应环境变化[26]。
2.1.2 促进病理性R环的因素:能够增加RNA和DNA接触机会的因素会促进R环的形成,例如非模板DNA链断裂[27-28],负超螺旋(有利于DNA展开)[27,29],阻碍非模板DNA链的非规范DNA结构(例如G4-四链体和三链体)[30],非模板DNA链的螯合配体[31]或者空间上游离RNA末端的接近等[32]。在尤文氏肉瘤中,EWS-FLI1蛋白调节RNA聚合酶II(RNA polymerase II, RNAPII)延伸并与剪接机制相互作用促进了R环的形成,阻断尤文氏肉瘤的乳腺癌基因1(breast cancer 1, BRCA1)修复,部分介导了尤文氏肉瘤对化疗的敏感性[33]。
2.2 抑制R环形成的因子 病理性的R环是危险结构,可能会对转录延伸产生负面影响并严重损害基因组完整性,是超突变、超重组、染色体重排或染色体丢失的潜在来源。这种威胁使得细胞进化出不同的因子和机制来防止共转录R环的形成或去除RNA:DNA杂交[34]。
2.2.1 引物酶-聚合酶PrimPol与R环:PrimPol属于AEP超级家族,是一种具有合成DNA引物的独特能力,以及能够绕过某些DNA病变的非过程DNA聚合酶。绕过DNA病变的能力赋予了细胞DNA损伤耐受性,这对于存在未修复DNA损伤的情况下支持持续的复制体进展至关重要。无法忍受这种损害会导致复制叉长时间停滞、崩溃,并最终导致基因组不稳定和(或)细胞死亡。GAA重复序列和许多其他引起疾病的串联重复序列可以形成DNA二级结构,例如发夹、三链体(H-DNA)或G-四链体(G4)。不参与这些结构形成的DNA链暴露为ssDNA。该暴露的ssDNA易于与互补RNA转录物杂交,从而导致R环的形成[35]。PrimPol通过发挥其跨病变合成和引发酶的作用,绕过DNA损伤下游、G4二级结构和链终止核苷酸类似物等DNA损伤位点[36],重新启动DNA复制,防止复制过程中过量的ssDNA暴露,从而限制了这些序列附近的R环积累(见图1)。PrimPol的缺失会导致人细胞DNA二级结构附近R环形成的增加,增加了细胞内部的转录-复制冲突风险,最终导致基因组的不稳定[37]。
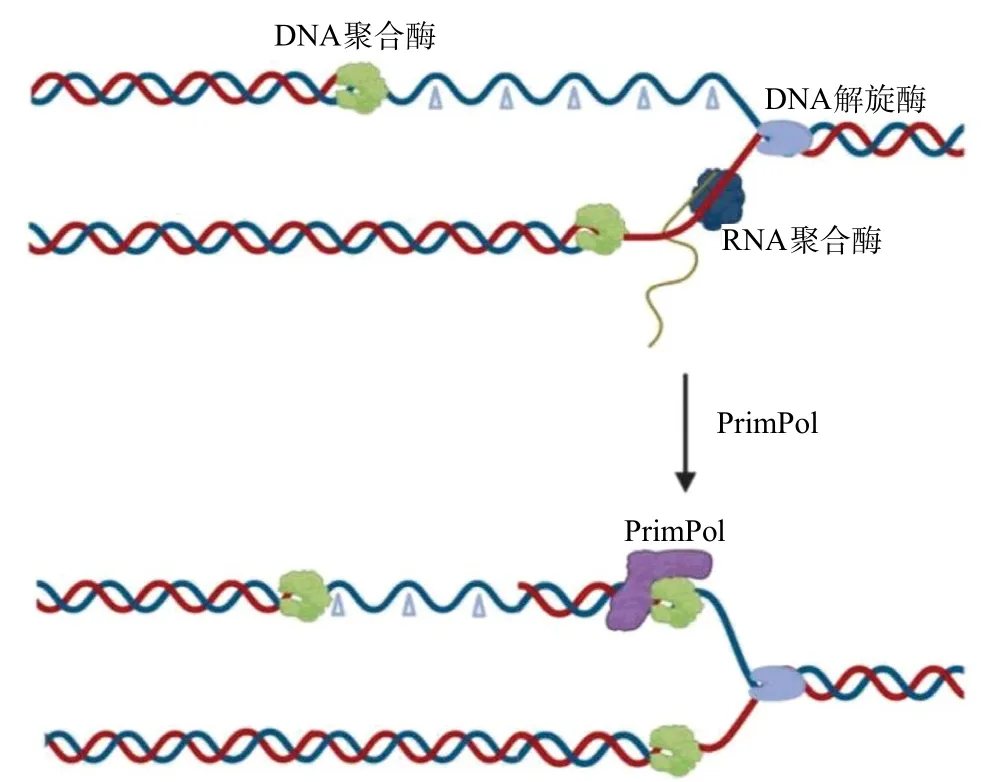
图1 PrimPol预防R环的形成
2.2.2 范可尼贫血(Fanconi anemia, FA)相关蛋白与R环:FA途径下有许多蛋白参与调节R环,保护基因组的稳定性。研究表明,FA途径下的范可尼贫血组D2蛋白(Fanconi anemia group D2 protein,FANCD2)在R环形成过程中具有保护作用[38-39]。R环的形成促进了FANCD2在大型脆弱基因上的积累[39]。 FANCD2能募集RNA处理酶,包括异质核核糖核蛋白(heterogeneous nuclear ribonucleoprotein U,hnRNPU)和DEAD-box解旋酶47(DEAD-box helicase 47, DDX47)。hnRNPU是一种RNA结合蛋白,在转录延长pre-mRNA剪接、mRNA稳定性以及更广泛的间期染色质结构中起作用。FANCD2可能通过将hnRNPU定位于R环形成的位点,促进巨大的易碎基因基因座上的pre-mRNA剪接[38]。DDX47为DEAD框蛋白家族的腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)依赖性RNA解旋酶,可以解开DNA:RNA杂合体破坏R环[39](见图2)。除了FANCD2外,FA途径的范可尼贫血组D1蛋白(Fanconi anemia group D1 protein,FANCD1)成员乳腺癌基因2(breast cancer 2,BRCA2)也能防止R环的积累[40]。BRCA2与RNAPII相互作用,以调节启动子近端暂停(promoter proximal pause, PPP)位点释放,同时募集RNase H2促进R环的去除[22](见图2),从而防止病理性的R环积累[41]。FA途径下还有一部分因子参与调控R环,例如BRCA1通过募集肌萎缩侧索硬化症相关蛋白(senataxin,SETX)解旋酶参与调控与转录终止相关的R环[42]。最近有研究表明,MRN可以促进FA途径内的关键抗R环蛋白范可尼贫血互补群M(FA complementation group M, FANCM)有效地募集到细胞中R环易发位 点[43]。
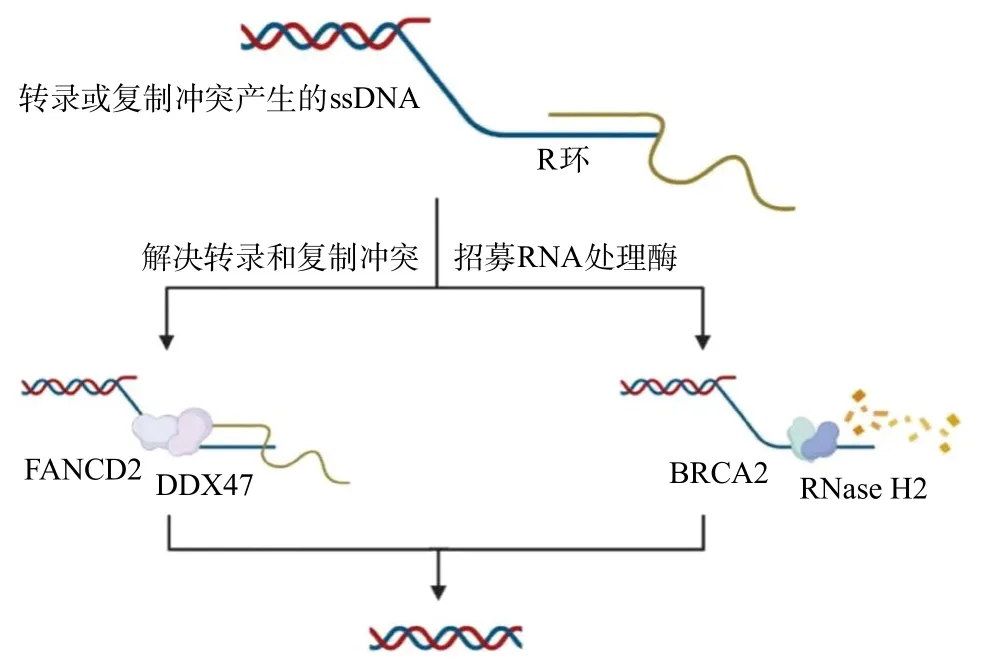
图2 以FANCD2和BRCA2为例的两种抑制R环形成的途径
2.2.3 RNase H与R环:真核细胞具有单体H1和异源三聚体H2两种类型的RNase H酶,它们专门用于消除基因组中的RNA-DNA杂交[44]。RNase H1和RNase H2利用5’→3’核酸外切酶活性从环中去除RNA。这些酶在原核生物和真核生物中在进化上是保守的,并且是消化杂交RNA的唯一已知的RNA特异性核糖核酸酶[45]。多个研究表明,RNase H可以促进R环的去除[23,46-49]。在许多的研究中利用RNase H酶的特性,通过过表达RNase H来特异性地去除R环或者验证R环的存在[2,16,20,26,32,50]。
还有一些因子与R环的关系比较复杂。DHX9虽然可以促进病理性和非病理性R环的形成[20],但在一些情况下也会抑制R环的形成,例如DHX9促进喜树碱处理的细胞中转录终止区域的R环抑制,并防止R环相关的DNA损伤[51]。此外,MRN与R环的关系也存在两面性[43]。
2.3 R环与DNA损伤
首先R环是一种DNA损伤引发剂,它能在复制和转录环节诱导DNA损伤。在复制过程中,复制叉前形成的R环可能会阻碍复制体的进程,从而导致复制叉的崩溃或断裂,产生DNA损伤[1,44]。R环还会引起转录-复制碰撞,从而导致DNA损伤和基因组不稳定[52]。其次,R环可能作为中间体导致了DNA的损 伤,例如G4配体对DNA的损伤由R环介导。
R环对DNA损伤的影响不仅仅体现在对DNA的直接损伤上,也可能体现在对DNA修复过程的影响。DNA修复主要有两个经典途径HR和NHEJ。R环对DNA损伤修复的一个主要影响是改变切除的效率,这一步骤决定了修复由HR还是NHEJ进行。在裂变酵母 中,R环的形成可防止DSB处的过度切除,但在DSB形成后的早期,R环的去除也是有效的RPA结合所必需的。敲低RNase H可以稳定DSB位点周围的RNA-DNA杂交体,并严重损害ssDNA结合RPA复合物的募集。相比之下,过表达RNase H1会破坏这些杂交体的稳定性,导致过度的链切除和RPA募集以及DSB周围重复区域的严重丢失[4]。在轻度复制压力下,XPG处理R环产生的瞬时DSB导致WS单元中的HR通路下共济失调毛细血管扩张突变(ataxia telangiectasiamutated gene, ATM)信号激活及其下游细胞周期检测点激酶(checkpoint kinase, CHK)1的激活[53-54],促进DNA修复从而保护基因组的稳定性。
3 R环与疾病
3.1 R环与非肿瘤性疾病 在人类基因组不稳定相关的多种疾病中发现了R环的增加(见表2)。目前有研究表明骨髓增生异常综合征(myelodysplastic syndromes, MDS)可能既是剪接又是转录的疾病,其中剪接因子的突变(如U2AF35)诱导的R环形成,并且形成的R环与骨髓来源的血液祖细胞增殖受损有关,促进了MDS的形成[55]。肌萎缩性侧索硬化症(amyotrophic lateral sclerosis, ALS)等神经退行性疾病也与R环形成有关,患者细胞内C9ORF72(C9)基因的第一个内含子中富含G的扩展序列可以在置换的DNA链(G4-DNA)中形成G四联体,从而使优先在富含G的位点形成的R环稳定,导致C90RF72基因转录受损;显性青少年肌萎缩侧索硬化症 (ALS4)患者的细胞内的SETX基因会发生突变,导致R环的减少。ALS4细胞中的R环越少,转化生长因子β(transforming growth factor-β, TGF-β)的负调节因子BAMBI的表达就越低,然后引起TGF-β通路的异常激活,这可能导致运动神经元功能障碍和死 亡[56]。Wiskott-Aldrich综合征(WAS)也与R环有关,R环可能通过影响DNA复制和(或)修复而损害基因组完整性,从而导致儿童白血病的发病率很高[47]。

表2 R环影响不同疾病的发生发展
3.2 R环与肿瘤 癌基因的激活通常会启动产生癌症特征的异常转录程序。这种转录激活导致转录-复制冲突(tranion-replication conflict, TRC)的可能性是双重的:首先,快速增殖和高转录频率增加了R环形成的可能性[57];其次,特定的DNA复制时间,再加上致癌基因诱导的细胞周期进入,可能导致与新获得的致癌转录状态发生冲突,从而促进TRC处的R环[58]。有文献报道,R环基因表达水平与癌症患者的存活率相关(P<0.05)[59]。
R环参与了肿瘤发生发展的过程。尤因肉瘤与R环关系比较密切。在尤因肉瘤中,EWS-FLI1融合蛋白的表达增强转录,导致R环积累,同时通过增加RNAPII与BRCA1相互作用而损害HR,从而导致基因组不稳定[33,60]。在乳腺癌的雌激素受体途径中,发现R环在雌激素诱导的基因上积累并驱动DNA损伤[61]。乳腺癌易感性因素BRCA1和BRCA2驱动的通路中的干扰也会引起R环驱动的DNA损伤。用致癌性醛处理的细胞会降解BRCA2,进而积累破坏DNA的R环[62]。这些R环直接与小鼠的乳腺肿瘤发生有关[63]。R环的存在与基因的不稳定性有着很大关系。在酿酒酵母菌株中发现,缺少Mlp1/2核篮蛋白的细胞显示出AID依赖性基因组不稳定性和复制缺陷,这些缺陷被RNase H1过表达抑制[64]。通过复制中间体的2-D琼脂糖凝胶电泳检测到了同时缺失RNase H和拓扑异构酶I(topoisomerase I, topoI)的酵母细胞的rDNA基因座中R环的复制,并被认为有助于复制数的变化,这与致癌作用高度相关[65]。在枯草芽孢杆菌中,复制与转录的正面碰撞可能导致普遍的R环形成。此类R环可以阻止复制,增加诱变作用,并抑制复制重启和应激生存所需基因的表 达[66]。受调控的复制是R环影响细菌的细胞生理和基因组稳定性的另一种主要机制[24]。
由于R环是转录的常见副产物,因此可以利用癌细胞的R环耐受性来使某些肿瘤对化学治疗敏感,从而重新激活癌症对R环结构和内源性的反应[59]。R环介导的遗传损伤(R环不耐受)可能使肿瘤更容易受到DNA损伤剂和细胞死亡的影响,这可能会促进涉及细胞毒性疗法和R环靶向药物的新型联合疗法的开发。在滑膜和尤因肉瘤(SS/ES)中,临床ATR抑制剂(ATR inhibitor, ATRi)的使用导致R环的积累并增加了对化学疗法的敏感性[67]。聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂可增强SS细胞ATRi的抗肿瘤活性,这表明使用ATRi的联合疗法有望成为治疗肉瘤的新方法[67]。EWS-FLI融合蛋白已显示可增加R环形成并失活,从而使尤因肉瘤细胞系对遗传毒性药物(如依托泊苷、喜树碱和PARP抑制剂)高度敏感[33]。
4 总结与展望
自R环被发现后,针对R环的检测技术更新迭代,从最开始的电泳技术到后来的免疫沉淀技术,再到现在在免疫沉淀技术上发展的免疫荧光技术和质谱技术,使得我们对R环能够更加精确定位,更全面地检测R环,从而更好地研究R环的相关信息。在肿瘤的治疗方法上,已经开发了一些与R环相关的疗法,并且通过联合治疗而提高疗效。在非肿瘤性疾病中,中枢神经系统和免疫系统的某些疾病与R环的形成有关,未来有望根据这些位点或者有针对性地除去这些R环来治疗或者辅助治疗这些疾病。虽然病理性R环与基因组不稳定和复制压力相关联,癌症和许多遗传疾病的特征,以及多种神经退行性疾病与R环积累相关,但我们仍未在R环与疾病之间建立因果关系。因此,需要了解R环稳态的分子基 础,以及保护细胞不受病理性R环影响的机制,以理解R环作为转录的隐藏面的作用。由于病理性R环的存在会影响复制和转录,所以当前针对抑制R环形成以及减少R环对基因组影响的因子研究比较多,如RNase H酶、FA途径等,而针对R环存在的生理功能研究却较少。在抑制R环形成的影响因子中,有许多与DNA修复途径有关,例如FA途径等,说明细胞已经进化出不同的因子和机制来防止共转录R环的形成,以利于细胞的生存。此外,细胞也进化出了与R环共存或者说利用R环参与生理过程的功能,例如R环导致的SIM,在CpG岛上形成的R环保护这些区域免受DNA甲基化的影响。虽然我们已经探索很多可能影响R环形成的场景和因素,但是仍然有很多信息不明确,包括:全基因中R环的分布和存在时间,R环在转录冲突中出现的频率及其影响程度,细胞如何识别生理性R环与病理性R环,不同细胞中R环形成的频率是否不同。围绕这一些问题进行研究可以更好地理解R环在细胞中的生理和病理学意义,为研究R环的影响因素和相关疾病的关系找到新的突破口。

