辣木甲基磺酸乙酯(EMS)诱变及表型变异的初步研究*
张 慧,阮明菊,王 韦,王 睿,杜建武,曾千春,2
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.云南辣木研究所,云南 昆明 650201)
辣木为辣木科(Moringaceae)辣木属(MoringaAdans)热带落叶木本蔬菜及油料植物,富含多种营养物质[1],具有极高的药用、生态和经济价值[2];目前中国已经引种栽培印度传统辣木、印度改良辣木和非洲辣木3个品种,主要分布在云南、贵州、广东、广西、海南和台湾等省区[3]。云南辣木主栽品种为多油辣木PKM-1,杂交指数为5,以异花授粉为主,品种内高度杂合,种性容易退化[4]。目前,辣木优质种质资源少,选育具有优良性状的辣木新品种具有重要意义。
已有辣木研究主要集中于辣木功能成分[5]、药用价值[6]、栽培技术[7]和辣木快繁[8]等方面。黄苏南等[9]曾尝试通过花药培养获得双单倍体植株,实现PKM-1 品种内纯合。甲基磺酸乙酯 (ethyl methane sulfonate,EMS) 诱变具有突变类型广、突变频率高和染色体损伤小等优势,是植物诱变育种中应用最广泛、效果最好的一种化学诱变方法,已经在木本植物的突变体育种研究及种质资源创制中取得了一定进展[10]。安佰义等[11]以白桦种子为材料进行EMS 诱变筛选,得出EMS 诱变不但延迟了种子发芽起始时间,还显著降低了白桦种子发芽率;陈敦萍等[12]用EMS 处理小桐子种子,在M1代诱变植株中共筛选到7 株具有冠幅较大、叶片繁密和长势较好的明显表型变异单株;李玉环[13]运用EMS 诱变亚麻种子构建亚麻突变体库并筛选出具有耐盐性的抗逆品种;叶春秀等[14]运用EMS 处理陆地棉,M2代中获得双茎、无顶端和子叶黄斑等突变植株,对部分M2代及突变植株进行SSR 分析后显示突变植株与对照在电泳条带上存在差异,一定程度上说明其在DNA 水平上发生了变异。
辣木是从国外引进的植物,虽然现在对辣木的研究逐渐深入,但多集中于栽培技术、引种试种和产品开发等方面,在种质创新和新品种选育方面研究较少,关于EMS 诱变辣木的研究还未见报道。因此,本研究以多油辣木PKM-1 种子为材料,分析5个EMS 质量分数和2个处理时间对辣木种子出苗及苗期生长情况的影响,筛选出EMS 诱变辣木种子的最佳条件,并对其M1和M2代表型变异特征进行分析,为辣木种质创新以及培育优质的辣木新品种提供基础材料和理论参考。
1 材料与方法
1.1 试验材料
供试材料为多油辣木PKM-1 种子,2018 年收获于云南省农业科学院热区生态农业研究所辣木试验基地。EMS 诱变剂购于美国SIGMA 公司,货号为M0880。
1.2 试验方法
1.2.1 EMS 最佳诱变条件的筛选
参照EMS 对杉木[15]和青檀[16]等的诱变处理条件,共设置5个EMS 质量分数(0、0.7%、0.9%、1.1%和1.3%)及2个处理时间(10 和12 h)。EMS质量分数的配制按照崔霞等[17]的方法,溶质为EMS 诱变剂,溶剂为pH 7.0 的磷酸缓冲液,以不添加EMS 诱变剂的磷酸缓冲液为对照。选取饱满、完好的辣木种子清水浸泡4 h,充分吸水后晾干,于不同质量分数的EMS 中浸泡处理。浸泡期间用玻璃棒搅拌,处理完成后用0.5%硫代硫酸钠中和10 min,流水冲洗2 h,播种至盛有沙土的育苗盘(长×宽×高为40 cm×30 cm×12 cm),播种深度1~2 cm,每处理播种1 盘,每盘播种10 行,每行15 粒。育苗盘放置于温度15~40 ℃的大棚中,适时浇水保持土壤湿度约为65%。每个处理150 粒种子,试验重复3 次。
1.2.2 M1代测定指标及其方法
播种后第5 天起,每天观察出苗情况,记录出苗时间和出苗株数。在各盘中随机标记5 株同一天出苗的植株,至第5 天时测量其根长和苗高,然后移植到营养袋中;其余材料待苗高约3 cm 时移植至装有配方土(V育苗基质∶V黄土∶V沙子=6∶3∶1)的营养袋中。适时浇水保持土壤湿度约为65%,保持温度15~40 ℃,第15 天统计移植后的成活株数。各指标计算方法为:
出苗率=出苗种子数/种子总数×100%;
相对出苗率=处理组出苗率/对照组出苗率×100%;
相对致死率=(对照组出苗率-各处理组出苗率)/对照组出苗率×100%;
相对成苗率=移植后成活株数/移植总株数×100%。
1.2.3 M1和M2代种植与表型变异植株筛选
2019 年春季,用筛选到的适宜质量分数和时间处理辣木种子700 粒,构建M1代群体。当育苗袋中的辣木幼苗长到约30 cm 时,将幼苗定植到元谋辣木试验基地(N25°41′,E101°52′,平均海拔898 m)。该地区气候属典型南亚热带干热季风气候,年平均气温21.9 ℃,年平均降水量613.8 mm。株行距为1.0 m×1.0 m,定植后浇定根水,常规田间管理。在M1代植株生长期内,从株型、叶型和叶色等对表型性状变异的植株进行筛选,并通过拍照记录与对照植株存在性状差异的单株,统计植株突变类型并计算植株突变率:突变率=突变株数/成活总株数×100%。果荚成熟后,按单株采收辣木种子。
2020 年8 月,从M1代中挑选49个表型变异单株和52个表型正常单株(小叶对生,薄纸质,全缘,叶片平展,叶面为绿色,植株形状较松散)共计101 份辣木种子按株系(M2)播种,每株选取6 粒饱满的种子作为 M2代株系进行育苗播种,每个株系定植3~5 株,对照组定植3 株。M2代播种于同为干热河谷的元江沙坪坝辣木试验基地(N23°62′,E101°95′,海拔380 m)。该地区年平均气温23.4 ℃,年平均降水量738 mm。株行距为1.2 m×1.2 m,M2代群体共存活 306个单株(101个株系),构建成 M2代群体。常规田间管理。全生育期调查记录变异表型、变异株数量及比例,并对各突变表型进行拍照。
1.3 M1 和M2 代性状变异及表型分析
根据M1代变异株的特点进行M2代株系突变性状的重复观测与表型鉴定,计算M2代中M1代的变异性状遗传频率和M2代新增突变频率:
M1-M2代的表型变异性状遗传频率=对应M2代中与M1代出现相同表型变异株数/M1代变异总株数×100%;
M2代新增表型突变频率=M1代未出现变异但M2代出现变异总株数/M1代正常表型总株数×100%。
1.4 数据统计与分析
使用SPSS 22、DPS 7.05 和Excel 软件进行数据统计和分析。
2 结果与分析
2.1 EMS 处理对辣木种子出苗的影响
由表1 可知:不同质量分数EMS 处理10 和12 h 后,辣木种子的出苗均受到抑制,且随着EMS 质量分数的增加,辣木种子的出苗率和相对出苗率均极显著降低(P<0.01),相对致死率极显著升高(P<0.01)。结合出苗率和相对致死来看:1.1% EMS 质量分数处理10 和12 h,辣木种子相对出苗率分别为58.60%和46.98%,相对致死率分别为41.40%和53.12%,较接近半致死率。
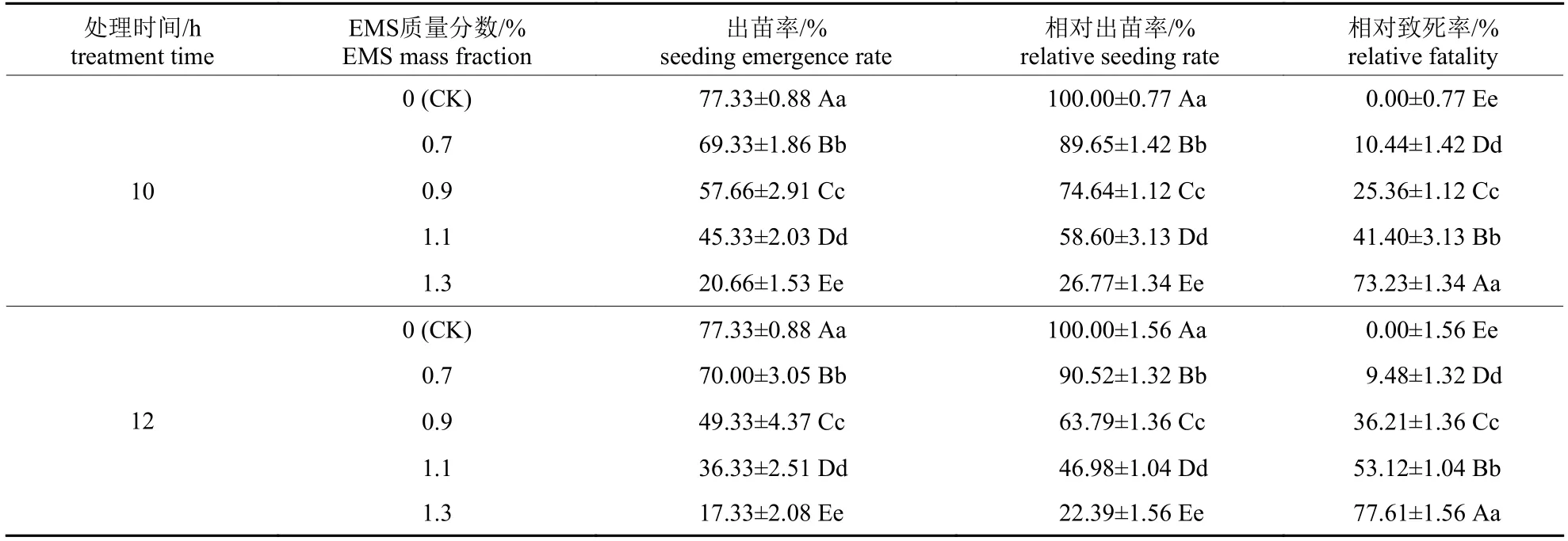
表1 不同质量分数EMS 诱变处理对辣木种子出苗的影响Tab.1 Effects of different mass fractions of EMS on the emergence of Moringa oleifera seeds
2.2 EMS 处理对辣木种子出苗进程和相对成苗率的影响
由表2 可知:随着EMS 质量分数的增加和处理时间的延长,出苗时间推后、出苗持续时间显著延长,相对成苗率显著降低。处理10 h 条件下,随着EMS 质量分数的增加,出苗起始时间由6.00 d 推后至14.33 d,出苗持续时间由6.67 d延长至10.33 d;处理12 h 条件下,随着EMS 质量分数的增加,出苗起始时间由6.00 d 推后至15.33 d,出苗持续时间由6.67 d 延长至11.00 d。
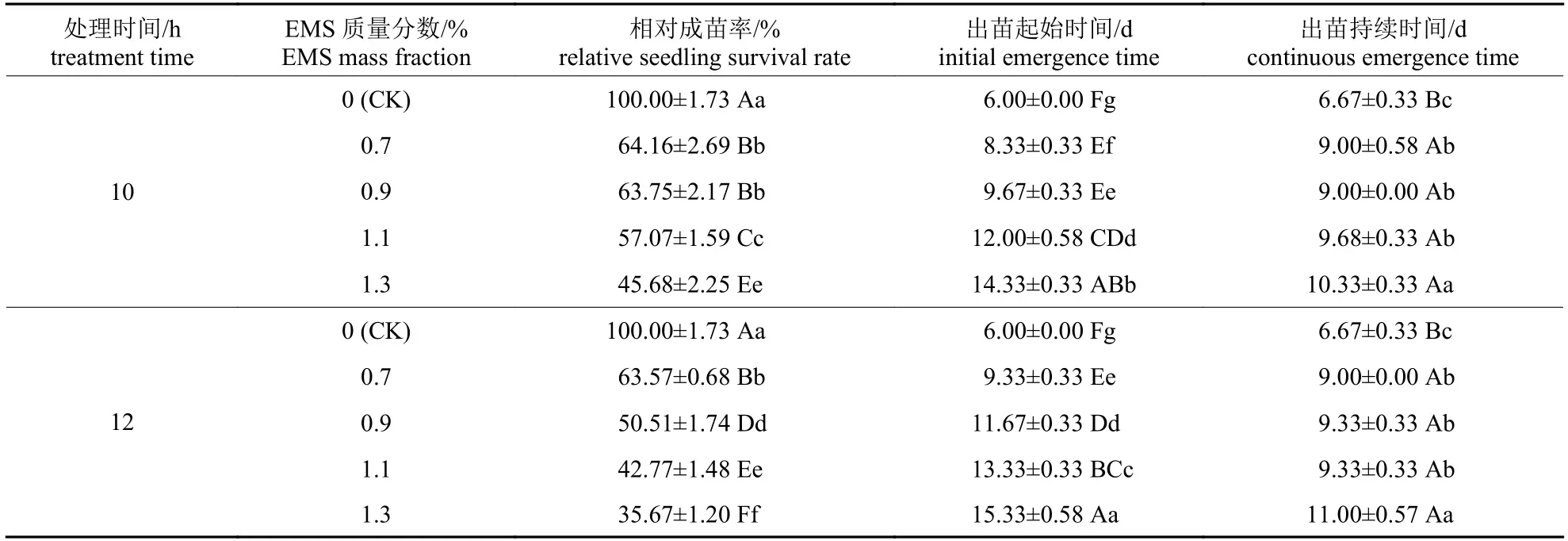
表2 不同EMS 质量分数与处理时间对辣木种子出苗的影响Tab.2 Effects of different EMS mass fractions and treatment time on the emergence of M.oleifera seeds
2.3 EMS 质量分数对辣木幼苗生长的影响
由图1 可知:随着EMS 质量分数的增加,处理10 和12 h 均使根长和苗高减小,其中处理12 h 的减小幅度更为明显。
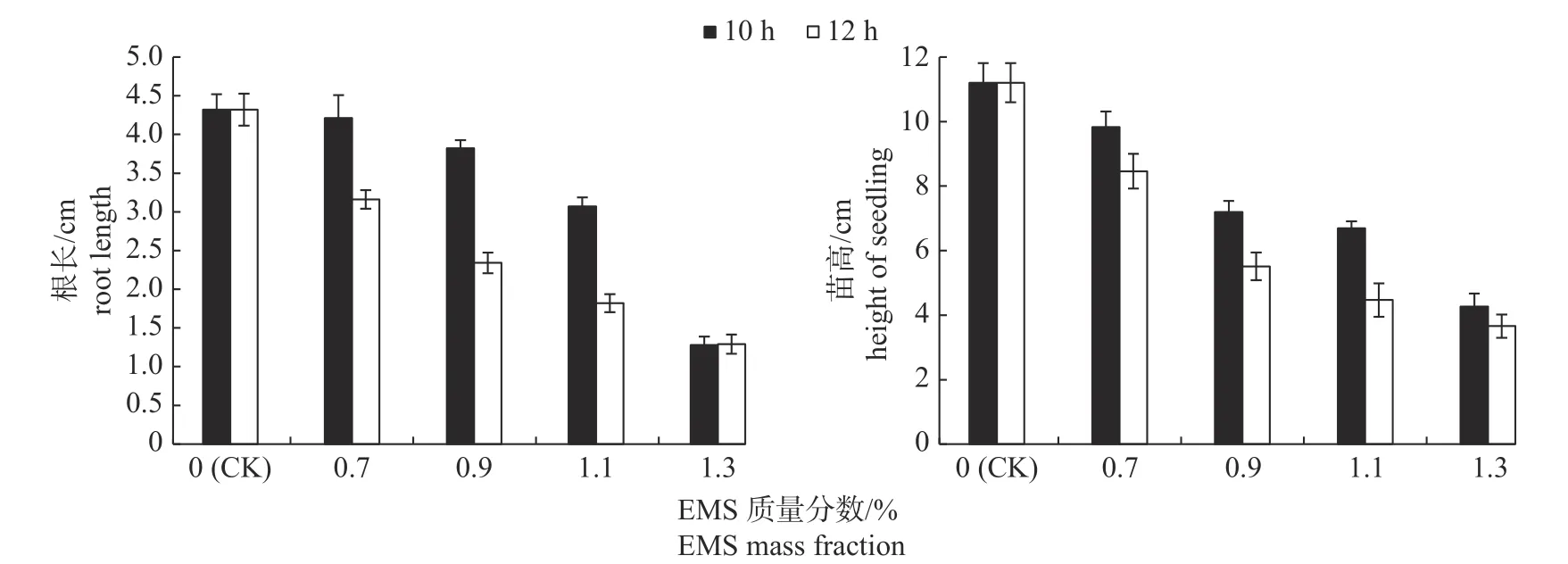
图1 不同EMS 质量分数和处理时间对辣木根长和苗高的影响Fig.1 Effects of different EMS mass fractions and treatment time on the root length and seedling height of Moringa oleifera
2.4 M1 代群体性状变异及表型分析
EMS 处理700 粒辣木种子,共获得M1代单株264 株,成株率为37.71%。M1代群体中出现了丰富的变异,共有88 株发生1个或多个性状的变异,变异频率为33.33% (表3)。共得到9 种变异类型的M1植株(图2),其中叶色变异3 种(叶片锈斑、叶片黄化、叶色深绿革质),叶形变异5 种(叶片大、叶片小、叶片卷曲、叶片狭长、连体叶),株型变异1 种(植株矮化)。由于EMS的毒害作用,大部分突变植株未能开花结果,最终收获突变单株49 份。

图2 辣木种子EMS 诱变获得9 种变异类型Fig.2 Nine kinds of mutant types by EMS treatment in M.oleifera seeds

表3 辣木表型突变统计Tab.3 Statistics of phenotype mutation of M.oleifera
2.5 M2 代群体性状变异及表型分析
M2代共获得306个单株(101个株系),并出现了丰富的变异,部分突变体可见11 种突变表型,表现出复合性状突变。由表4 可知:M2代共鉴定突变株132 株,变异频率为43.14%。其中叶型性状突变7 种(图3),叶色性状突变3 种(图4),株型性状突变1 种(图5)。M1的9 种变异类型中,叶片卷曲、叶片狭长、叶片大、叶片锈斑、叶片黄化和连体叶在M2代中有所表现,但M1代中叶片深绿革质、叶片小以及变异率最大的植株矮化在M2代中未发现,说明这些表型的变异在M2代可以恢复。此外,M2代也表现出M1代不曾有的新变异类型,如喇叭状叶、叶片倒卵形、叶片尖凹、花叶和芽多分支。其中,芽多分支表现在植株生长早期,叶腋分化能力强。

图3 M2 代辣木植株叶型变异Fig.3 Leaf type variation of M.oleifera in M2 generation

图4 M2 代辣木植株叶色变异Fig.4 Leaf color variation of M.oleifera in M2 generation

图5 M2 代辣木植株株型变异Fig.5 Plant type variation of M.oleifera in M2 generation

表4 M2 代辣木突变类型统计Tab.4 Statistics of mutation type of M2 generation M.oleifera
2.6 M1-M2 代变异性状遗传频率
由表5 可知:M2代共获得的306个单株中,有117 株源自M1代的49 株突变株,有189 株源自M1代的52 株正常株。对这306 株M2代进行表型突变性状的重复观测,结果显示:在M2代中,与对应M1代出现相同表型的植株只有12株,M1-M2代表型变异性状遗传频率为10.26%,其中叶型的遗传频率最大,主要为叶型中叶片变大(6 株,突变频率为5.13%);M1代突变频率最大的植株矮化(26.52%)在M2代得到恢复;M2代新出现68 株变异株,突变频率为35.98%;变异类型主要为叶型变异,其次为叶色变异,株型变异(芽多分支)的突变频率为4.23%。
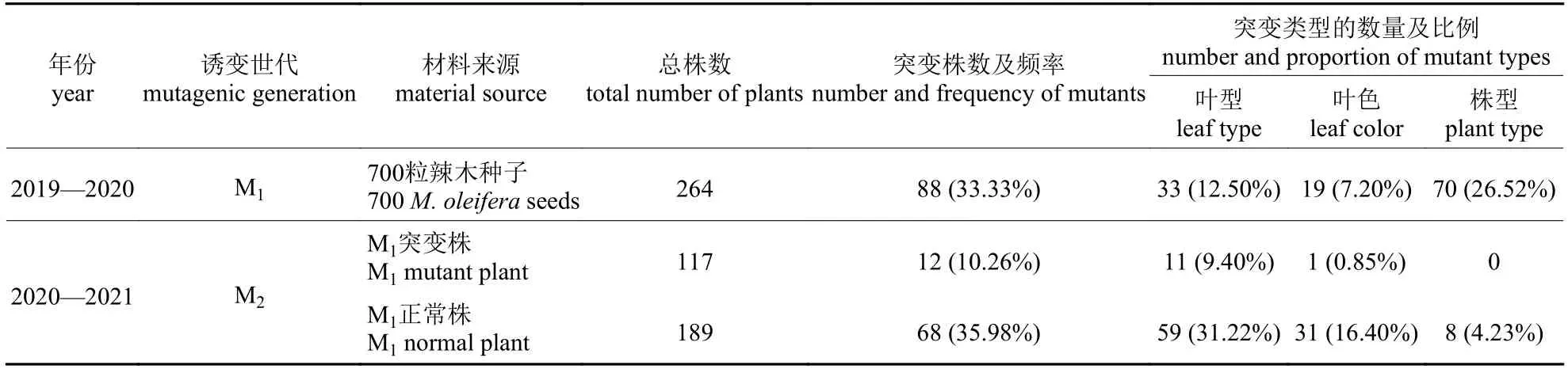
表5 辣木EMS 诱变突变类型及频率Tab.5 Variation types and frequency of EMS mutagenesis in M.oleifera
3 讨论
本研究表明:不同EMS 质量分数和处理时间均可极显著降低辣木种子出苗率,这与高维锡等[18]EMS 诱变处理沙枣种子的研究结果一致。不同质量分数EMS 和处理时间对辣木种子出苗的抑制表现在种子发芽起始时间和发芽进程延迟,且随着EMS 质量分数增加,抑制效应增强,这与安佰义等[11]的研究结果类似。EMS 诱变处理抑制辣木幼苗地上部和地下部的生长,根长减小0.09~3.04 cm,苗高减小1.37~7.54 cm,且随着诱变质量分数增加,抑制作用增强,这与前人对羊草[19]和木槿[20]的研究结果一致。
半致死剂量(LD50)是作物EMS 诱变的关键[21],适宜诱变剂质量分数及处理时间是成功诱变突变体植株的关键因素之一[22]。诱变剂的质量分数越高,EMS 越易溶解产生有机酸,毒害作用越强,会对种子产生严重损伤;若诱变剂的质量分数较低,则变异不明显[23-24]。王鹏伟等[25]以泡桐种子为材料,确定120 mg/L EMS 浸种12 h 能达到较好的半致死效果;徐刚等[26]确定1.2% EMS 诱变处理8~12 h 为麻疯树种子EMS 诱变的半致死剂量;王莹等[27]用LD50为指标确定旱柳愈伤组织的EMS 最佳诱变条件为0.4% EMS 处理3 h。本研究以辣木种子为材料,以半致死率为最佳诱变条件的筛选标准,得出1.1% EMS 处理辣木种子10 和12 h 均较为接近半致死率。结合辣木种子的出苗和幼苗生长情况,诱变处理12 h 对辣木幼苗生长的抑制作用更强,确定1.1% EMS 处理10 h为辣木种子最适诱变参数。
表型性状的突变类型及突变频率对评价诱变群体具有重要意义[28]。通常认为:诱变后产生的突变多为隐性,在M1代不表现出不同性状,只有经过自交后才能有所表现,因此,很多诱变相关的研究不在M1代对突变体进行选择。但王长里等[29]对小麦的EMS 诱变研究发现:小麦M1代群体中出现了早熟、矮秆和大穗等显性突变体,且突变频率很高,故认为突变的选择在各世代都要进行。本研究也在辣木EMS 诱变M1代群体中得到了表型发生丰富变异的突变植株,因此在M1代进行突变性状的选择是十分必要的。表型性状筛选主要以未经诱变的植株作为对照,观测诱变群体中各个单株的表型性状特征,若在单株中发现与对照植株表型性状有明显的变异即认定为该单株发生了表型性状突变[28]。经过EMS 诱变的辣木种子胚细胞会受到损伤,进而在M1代群体中表现出明显的畸形,这不仅能够进一步证明诱变剂的效果,还可以得到丰富的突变体。EMS诱变多数会产生不良的农艺性状诱变,而对于高产或高品质等优良突变少之又少。本研究获得了极少数重要表型性状明显优于对照的突变单株,如芽多分支和叶片变大的突变体,可以为提高辣木产量及辣木新品种选育研究提供基础材料。姜颖等[30]对EMS 诱变火麻一号的后代进行形态分析,从后代植株中筛选到叶色、叶形、株型及生育变异4个类型的突变体,利用RAPD 分子标记分析发现:突变体的DNA 序列发生变化,为突变体的真实性提供了分子水平上的证据。本研究在M1和M2代辣木植株中进行表型筛选,得到叶型、叶色和株型等典型表型变异植株,为下一步从分子水平上验证突变的发生提供了基础材料。正常多油辣木叶片多为卵圆形、椭圆形或长圆形,叶片平展,本研究发现有的植株新长出的嫩叶小并且叶缘卷曲或狭长,在叶片成熟后转为正常叶。这些变异表型在M1和M2代中都有出现,可能是EMS 诱变存在残留药物的后效作用,在M1代引起的生物损伤较大,在M2代也存在一定的生物损伤。这些叶片突变仍需在M3代进行进一步研究。已有研究表明:叶色突变基因可以直接或间接影响叶绿素合成和降解,改变突变体中的叶绿素含量,引起光合效率下降,严重时甚至导致植株死亡[31]。本研究筛选得到的黄化苗突变体是否存在等位突变以及其对叶绿素的产生机制还需要进一步研究。本研究在M2代辣木植株发现芽多分支的株型性状突变,叶腋分化能力强,有望作为下一步辣木突变体高产研究的材料,进一步加快辣木新品种选育进程。
种植于元江的M2代共获得306个单株,来自101个M1株系,表型调查发现:在M1代中变异率最大的植株矮化并没有遗传给M2代,说明M1代株型矮化变异是由于EMS 毒性损伤引起的,这与对北高丛越橘[32]的研究结果一致。M1-M2代表型变异株为12 株,变异性状遗传频率为10.26%,M2代新出现变异株68 株,突变频率为35.98%,可能与EMS 诱变造成点突变和突变性状调控的复杂性等有一定关系[33],故还未得到稳定遗传。为进一步明确上述突变类型是否具有遗传性和稳定性,将来还需从具有表型突变的M2代中随机挑选突变株(系),系统调查其M2或M3代的突变性状,最终获得可稳定遗传的突变体材料。同时,可在M3代挑选表型性状明显的突变株进行分子鉴定,为下一步进行辣木功能基因组研究及新品种选育提供基础材料。
4 结论
辣木种子EMS 诱变的最佳条件为1.1% EMS处理10 h,该处理下种子相对出苗率为58.60%,相对成苗率为57.07%。M1代共获得264个单株,突变株88 株,共9 种变异类型,突变频率为33.33%;共获得源于101个M1株系的M2单株306 株,突变株132 株,可分为11 种突变表型,变异频率为43.14%。M1-M2代变异性状遗传频率为10.26%;M2代新出现变异株68 株,突变频率为35.98%,为下一步M3代获得稳定遗传的辣木突变体奠定了基础。

