组蛋白去乙酰化酶抑制剂对肝癌诱导自噬的作用
庄 薇 钟 宁
1 江西卫生职业学院(南昌 330052)
2 江西省肿瘤医院(南昌 330006)
原发性肝癌是临床上常见的消化系统疾病之一,在我国,原发性肝癌的发病率和死亡率较高,占全球的50%左右[1- 2],每年我国有逾13万人死于该疾病[3]。原发性肝癌在早期不易察觉,随后的病情进展迅速,这导致原发性肝癌的预后差,5年生存率只有12%左右[4- 5],严重损害了人们的健康与生命。因此,我们的努力方向就是要明确原发性肝癌的发生原因和进展机制,为肝癌寻找到新的治疗途径已然成为医疗领域的研究热点。曲古霉素作为一种新型的抗肿瘤药物,属于组蛋白去乙酰化酶抑制剂的一种,其具有抑制多种恶性肿瘤进展的作用[6- 7],但是具体的作用机制还不是十分明确。本实验旨在观察曲古霉素对肝癌细胞增殖和凋亡是否有影响,该影响是否与自噬有关,这个作用机制可为临床上治疗肝癌开辟一条新的途径。
1 材料与方法
1.1 材料
人肝癌细胞 HepG2(ATCC公司);曲古霉素(Sigma公司);胎牛血清和DMEM 培养基(Gibco公司);MTT试剂(Sigma公司);Western blot相关试剂(Sigma公司);Annexin-V/PI凋亡检测试剂盒(北京百奥莱博公司);RT和逆转录等相关试剂(Fermentas公司);β-actin(Abcam 公司);引物(上海生工生物有限公司)。
1.2 细胞培养
将人肝癌细胞 HepG2置于含有10%FBS、青霉素与链霉素各100 U/mL的DMEM培养基中,然后置于CO2培养箱中,5%CO2、37 ℃进行培养,进行传代。
1.3 MTT法检测细胞增殖
把处于对数生长期的HepG2肝癌细胞铺满96孔板孔底,置于CO2培养箱中,5%CO2、37℃进行培养,等到细胞贴壁后依次加入浓度梯度的药物,即浓度为50、100、200和500 nmol/L的曲古霉素,使用曲古霉素处理 HepG2 细胞的同时对照组加入相同量的培养液,每一组浓度均设3个平行复孔。待48 h后每孔均加入 20 μL MTT (5 mg/mL),维持条件不变继续培养4 h,然后终止培养,吸弃其上清后,每孔中加入150 μL的二甲基亚砜,轻微振荡10 min,运用酶联免疫检测仪检测490 nm 波长处各孔的吸光度(optical density, OD)的值,OD值的大小与活细胞数量呈正相关。
1.4 流式细胞术检测细胞凋亡
使用 Annexin V/PI细胞凋亡双染试剂盒来检测细胞凋亡的总体情况,仍然是使用处于对数生长期的HepG2肝癌细胞,将其分别接种于6孔板中,等到细胞贴壁后依次加入浓度梯度的曲古霉素,48 h 后用离心管收集细胞离心,条件5 min、1 000 r/min,弃去上清后用200 μL流式染色缓冲液重悬细胞,然后再依次加入5 μL的Annexin V-FITC 和5 μL的碘化丙啶(propidium iodide, PI),轻轻摇晃混匀,注意室温避光保存,务必在30 min以内用流式细胞仪进行检测。
1.5 Western blot法
此阶段处理细胞的方法同1.4,结束培养后细胞中加入RIPA裂解液,充分地震荡,12 000 r/min,离心10 min后收集上清,随即进行蛋白定量,可置于- 80 ℃冰箱中贮存。进行SDS聚丙烯酰胺凝胶电泳,待电泳结束转膜而后室温下封闭2 h,加入一抗以后4 ℃孵育过夜;孵育一抗的膜使用缓冲液充分冲洗,随后加入相应的二抗孵育2 h,洗膜,加入ECL试剂,用凝胶成像并用图像分析系统检测,截取图片并记录相关条带灰度值。
1.6 RT-PCR法
处理细胞的方法同1.4。引物序列从Gene Bank中查阅,根据引物设计原则设计。β-actin:上游5′-GTGTGATGGTGGGTATGGGTCAGAAGGACT- 3′,下游5′-ATGGCATGAGGGAGCGCGTAACCCTCA-TAG- 3′;Beclin1:上游5′-GACCAGTGGGCATCGCA-TCG- 3′,下游5′-CTGGTTGGCTGATGCTACTG- 3′;Bcl- 2:上游5′-TGCCACCATCACTCAATACC- 3′,下游5′-AAACGCCAATAGCACGGTGA-3′。实验过程使用Trizol一步法提取细胞的RNA;具体操作过程参照RT试剂盒程序进行RT及PCR反应,所得的cDNA可置于- 20 ℃冰箱保存以待后续实验使用;以cDNA为模板,在聚合酶的催化下进行PCR扩增反应,反应条件为:95 ℃ 2min;95 ℃ 30 s,退火30 s,70 ℃ 1 min,70 ℃,2 min。反应结束后取PCR扩增产物6 μL,配制琼脂糖凝胶进行电泳,使用凝胶成像以及图像分析系统成像并进行检测,计算各mRNA的表达情况。
1.7 统计学处理
2 结 果
2.1 TSA对HepG2细胞增殖的影响
不同浓度的曲古霉素分别作用于HepG2肝癌细胞后,我们可以观察到HepG2肝癌细胞的增殖情况,随着药物作用时间的延长以及药量的增加增殖所受到的抑制越明显,与对照组相比较,差异有统计学意义(F=237.69,P<0.05,表1)。

表1 不同浓度TSA 对HepG2细胞增殖的抑制
2.2 TSA对HepG2细胞凋亡的影响
利用流式细胞术检测不同浓度的 TSA 对 HepG2细胞凋亡的影响。与对照组相比较,200 nmol/L TSA 处理细胞以后,其凋亡百分数增加(F=335.14,P=0.041,图1)。

图1 TSA对HepG2细胞凋亡率的影响
2.3 TSA对HepG2细胞Beclin1和Bcl- 2蛋白表达的影响
Western blot检测结果表明,不同浓度的 TSA(100、200 nmol/L) 在处理HepG2细胞48 h以后,Beclin1蛋白的表达逐渐上调(F=511.93,P=0.029),差异有统计学意义,而Bcl- 2蛋白的表达逐渐下调(F=197.24,P=0.032),差异也有统计学意义 (图2、图3)。

图2 HepG2细胞Beclin1和Bcl- 2蛋白的表达
2.4 TSA对HepG2细胞Beclin1和Bcl- 2 mRNA表达的影响
RT-PCR结果表明,不同浓度的TSA(100、200 nmol/L) 处理HepG2细胞48 h以后,Beclin1mRNA的表达逐渐上调(F=258.41,P=0.039),差异有统计学意义,Bcl- 2 mRNA的表达在逐渐下调(F=1 082.62,P=0.04),差异也有统计学意义 (图3)。
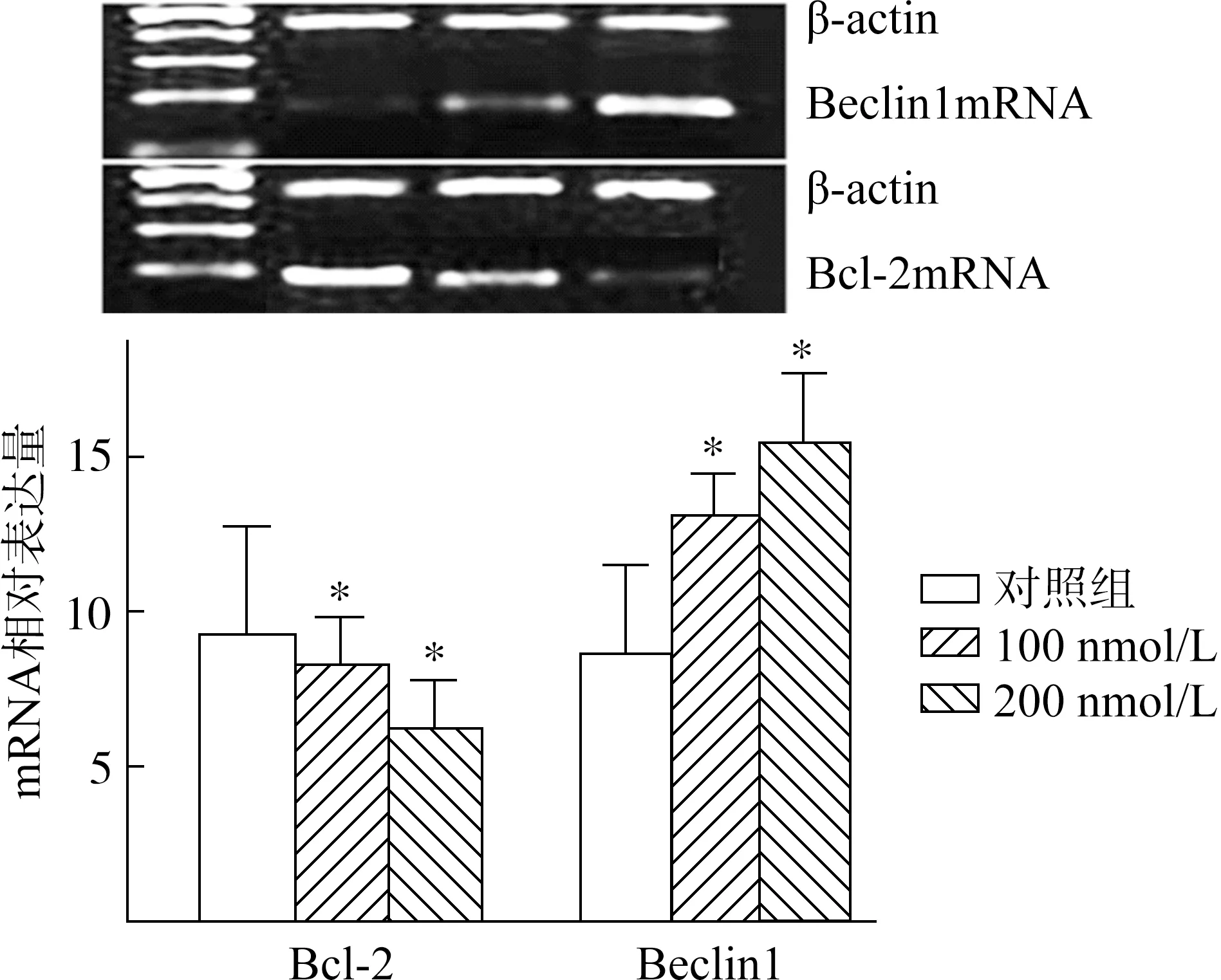
图3 HepG2细胞Beclin1和Bcl- 2mRNA的表达
3 讨 论
细胞凋亡是一种主动过程,是由基因所控制的一种细胞自主而有序的死亡,其目的是为了维持内环境的稳定,涉及一系列基因的激活、表达以及调控,是一个极其复杂的过程。迄今为止我们发现,肿瘤细胞的凋亡可以由现有的大多数抑制肿瘤的药物所诱导,这也是这些药物治疗肿瘤的途径之一。因此,我们评价肿瘤治疗是否有效的指标之一就是看这个药物能否诱导肿瘤细胞发生凋亡[8]。细胞自噬是细胞在缺乏能量或者外界刺激等因素作用下的一种自我消化的过程,通过自噬的作用,生物机体可以将自身的蛋白、细胞器以及细胞质包裹、消化和降解,由此实现细胞器更新以及自身代谢的目的。自噬很少发生,可以由某些因素所诱导,细胞保持一种自噬对于细胞本身以及机体内环境的稳定具有非常重要的生物学作用[9]。与此同时自噬不仅仅可以维持细胞的稳态,同时它还可以诱导细胞的死亡[10],在肿瘤细胞中,这种现象尤为明显,自噬可以缓解肿瘤细胞增殖带来的压力,但是同时自噬又会诱导细胞的死亡,而这种死亡与细胞凋亡以及一般的细胞程序性死亡不同,它是一种新的程序性细胞死亡,人们称其为细胞自噬性死亡[11- 12]。
研究显示,在肿瘤的发生发展过程中,表观遗传调控起着非常重要的作用,这是一种不改变DNA序列,但是却可以影响基因转录活性的调控方式,表观遗传调控的现象有很多,组蛋白乙酰化(和)或去乙酰化修饰就是其中一种,组蛋白及非组蛋白乙酰化会保持一种平衡,这种平衡的打破与肿瘤的发生以及恶性进展有着密切关联,目前该靶点有望成为治疗肿瘤的新途径,已然成为目前抗癌治疗和肿瘤靶向治疗联合用药领域的新热点。组蛋白去乙酰化酶抑制剂是通过提高细胞内组蛋白的乙酰化程度,诱发DNA损伤、抑制肿瘤细胞的增殖、诱导细胞分化和(或)凋亡,从而最终导致肿瘤细胞死亡。有研究显示,组蛋白去乙酰化酶抑制剂对肿瘤细胞的自噬、凋亡和细胞程序性死亡这三种途径均有显著影响,其诱导的自噬可以发挥细胞毒性作用,促进细胞的死亡,与自噬抑制剂联用或敲除自噬调控的关键基因Atg5基因均会减弱组蛋白去乙酰化酶抑制剂的细胞毒性作用[13- 14]。曲古霉素就是一种组蛋白去乙酰化酶抑制剂,它最主要的作用就是抗真菌,此外对阴道滴虫、梅毒螺旋体以及阿米巴原虫也有一定的作用,近年来研究发现其对乳腺癌等多种肿瘤亦具有抑制作用[15]。曲古霉素可以诱导多种肿瘤细胞发生自噬,但是其诱导的自噬与细胞死亡之间的联系,在不同的用药以及不同性质的肿瘤细胞中均存在着一定差异,这个环节还需要我们进行进一步的探究。
目前的研究表明,存在着某些自噬基因在肿瘤细胞中异常表达,许多抗肿瘤药物治疗途径都是通过诱导肿瘤细胞的自噬,从而导致细胞死亡而实现的[16- 17]。Beclin1作为一种自噬基因,是候选的肿瘤抑制基因,也是目前所发现的参与自噬调控的关键靶点之一,其在多种肿瘤细胞中均有所表达[18]。现有研究发现卵巢癌、乳腺癌以及前列腺癌中均存在Beclin1基因的缺失性突变,Ding等[19]研究发现在肝癌组织中Beclin1的表达会明显低于其周边正常组织,而且肝癌的恶性程度与Beclin1表达的水平有相关性,在同步进行的细胞试验中还证实了Beclin1的表达与肿瘤细胞的侵袭能力和转移能力相关。任宁等[20]研究同样证实了这个观点,他们通过体外培养肝癌细胞,发现自噬可以抑制肝癌细胞的增殖。Beclin1还能够与凋亡相关蛋白Bcl- 2结合形成 Beclin1/Bcl- 2 复合体,参与调控细胞的自噬和诱导细胞凋亡。
通过本实验我们可以看到曲古霉素能明显抑制HepG2肝癌细胞的增长,且这种抑制作用会随着曲古霉素作用时间的延长、药量的增加而逐渐增强,这就告诉我们曲古霉素是可以抑制HepG2肝癌细胞繁殖的。在使用了200 nmol/L的曲古霉素处理HepG2细胞48 h以后,RT-PCR与WB法检测结果均显示自噬基因Beclin1 mRNA及蛋白的表达均上调,而抑凋亡蛋白Bcl- 2 mRNA及蛋白的表达均下调,且差异均具有统计学意义。这说明在TSA作用于HepG2细胞的过程中,凋亡与自噬两种方式同时存在,且两种方式会相互影响,可能是TSA通过干扰Bcl- 2/Beclin1复合体的结合,诱导自噬的同时促进了细胞凋亡的发生。

