地西他滨联合沙利度胺对MDS患者的病态造血及疗效的影响
葛晓华 赵小强
1 登封市人民医院血液内科(登封 452470)
2 河南科技大学第一附属医院血液内科,河南科技大学临床医学院(洛阳 471000)
骨髓增生异常综合征(myelodysplastic syndrome, MDS)是以病态造血、血细胞降低及髓系细胞一系或多系发育异常等为主要特征的获得性造血干细胞病症,约30%MDS患者可演变为急性髓系白血病(acute myelogenous leukemia, AML)[1]。就本质而言,MDS虽可视作类白血病,但多数患者终其一生未朝AML方向转化,多持续表现为顽固性血细胞降低,而由此引发诸如感染、出血及贫血等一系列并发症是导致MDS患者死亡重要因素[2]。而现阶段研究尚未阐明MDS病因及起病机理,由此关于MDS特异性治疗方案尚未统一意见。对此,根据MDS患者修订的国际预后积分系统(revised International Prognostic Scoring System,IPSS-R)[3]、年龄及机体状况制定个体化实施方案为目前广大学者所认同主流观点。譬如IPSS-R中低危或高龄MDS患者,治疗策略重点在于血细胞提高及生活质量改善,由此,行支持治疗为首要选择方案。而针对诸如促红生成素(erythropoietia, EPO)+集落刺激因子(colony stimulating factor, CSF)等细胞因子治疗支持治疗效果不佳,且病情进展MDS患者,给予诸如沙利度胺、来那度胺等免疫调节剂免疫治疗,可一定程度增强机体免疫,并抑制新生血管生成,对于MDS病态造血改善有不错效果[4]。基于我国国情考虑,于临床应用沙利度胺较为广泛。而据有关研究指出,沙利度胺治疗有效率约11%~56%[5]。故实际疗效有所不足。而随MDS研究不断深入发现,MDS发病与大量基因甲基化失活密切相关,在此基础上发展的去甲基化药物使MDS患者病情缓解成为可能[6]。地西他滨(decitabine, DAC)便为去甲基化药物典型代表,可通过机体DNA甲基化过程逆转作用,使得失活的抑癌基因得以激活,由此美国国家综合癌症网络指南于2006年批准DAC用于MDS治疗,而至2009年我国国家食品药品监督管理局亦批准DAC可于临床使用。不过单一DAC治疗虽可初步获得较好疗效,且不良反应可控,但于临床应用与预期疗效有较大差距。而据有关研究表明,联合用药有助于提升MDS患者治疗效果[7]。而DAC联合沙利度胺治疗于我国研究较少,故在疗效、病态造血改善及不良反应方面尚未得到有效的临床研究证实。基于此,笔者以此为切入点进行研究,现获一定收效,报道如下。
1 资料与方法
1.1 一般资料
以本院自2014年6月—2020年5月收治的MDS患者为研究总体,行便利抽样法选择60例于收治期间行输血、抗感染及诸如EPO+CSF等细胞因子治疗效果不佳MDS开展研究,按完全区化原则设立对照组及观察组,均30例。其中,对照组:男21例,女9例,年龄:40~73岁,均龄(58.46±9.35)岁;染色体核型:正常24例,异常6例;观察组:男22例,女8例,年龄:41~75岁,均龄(59.31±9.46)岁;染色体核型:正常25例,异常5例。以上2组MDS患者性别、年龄及染色体核型等资料具有可比性(P>0.05)。
1.2 纳入标准及排除标准
纳入标准:①符合MDS有关诊断标准[8],且于我院采取病态造血观察、骨髓穿刺检查、免疫分型判别及基因突变诊断等方式确立为MDS;②年龄40~80岁;③研究获经批准,患者及家属知悉;排除标准:①研究药物过敏史;②伴发其他恶性肿瘤;③存在造血及免疫系统病症;④精神或脑性障碍,难以配合研究进行。
1.3 治疗方法
患者于收治期间行输血、抗感染及诸如EPO+CSF等细胞因子治疗,均表现为无效及复发需另用其他药物治疗。对照组采用沙利度胺治疗,予以初始剂量50 mg沙利度胺【国药准字:H32026130,厂商:常州制药厂有限公司】于睡前口服,每周剂量逐步递增50 mg,最大剂量不宜超过200 mg/d;观察组沙利度胺治疗同“对照组”,另联合DAC进行治疗,第1~5 d予以初始剂量20 mg/m2DAC【国药准字:H20140051,厂商:齐鲁制药(海南)有限公司】每隔8 h分3次静脉滴注。采用骨髓细胞学等实施复查以明确DAC治疗效果,若发挥有确切疗效,继续用药。2组一疗程均为28 d,持续治疗2疗程。于治疗期间,密切监测患者血常规、肝肾功能,若出现肝肾功能损害,给予托烷司琼等肝肾保护药物,若出现明显贫血[血红蛋白 (hemoglobin, HGB)<70 g/L],给予浓缩红细胞输注;若血小板计数 (platelet, PLT)<20×109/L,输注机采血小板。此外,为避免TET2、RUNT等染色体异常或P53基因突变致使疾病加重,应定期(3个月)予以骨髓形态检查及染色体核型鉴别有效评估治疗效果。
1.4 观察指标
2组疗效、血象相关指标、病态造血改善情况及预后转归。其中,根据经修订2006年国际工作组疗效标准,于8周后评估疗效。①完全缓解(complete remission, CR):于骨髓细胞(bone marrow cell,BMC)中,骨髓原始细胞(blast,bls)≤5%,各系细胞均成熟正常,于外周血(PB)中,HGB≥110 g/L、中性粒细胞计数(absolute neutrophil count, ANC)≥1.0×109/L,PLT≥100×109/L;②部分缓解(partial remission, PR):于BMC中,bls较原先降低≥50%,但仍高于5%,于外周血中,标准同“CR”一致;③血液学改善(hematology improvemenit,HI):Ⅰ、血红蛋白反应:以治疗后HGB上升15 g/L(治疗前HGB<90 g/L,需行红细胞输注MDS患者),且每8周输注量减少≥4 U视作血红蛋白反应改善;Ⅱ、中性粒细胞反应:针对PLT处于20×109~100×109/L者,治疗后净增30×109/L,针对PLT<20×109/L者,治疗后净增>20×109/L,且增幅≥100%视作中性粒细胞反应改善;Ⅲ、血小板反应:针对ANC<1×109/L者,治疗后净增>0.5×109/L视作血小板反应改善;④无效(no remission,NR):无反应或进展均视作NR;总反应率(overall response rate,ORR)=CR例数+PR例数+HI例数/总例数×100%。血象相关指标:包括HGB、ANC、PLT及bls,HGB、ANC、PLT检测采用日本希森美康XS- 500i全自动血液分析仪,bls监测采用美国贝尔曼库尔特DxFLEX流式细胞仪。病态造血改善情况:以脱离输血治疗(T1)进行评估,标准:(8周内)无需外界红细胞输注。预后转归:以IPSS-R、不良反应及总生存时间(overall survival, OS)综合评估: ①IPSS-R:计极低危、低危、中危、高危及极高危5组;②不良反应:主要见于中性粒减少、骨髓抑制、感染、皮疹、嗜睡、瘙痒等,依照美国国立肿瘤研究所制定的毒性标准[9](version 3.0)予以程度划分,共Ⅰ~Ⅳ级,级别越高,不良反应越重;③OS:经病例确诊时间至末次随访时间,统计5年OS率。
1.5 统计学处理
2 结 果
2.1 2组疗效比较
观察组ORR为51.61%,与对照组的26.67%相比更高,差异有统计学意义(P<0.05)。

表1 2组疗效比较 [n=30,n(%)]
2.2 2组血象相关指标比较
经治疗,2组PLT、HGB、ANC水平均见一定程度上升,bls水平则见下降,观察组PLT、HGB、ANC相较于对照组更高,bls水平则更低(P<0.05)。
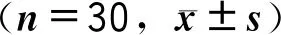
表2 2组血象相关指标比较
2.3 2组病态造血改善情况及预后转归比较
于2020年6月截止随访,随访时间8~96个月,中位随访时间68个月。于治疗及随访中行骨髓形态检查及染色体核型鉴别均表现正常。关于病态造血改善情况,2组T1率比较,差异无统计学意义(P>0.05);观察组IPSS-R预后评分整体优于对照组(P<0.05);2组Ⅰ~Ⅳ级不良反应比较,差异无统计学意义(P>0.05);观察组5年OS率为63.33%,相较于对照组的36.67%更高(P<0.05)。
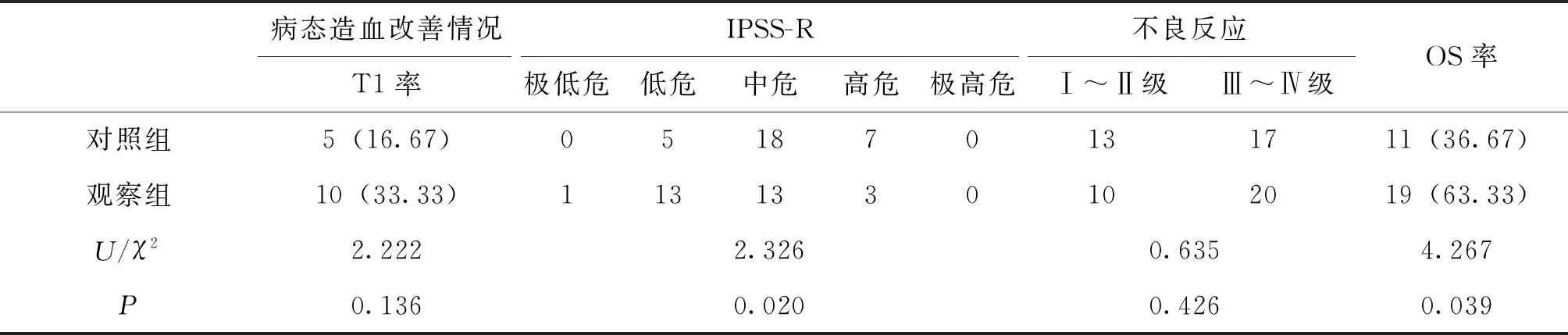
表3 2组病态造血改善情况及预后转归比较 (n=30)
3 讨 论
MDS发病率约4/10万,于老年人群较为好发,与年龄呈明显正相关,年龄越大,罹患MDS风险越高。由冷青学者[10]研究指出:我国每年新检出MDS患者约30万,且随我国老龄化进程加快,发病率有逐年上升趋势。考虑到MDS患者收治IPSS-R、年龄及机体状况存在较大差异,依循个体化治疗手段解决骨髓衰竭、并发症及AML转化等问题为现阶段MDS治疗重点。既往针对高龄及低危类型MDS患者以输血、抗感染及EPO + CSF等细胞因子等支持治疗为主,而应用上述支持治疗效果欠佳MDS患者,予以免疫抑制剂、去甲基化药物等为国内常用手段。其中,免疫抑制剂代表药物中的沙利度胺,去甲基化典型药物中的DAC已被诸多研究证实在MDS治疗中获有确切疗效。由Ito T学者[12]便指出,既往具有致畸历史沙利度胺,应用于炎性疾病、多发性骨髓瘤及癌症等临床中可发挥较好疗效,具体作用机制系于促进mRNA的降解,由此诸如肿瘤坏死因子(tumor necrosis factor-α, TNF-α)等炎性因子活性降低,且可通过抑制血管生成。而据Ye X学者[13]研究表明:低剂量DAC可能是治疗MDS / MPN的有效方法,可改善身体症状,并对血液学进行缓解。
而关于两者联用是否可改善MDS患者病态造血水平,并提升疗效,现阶段国内研究未在此作深入研究。由王慧学者[14]应用DAC联合沙利度胺治疗30例高危MDS患者研究指出,此联合方式有助于降低外周血调节性T细胞上程序性死亡分子- 1、细胞毒性T淋巴细胞相关抗原- 4的表法,可进一步使T细胞免疫功能提升,有助于抗肿瘤基因激活,从而抑制肿瘤分析扩散。而由邱莹玉学者[15]通过54例MDS患者应用沙利度胺联合低剂量DAC治疗研究表明,该联合治疗手段可取得较好疗效。故上述研究观点为本临床对照研究实施依据,且笔者以疗效、病态造血及预后转归方面开拓创新,进行深入分析,旨在探讨本联合用药策略疗效及安全性。考虑到本文收治MDS患者年龄处于40~75岁之间,以老年人群占比较多,而老年MDS患者脏器功能缺失严重,且代偿功能衰退,耐受性差,治疗致死率较高,由此,在实施联合治疗过程中,笔者对药物剂量严格把控。在给予沙利度胺治疗,初始剂量为50 mg,且依据患者耐受性逐步递增剂量,有助于避免剂量过高引发诸多不良反应发生。而关于DAC剂量,根据国际FDA推荐20~25 mg/m2标准,本文选取20 mg/m2联合实施治疗。由疗效结果显示:观察组ORR为63.33%,远高于对照组的26.67%。提示地西他滨联合沙利度胺可获得更佳治疗效果。且通过进一步检测血象及脊髓原始细胞结果显示:2组经治疗PLT、HGB、ANC水平呈上升趋势,bls显下降趋势,观察组变化幅度均高于对照组。由此上述疗效结果得到进一步佐证。而具体分析原因在于[16- 17]:①沙利度胺可通过白介素- 10、白介素- 6等细胞因子释放促进,可调节机体免疫,且通过抑制IκB激酶阻滞转录因子NF-κB的激活,TNF-α释放降低,有助于症状改善,此外,还具有肿瘤微小血管生成抑制效果;②DAC作为一类2’-脱氧胞苷类似物,可经修饰特异转化为DNA甲基化转移酶抑制剂,低剂量下可很好发挥甲基化作用,激活沉默抗癌基因,从而增强机体免疫功能,改善病态造血症状;两者联合过程中具有协同之效,可增进MDS治疗效果。这与Zhao WH学者[18]研究呈较大相似性,其认为相较于单一地西他滨治疗方案,自身特殊活性及低毒性的免疫调节药物沙利度胺不失为一种良好联合药物选择。而据李佳明学者[19]研究指出,采用DAC治疗可MDS患者获益,且有助于提高T1率,但较易出现感染、中性粒细胞减少等不良反应。由本文结果显示:观察组T1率为33.33%,虽较对照组的16.67%稍高,但差异不具有统计学意义。可能原因系本研究样本选取过少,此为本研究不足。而从IPSS-R预后结果来看,观察组极低危、低危、中危、高危例数依次为1例、13例、13例及3例,相较于对照组的0例、5例、18例及7例显著预后整体效果更好。而由不良反应结果显示,2组均出现Ⅰ~Ⅳ级不良反应,DAC以骨髓抑制、中性粒细胞减少及感染多见,沙利度胺则多见瘙痒、皮疹及嗜睡等症状,联合用药过程中,Ⅲ~Ⅳ级不良反应稍高,但经对症治疗后均可缓解,可见DAC联合沙利度胺治疗安全性所在。且由5年OS率来看,观察组亦明显高于对照组。综合分析,较单一沙利度胺而言,DAC联合沙利度胺治疗预后转归效果更好。不过,在实施联合治疗过程中,需谨慎选用DAC及沙利度胺剂量,最佳服用剂量还需临床研究进一步证实。而本文研究不足之处在于:①基于我国国情考虑,免疫抑制剂未采用疗效更为确切的来那度胺,无法探究来那度胺联合DAC使更多MDS患者获益;②研究样本选取过少,故确切疗效有待大样本研究加以证实。除此之外,据Dhillon S学者[20]研究指出:Astex Pharmaceuticals公司已开发出一种地西他滨联合西屈祖啶口服片剂,已于国外获批使用,有望成为MDS、急性髓细胞性白血病等疾病首选治疗药物。现关于该药物临床研究于多个国家陆续开展,这可能是以后MDS治疗研究热点所在。
综上所述,应用地西他滨联合沙利度胺治疗MDS,疗效确切,且可改善血象指标,拥有一定T1率,且预后转归表现较好,可作推广普及。

