雾化肺表面活性物质联合无创辅助通气治疗新生儿呼吸窘迫综合征
刘 颖 段顺艳 杜岚岚 王 柱 陈 佳 高薇薇
广东省妇幼保健院新生儿科(广州 511440)
新生儿呼吸窘迫综合征(respiratory distress syndrome, RDS)是肺表面活性物质(pulmonary surfactant, PS)缺乏导致的早产儿常见病,是引起早产儿早期死亡及远期不良预后的主要原因之一[1]。出生后早期PS替代疗法和机械通气可明显降低RDS病死率及相关并发症的发生率,是治疗RDS主要手段[2]]。目前,气管插管给药是临床给予PS的传统方法,但此技术属于有创性操作,并可导致肺部气压伤和容量伤。
越来越多的研究表明分娩后立即使用无创辅助通气(non-invasive ventilation, NIV)可有效减少25~28周早产儿有创通气比例[3],但部分患儿仍会出现NIV失败,需要抢救性有创通气以及PS治疗,从而错过最佳PS给药时机,反而导致患儿病情加重,上机时间延长。对于出生后早期有自主呼吸的RDS早产儿而言,如何在最小创伤情况下给予PS替代治疗从而改善其近期及远期预后是临床目前亟需解决的问题。最新版的欧洲RDS管理指南[1]推荐对在经鼻持续气道正压通气(nasal continuous positive airway pressure, NCPAP)下有自主呼吸的早产儿使用LISA技术给予PS,但如果要实现真正无创给药,雾化肺表面活性物质(aerosolized surfactant, AS)是一种更理想的给药方案。
雾化给药是临床治疗呼吸系统疾病的一种重要手段,最新改良的振动筛网雾化技术,是通过隧道状网格振动产生肺部靶向的低速气溶胶,形成大小约5 μm的雾化颗粒,利于肺泡沉积,该技术已被证明可有效地产生PS的气雾剂,且不会改变其生物物理和生化成分,有数据显示[4],在使用经鼻无创呼吸支持回路中,PS气雾剂输送被证明是可行的。
目前已有动物实验[5]表明,和雾化生理盐水比较,AS可改善兔的动脉血氧分压以及肺顺应性,和气道给药相比,PS经过雾化后在肺部分布更均匀。国外已有部分临床研究[6- 7]显示,在NIV基础上联合AS治疗RDS是安全有效的,AS可降低NIV治疗的RDS患儿气管插管率。此前,我们团队已有相关研究个案报导[8],因此,基于上述理论及实践基础,我们假设,NIV联合早期AS为RDS早产儿初始治疗是可行的,能降低RDS早产儿病死率,减少BPD发病率,改善RDS患儿短期临床结局。为评估此项治疗技术的可行性及安全性,我们开展了此项临床研究。
1 资料与方法
1.1 对象
选取2019年7月—2020年6月在本院出生并立即入住新生儿重症监护病房诊断为RDS的早产儿为研究对象。入组标准:①胎龄≤30周,且出生体质量≤1 500 g;②符合《实用新生儿学》第五版RDS诊断标准[9];③征得父母同意,并签署知情同意书。排除标准:①入院时已气管插管需有创辅助通气;②患儿合并呼吸系统先天性畸形、复杂先天性心脏病、严重宫内感染、循环系统严重不稳定、先天性遗传代谢性疾病和染色体病;③家属拒绝参与;④未能完成研究无法提供完整数据者。本研究系单中心非双盲前瞻性临床初步研究,已获广东省妇幼保健院伦理委员会审批(伦理批件号:广东省妇幼保健院医伦第[201901102]号)。
1.2 方法
1.2.1 临床资料采集:收集所有入组患儿的临床资料,包括:出生胎龄、出生体质量、性别、分娩方式、Apgar评分、是否多胎、母亲孕期是否合并妊娠期糖尿病、妊娠期高血压及胎膜早破、产前是否使用激素。
1.2.2 NIV设备及参数设定[10]:所有入组患儿均初始接受经鼻间歇正压通气(nasal intermittent positive pressure ventilation,NIPPV),使用瑞士ACUTRONIC医疗集团所生产的新生儿婴幼儿呼吸机(型号为FABIAN HFO),鼻塞使用Medin无创双腔鼻导管;起始参数设定为:吸气峰压(peak inspiratory pressure,PIP):15~25 cmH2O、呼气末正压(positive end-expiratory pressure,PEEP):4~6 cm H2O、呼吸频率(respiratory rate,RR):25~40次/min、吸气时间(timed inspiratory,Ti):0.3~0.4 s、流速:8~10 L/min、吸入氧浓度(fraction of inspired oxygen,FiO2):0.21~0.40。目标血氧饱和度(oxygen saturation by pulse oximetry,SpO2): 0.90~0.94。
1.2.3 PS给药方案:入组患儿入室后,在NIV基础上,尽快将振动筛网雾化器系统(型号为Aeroneb Solo,爱尔真有限公司,爱尔兰)与呼吸机管道连接,患儿端连接Medin无创双腔鼻导管,并加压固定封闭口腔。在NIPPV模式辅助通气下,100 mg/kg注射用牛肺表面活性剂(珂立苏,双鹤制药,中国)通过振动筛网雾化器系统随呼吸机气流输送,雾化完毕继续NIPPV模式辅助通气。若AS治疗后72小时内,患儿NIV失败,则给予气管插管改有创辅助通气,并且在插管后常规再次经气管插管给予患儿1次PS 100 mg/kg,结合患儿病情最多累计给予PS不超过3次(备注:若患儿因NIV失败指征中第5条改有创通气,则不常规再次给予PS)。
1.2.4 咖啡因使用:所有患儿常规给予咖啡因(枸橼酸咖啡因注射液,凯西制药,意大利),首剂负荷量为20 mg/kg,维持量为5~10 mg/kg每天。
1.2.5 NIV失败指征[10]:①频繁呼吸暂停,即反复呼吸暂停>3次/h并且心率<100次/min,或者24 h只出现1次但需要复苏囊面罩加压给氧才能恢复,咖啡因治疗不能缓解;②严重低氧血症,即FiO2>0.40,氧分压(partial pressure of oxygen,PaO2)<50 mmHg;③严重呼吸性酸中毒,即二氧化碳分压(partial pressure of carbon dioxide,PaCO2)>60 mmHg,pH<7.20;④进行性加重的呼吸窘迫,FiO2>0.40才能维持正常SpO2;⑤出现肺出血、严重心律失常、休克、频繁抽搐、新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、肠梗阻等NIPPV禁忌症。
1.2.6 撤除NIV指征[10]:当FiO2<0.30, PIP<14 cmH2O,PEEP<4 cmH2O,RR<25次/min时,在此基础上临床症状和血气结果在可接受范围内,维持病情平稳至少12 h可考虑撤离。若患儿完全撤除NIPPV难以维持临床稳定,可由NIPPV模式过渡为高流量给氧模式给予患儿呼吸支持至完全撤机。
1.2.7 早产儿出院标准:纠正胎龄35周以上,体质量达1.8 kg以上,可经口喂养,无需呼吸机辅助通气,临床情况稳定。
1.2.8 观察指标:详细记录患儿AS治疗开始时、雾化后2小时的心率、血压、SpO2;记录上述2个时间点的呼吸机参数及血气分析数据;详细记录患儿入组3天内需气管插管的例数,PS用量,无创通气时间,有创通气时间,需氧时间,住院时间,住院费用,死亡病例数、AS治疗中断情况。详细记录患儿出现支气管肺发育不良(bronchopulmonary dysplasia,BPD)、早产儿视网膜病变(retinopathy of prematurity,ROP)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、有血流动力学改变的动脉导管未闭(patent ductus arteriosus,PDA)、Ⅲ级以上颅内出血(intraventricular hemorrhage,IVH)/脑白质软化、早发型败血症(early-onset sepsis,EOS)等主要并发症例数,以上疾病诊断标准均参照第五版《实用新生儿学》。
1.3 统计学分析
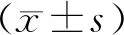
2 结 果
2.1 入组患儿基本信息
2019年7月—2020年6月共有20例RDS早产儿纳入研究,这20例患儿一般情况如下:胎龄25+2~30周,出生体质量790~1 500 g,男12例,女8例,多胎10例,单胎10例,剖宫产8例,顺产12例。出生时1分钟Apgar评分中位数为8(6~9),5分钟Apgar评分中位数为9(8~10)。入组患儿中有12例出生后即接受了NCPAP辅助通气。20例早产儿中,母亲孕期合并妊娠期糖尿病10例,合并子痫前期3例,胎膜早破超过18小时10例,产前使用激素18例。所有患儿均在AS后使用咖啡因防治呼吸暂停。
2.2 患儿AS治疗前后生命体征、呼吸机参数及血气分析结果比较
和雾化前数据比较,雾化后2小时的患儿心率下降、SpO2较前升高(P<0.05),但外周血压平均压及呼吸机参数则无改变(P>0.05);此外,监测的血气分析指标均有改善,雾化后2小时PaO2、pH较雾化前升高,PaCO2则降低,差异有统计学意义(P<0.05),见表1。
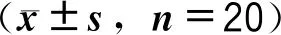
表1 患儿AS治疗前后生命体征、呼吸机参数、血气分析结果比较
2.3 患儿治疗过程以及主要并发症发生情况
纳入研究的20例患儿中,共有5例患儿在AS治疗后3天内需气管插管有创通气。在这5例患儿中,1例因大量气胸未给予第2剂PS,1例累计给予300 mg/kg的PS,其余3例则给予200 mg/kg的PS。5例患儿中,1例早期合并大量气胸,其余4例中均合并EOS;1例未诊断BPD,1例因生后不足28天即死亡,未达到诊断BPD节点,另外3例均合并有中重度BPD以及ROP。1例因NEC在生后26天死亡,其余19例均治愈出院。
而在AS治疗后3天内未出现NIV失败的15例患儿中,仅有1例合并EOS,有4例患儿出现BPD(3例为中重度BPD,1例为轻度BPD),有7例出现了不同程度的ROP,2例因NEC改为有创通气,其中有5例没有任何严重合并症。
所有患儿未在AS治疗过程中因出现呼吸心跳骤停、血压下降、频繁呼吸暂停等严重不良反应而中断AS治疗,管床护理人员均表示AS治疗未增加临床护理负担,见表2。
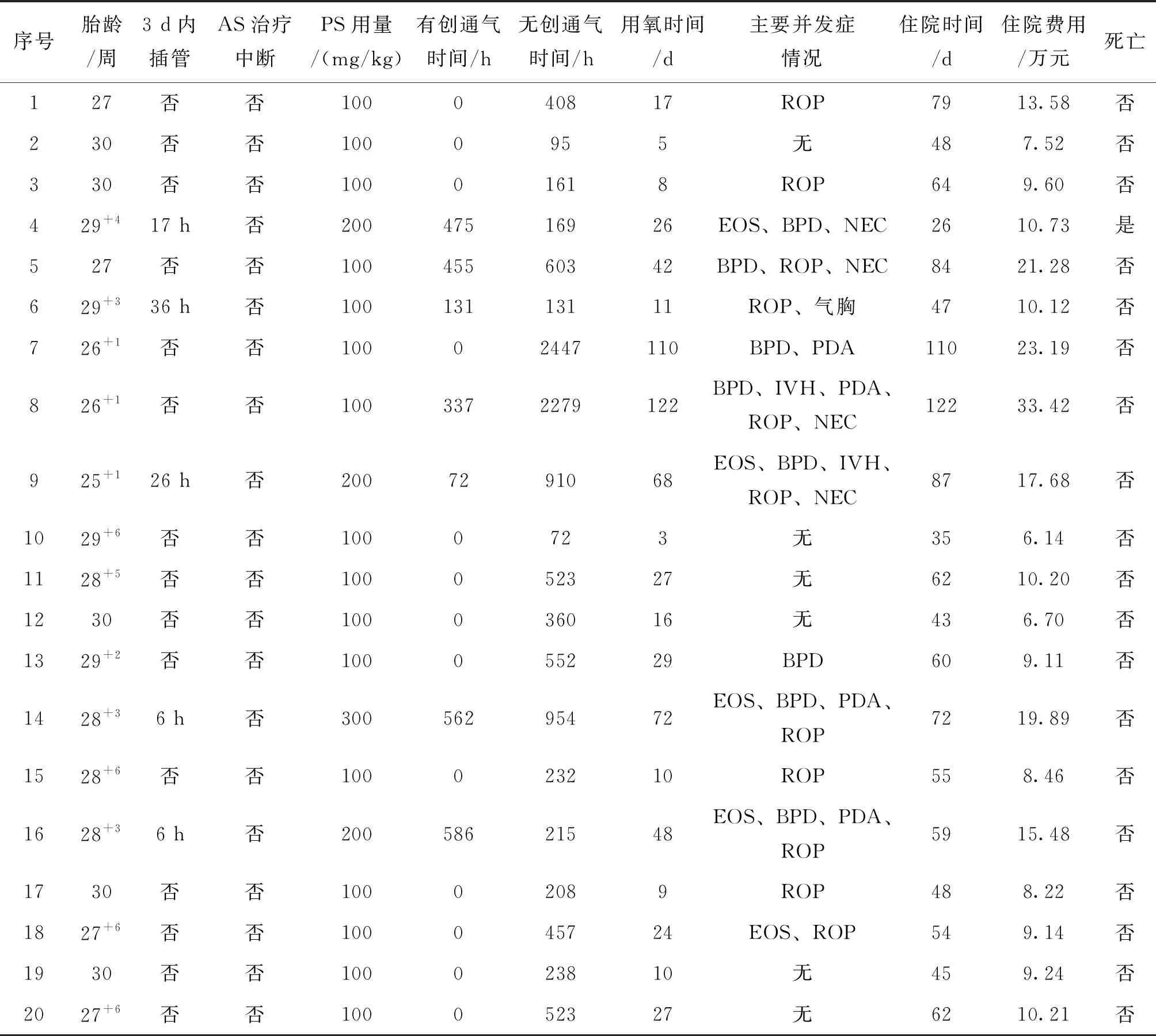
表2 20例患儿主要临床数据汇总
3 讨 论
本文总结汇报了一项非双盲的、非随机对照的初步临床试验,是目前国内首项关于AS联合NIV初始治疗RDS早产儿的临床研究,用以评估其在生命早期对RDS 极低/超低早产儿的临床治疗情况。
从1964年开始就有研究人员开展AS相关临床研究,Berggren E[11]等人在2000年使用射流雾化器系统对RDS早产儿进行AS治疗临床研究结果显示AS组NIV失败率为37.5%,和单纯NIV治疗相比,AS无明显临床治疗效果。2010年Finer[12]等给予胎龄28~32周RDS早产儿在NCPAP基础上通过爱尔真振动筛网雾化器系统进行AS,结果显示4小时后患儿平均需氧浓度由0.40降至0.32,29.4%的患儿在AS治疗后NIV失败。2018年Minocchieri S等[13]进行的一项随机双盲对照研究结果显示,胎龄29~33+6周的RDS早产儿在NCPAP辅助通气下,AS治疗组约有33.3%的患儿在3天内需气管插管,失败率较单纯NCPAP治疗组有明显下降。我们的研究结果显示,胎龄25+1~30周RDS早产儿在NIV基础上接受AS治疗后,25%的患儿3天内出现NIV失败,失败率均低于上述临床研究的干预组。Sood BG等[14]在2019年报道的一项AS临床研究中,一共有17名胎龄24~36+6周RDS患儿参与,患儿在接受干预后,心率下降(148次/分 vs 145次/分),末梢血血气分析PaCO2下降(51 mmHg vs 46 mmHg)、pH值改善(7.31 vs 7.34),但SpO2、FiO2及血压平均压在治疗前后无明显差异。我们此次的研究结果也显示, RDS早产儿在接受AS治疗后,心率和末梢血血气分析PaCO2与雾化前相比明显降低,SpO2和末梢血血气分析PaO2、pH值较前有明显升高,并且在研究干预期间,血压保持稳定,没有出现心跳呼吸骤停、频繁呼吸暂停等干预操作的明显临床不良反应,与上述研究结果类似。以上结果均初步提示AS治疗确实可给RDS早产儿带来一定的益处,并且我们的研究结果比前述研究结果更理想。
通过比较研究方案,发现本研究治疗效果更好的原因之一可能是本研究所使用的雾化器系统有所改进,此次研究中使用的是改良的振动筛网雾化器系统,与Sood BG等[6]在2021年最新发表的研究中所使用的雾化器系统相同。有动物研究结果显示,在接受婴儿模式有创通气治疗时给予不同雾化器进行雾化,通过振动筛网雾化器系统给药,肺部的药物沉积率可达12.6%,明显高于普通的射流雾化器系统的药物沉积率(0.5%)[15]。并且有研究结果显示,我们使用的振动筛网雾化器系统利用自身隧道状网格振动产生小颗粒低速气溶胶,可增强PS向患儿呼吸系统的定向输送,不会引起蛋白质变性或稀释[16- 18]。此外,Minocchieri S等[13]的研究中使用面罩作为患儿的接口,而在本研究中,我们使用短的双腔鼻导管作为患儿接口。尽管两种接口方式都已证明可成功进行雾化治疗,但体外研究[19- 20]显示在新生动物中和经口雾化药物向肺部给药相比,鼻腔给药更具有优越性。新生儿对鼻导管的耐受性更好,特别是当雾化治疗需要持续一段时间时。此外,双腔鼻导管更利于临床医护人员的操作,更能保持呼吸通路的密闭性,不会增加局部组织的损伤。且该雾化器系统是由电驱动,通过呼吸管路中的气流进行输送,不需要额外的气流作为动力,操作简便易行。在我们的此项研究中,护理人员均表示AS治疗没有增加临床护理难度,也没有增加患儿局部压疮风险。
此外,我们的研究结果显示无创辅助通气失败均发生在AS治疗6小时以后,Minocchieri S等[13]的数据同样显示AS干预组平均无创通气失败的时间节点大约出现在生后11.6小时,比单纯NCPAP组延后4.5小时,以上研究结果表明部分患儿可能在生后6小时之后需要再次供给PS,初步考虑可能与外源性PS在体内代谢过程有关。另外,本项研究和以往研究不同的是我们使用的PS制剂为我国自主研发的天然剂型牛肺表面活性制剂,本研究中AS治疗效果和既往研究类似,但国产PS制剂费用低,更利于在临床推广。
尽管我们的研究结果初步显示AS治疗对RDS早产儿有一定效果,并且安全易执行,但由于本研究纳入的患儿病例数较少,是一项非双盲研究,也未能设置对照组,因此无法对AS治疗的临床效果进行有效分析评价,且对于AS治疗的安全性方面的评估主要依赖于临床生命体征观察,尚缺乏脑氧饱和度监测、脑血流监测、心功能监测等相关数据佐证。我们计划进一步完善研究方案,开展前瞻性随机对照双盲临床研究,为评估AS治疗提供更有效更全面的数据。
综上,AS治疗和NIV的非侵入性组合与新生儿呼吸管理的最新趋势一致,但仍需要更多更进一步的前瞻性随机对照临床研究来证实。

